帕金森病脑深部刺激疗法中STN靶点定位方法综述
曾雪,胡春华
(清华大学航天航空学院,北京 100084)
引言
帕金森病(Parkinson’s Disease, PD)是一种多发于中老年人的神经系统变性疾病,症状表现为动作缓慢,手脚或身体的其他部分震颤,身体僵硬等,给患者带来巨大的身心痛苦和经济负担。在DBS疗法中,电刺激依靠植入式的脑部神经电刺激器实现,作用于患者大脑深部的功能区域,达到治疗效果。医生需要通过术前或术中的各种方法得到STN的位置信息从而进行脑起搏器植入和治疗。
1 DBS疗法与脑深部核团定位
当前,帕金森病有三种治疗方法:药物、毁损手术、脑深部电刺激(DBS)[1~3]。其中,脑深部电刺激治疗疗效确切、安全、可逆,是目前国际公认的最佳外科治疗方法。在这种疗法中,电刺激依靠植入式的脑深部刺激器实现。脑深部刺激器的基本工作原理是:在患者大脑功能部位(一般是丘脑底核,STN)靶点植入刺激电极,由埋植于皮下的延长线将电极和埋植在胸前的脉冲发生器相连,脉冲发生器发出指定频率、强度的刺激电脉冲,作用于患者大脑深部的功能区域,达到治疗效果。
电刺激靶点STN位于间脑底部,解剖上看,其形状呈双凸透镜状,长径10~12mm,短径4~6mm,位于运动丘脑的下方。丘脑底核的中心位于AC-PC线下方约4mm处。STN内部可分为运动亚区和非运动亚区,后者又包括边缘系统相关亚区、连带运动区和眼球运动区。周围有内囊、内侧丘系、未定带、下丘脑-黑质网状部等组织,最佳靶点普遍认为位于运动亚区中心部。
STN脑深部刺激手术不但能够消除顽固性震颤、缓解迟缓、僵直、运动功能紊乱等,还可以减少药物用量及各种副作用[4,5]。手术治疗帕金森氏病效果如何,并发症多少,关键在于手术靶点定位准确程度。
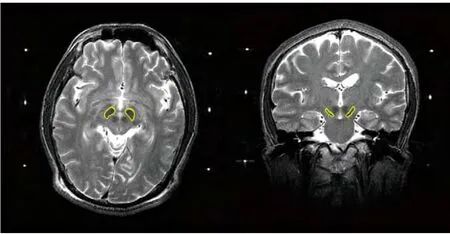
图1 STN解剖位置示意图Fig. 1 Anatomical Position of STN
2 STN定位方法
世界上第一例治疗帕金森氏病的脑立体定向手术于1947年由美国神经外科专家完成,并取得一定效果,当时定位依据主要是X线脑室造影。1967年左旋多巴问世后,立体定向手术治疗帕金森病则步入低谷。70年代后期,随着神经影像学、立体定向和电生理技术的进步,科研人员对手术靶点的选择进行了新的探索。90年代末,帕金森外科手术治疗再次成为国际广泛应用的治疗方法,较高分辨率的CT或MRI立体定向系统被应用于靶点定位上,同时,微电极记录技术也逐渐被医生接受,成为目前临床的主流技术。
本文经过对近年来DBS手术靶点定位的调研,将STN定位分为生理层面的微电极记录以及解剖层面的医学影像两类方法,并进行归纳介绍。
2.1 微电极记录法( Microrecordings)
微电极记录技术是指对指定部位进行微电流刺激,记录其诱发电信号,经过分析得到刺激部位是否为真实靶点。微电极技术的发展使靶点的定位由解剖定位飞跃到功能定位,手术疗效也有了质的改变。微电极技术发展到今天,已能记录到单个细胞的细胞外电活动,可辨认其结构和确定毁损范围。
2.1.1 细胞生物电原理
作为细胞生物电的一个基本特点,是同一个细胞的动作电位大小和形状具有一致性。微电极记录到的放电细胞的多少与其阻抗密切相关,阻抗较大(>1MΩ)时容易记录到单细胞的放电,甚至细胞内膜电位;阻抗较小(<10KΩ)时记录到的是场电位,用于集合电位(如诱发电位)的记录[6]。
手术中使用的微电极,阻抗介于二者之间,多数情况下记录到的是多细胞放电(multiple neuronal firings)。多细胞放电在术中容易导致放电频率的误读,并由此导致术者对靶点位置的误判,尤其需要医生根据丰富的经验进行判读[7]。考虑到上述因素,放电频率的计算,应通过动作电位的大小和形状甄别单细胞放电。现在的一些计算机软件不难完成术后数据的分析,得出可信的结论。
2.1.2 单细胞电记录法
单细胞电记录法是先根据理论分析或者MRI成像确定一个大致坐标,然后记录其周围10~15mm路径上的单细胞电生理情况。术中的电生理图绘制通过使用微电极记录单细胞电生理活动,并对放电模式和频率进行分析。
其临床使用的一般步骤是[8]:首先对患者进行局部麻醉,在头部固定立体定向头架。然后对患者进行CT或MRI扫描,根据图像结果,完成STN粗定位。在颅骨打洞,向靶点方向插入微电极。最后根据国际微电极记录技术标准,对核团进行电刺激,使用专门的信号采集识别软件,辨识STN的位置信息。

图2 拜谱公司的电生理微电极记录系统(图片来自http://www.bioon.com.cn/product)Fig. 2 The physiological microelectrode recording system of Bio-Equip company (From http://www.bioon.com.cn/product)
使用单细胞电记录法,一般会造成手术时间延长,并且通常会记录到不止一个细胞的电活动,将其作为单细胞放电进行分析,引起一定的误差。
2.1.3 多细胞电记录法
在单细胞电记录的基础上,也有学者尝试使用多细胞电记录的方法进行靶点定位。其依据原理是,STN的边界处,多细胞电记录信号振幅会显著增加,根据实验数据,STN内部的放电幅值高于1mV,而外部约为0.6~0.8mV,据此判断STN边界[9]。
多细胞电记录的流程与单细胞电记录相似。所使用的电极直径稍大,采集到的多细胞放电情况通过相应软件进行处理,从而得到每处的电信号幅度以及放电神经元数目,进行边界判定。
对于STN定位方法一直有很大争议。目前多细胞电记录法使用的还比较少。其缺点在于,多细胞电记录的空间分辨率较低,不能具体辨别某个神经元的放电情况。其优点在于,这种方法可以确定在一定区域内放电的神经元的数量。通过此方法,除了可以定位STN靶点,还可以得到STN的长度、周围神经元的放电幅值特点等信息。
此外,也有研究者提出利用多通道的电极进行记录[10],在短时间内获得更多的信息,并且运用阵列数据处理技术对所得到的数据进行处理分析,也取得了不错的实验进展。
在帕金森症的外科手术治疗中,关于微电极记录技术的争论一直存在。诸如微电极技术是否需要,是否可以临床常规应用,该技术是否会增加脑出血危险性等等,此外,由于各种原因是否会延长手术时间,对这些争论,现在还没有一个准确的结论[11]。
微电极技术的优点在于,对微电极记录技术富有经验的医生来说,使用微电极记录并观察信号特征,能够对靶点边界进行较为准确的定位,尤其是苍白球目标靶点,能达到微电极制图,因此他们推荐使用微电极记录技术。
但对微电极记录持否定态度的医生认为,微电极记录获得的定位信息是以增加记录过程中可能出现的手术时间过长、脑出血等并发症为代价,得不偿失,因此他们不建议推广使用微电极记录,希望寻找更安全更准确的定位方法。
尽管如此,微电极技术仍然是目前最直接最准确的定位方法,目前在临床上使用较为广泛。
2.2 医学影像法
医学影像学的定位方法由来已久,并且随着成像技术的发展,成像质量越来越高,在DBS手术中有着越来越重要的应用价值[12]。尸脑解剖的图谱或者MRI扫描健康人形成的脑图谱是临床定位的依据。
根据时间顺序,分三个阶段对医学影像定位的方法进行简要介绍。
2.2.1 阶段一:尸体解剖标本或MRI人脑图谱
外科手术初期,中国活体人脑图谱尚未出现,一般认为Schaltenbrand & Wahren图谱是最适用于中国人大脑的图谱。2009年,哈尔滨医科大学的林志国等人根据120例健康中国自愿者人脑立体定向MR图像,在标准的立体定向空间内,制作成标准的中国活体人脑立体定向MR解剖图谱,是第一本中国活体人脑立体定向MRI数字化、可视化解剖图谱[13]。

图3 Schaltenbrand and Wahren 图谱示意图Fig. 3 The Schaltenbrand and Wahren atlas
此外,解剖学切片标本也具有重要的参考价值。解剖学冠状切片由死亡48小时之内的尸体,用10%福尔马林定影1个月制作而成[14]。如下图。根据对标本的分析测算,得到脑组织各部分的位置关系,是外科医生认识大脑组织的重要手段。一般根据AC-PC线,可推断和找到STN靶点的位置。
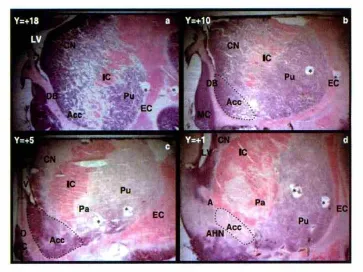
图4 解剖切片示意图Fig.4 Diagram of anatomy slice
2.2.2 阶段二:基于高分辨率的CT或MR影像
神经影像学的进步使脑内结构的分辨率不断地提高,医生可以在直视下识别并计算核团或纤维束的三维坐标,完成解剖定位。上述阶段一中通过标准图谱推算靶点位置的方法,正逐渐被淘汰。
MRI以其较高的分辨率优于其他的影像学定位。近年来,国际上采用CT进行定位的越来越少。利用MRI的高分辨率和CT的良好线性,进行图像融合(image fusion)的技术则是更高的境界。
CT与MRI的出现极大的推动了核团切开术影像定位技术的发展。高场强的磁共振具有无损伤,组织分辨率高等优越性,磁共振脑正中矢状位上可以清楚地显示脑内标志性结构—前连合(AC)与后连合(PC)。以AC-PC的连线为基准定位VL核、GPi与STN等核团的三维坐标,是目前广泛采用的解剖定位技术。在所得图像基础上,还可以使用立体定向仪,对脑内靶点进行精确坐标定位[14]。使用MRI扫描与多层重建技术,可以根据手术需要取任何方向重建任意层次的影像,在最理想的层面上取靶点坐标数据。但也有影响坐标数据出现误差的可能,例如框架的机械精度、CT或MRI的扫描层厚及术中出现脑脊液丢失较多、脑组织移位的情况等。
2.2.3 阶段三:基于图像处理技术的手术导航规划系统
在脑部图像的处理方面,MRI和CT的融合是一个重要的研究方向。多种成像模式提供的信息常常具有互补性,为了综合使用多种成像模式以提供更全面的信息,常常需要将有效信息进行整合。图像融合(Image Fusion)是指将多源信道所采集到的关于同一目标的图像数据经过图像处理和计算机技术等,最大限度的提取各自信道中的有利信息,最后综合成高质量的图像,以提高图像信息的利用率、改善计算机解译精度和可靠性、提升原始图像的空间分辨率和光谱分辨率,利于监测。整合的第一步就是使多幅图像在空间域中达到几何位置的完全对应,这一步骤称为“配准”。整合的第二步就是将配准后图像进行信息的整合显示,这一步骤称为“融合”。
DBS手术中,将采集得到的CT扫描图像与MR图像进行图像配准与融合,提高了图像的分辨率,便于进行目标核团的观测和定位[15,16]。
示意图如图5。
该定位方法对软件配准算法和融合算法都有很高的要求[17]。一般借助于已有的手术导航系统,把采集的数据进行配准融合,得到靶点位置信息,同时设置电极刺激参数,完成手术规划和后续治疗规划[18~20]。
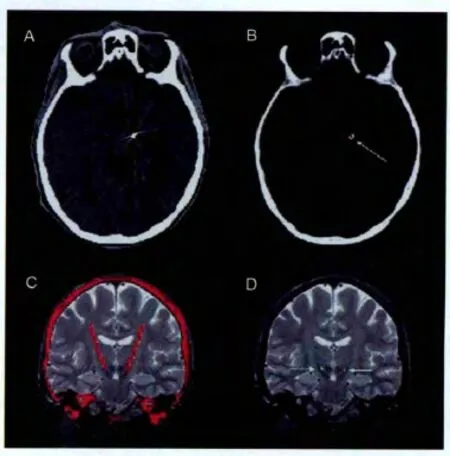
图5 CT-MRI配准融合示意图Fig. 5 Registration and fusion of CT-MRI
这套方法的意义在于,术后可以只做CT扫描,避免了术后的MR扫描[8]。之前的研究大多希望通过术后MRI成像来得到STN靶点位置信息。但是这种方法会产生两个缺点。其一是,植入的电极会使得MRI图像失真[21],加上开颅手术造成的脑漂移[22],从而造成对STN及电极的定位都不准确。其二是,术后MRI会造成电极发热等后果,安全性不高。因此,用CT-MRI融合来确定术后的电极位置更为合适。
3 结束语
在本篇综述中,将DBS手术中STN靶点定位的方法按照生理层面和解剖层面分为两类,分别是微电极记录法和医学影像法。微电极记录法较为经典,目前临床上依然被广泛采用;而随着各种成像技术、手术导航系统的发展,医学影像法的应用也会越来越多。
微电极法的优点在于它的直接性和准确性,使用微电极在术中对组织进行实时记录并观察信号特征,能够对靶点边界进行较为准确的定位,尤其是苍白球目标靶点,能达到微电极制图的水平。同时,这种方法也有许多争议和局限性。首先,它对外科医生的微电极记录经验和操作水平要求很高。其次,使用微电极,势必会增加手术时间,并有可能导致脑出血等并发症,其风险性较难评估。
医学影像学的定位方法由来已久,并且随着成像技术的发展,成像质量越来越高,在DBS手术中有着越来越重要的应用价值。这种方法的优点是,定位过程不需要额外的手术操作,安全无风险;降低了对医生实时记录细胞电信号的严苛技术要求,很大程度上实现了手术可视化。然而与精确直接的电记录法相比,医学影像法的缺点在于成像质量和精度有待提升;由于开颅手术以及病人姿势改变,会造成脑漂移,一定程度上影响了图像靶点定位的准确性等等,这些都需要继续改进。从最初的二维解剖图谱,到现在的MRI成像和三维手术导航系统,可以预见,未来的DBS手术中,数字化医疗一定会扮演非常重要的角色。
[1]Alkhani A, Lozano A. Pallidotomy for Parkinson's disease: a review of contemporary literature. Journal of Neurosurg, 2001, 94 (1): 43-49.
[2]Eskandar E N. Stereotactic pallidotomy performed without using microelectrode guidance in patients with Parkinson's disease:surgical technique and 2 years results. Journal of Neurosurg, 2000,92: 375- 383.
[3]郝斌. 丘脑底核核磁共振三维重建与脑深部电刺激治疗帕金森病的相关研究. 第二军医大学,2008.
[4]Peter A, Pahapill, O'Connell B. Long-Term Follow-Up Study of Chronic Deep Brain Stimulation of the Subthalamic Nucleus for Cervical Dystonianer. Neuromodulation, 2010, 13(1): 26-30.
[5]Young S P, Joopyung K, Won S C, et al. Management of a DBS System in Patients With Traumatic Brain Injury: Case Reportner.Neuromodulation, 2011, 14(1): 214-218.
[6]张日辉. 实用电生理基础(学术前沿研究). 北京师范大学出版社, 第1版, 2011年1月1日.
[7]Aage R Moller著, 窦万臣译. 术中神经电生理监测. 人民卫生出版社, 第1版, 2009年12月1日.
[8]Shin M, Lefaucheur J P, Penholate M F, et al. Subthalamic nucleus stimulation in Parkinson's disease: Postoperative CT-MRI fusion images con fi rm accuracy of electrode placement using intraoperative multi-unit recording. Clinical Neurophysiology, 2007, 6: 457-466.
[9]D' Haese P F, Pallavaram S, Niermann K, et al. Automatic selection of DBS target points using multiple electrophysiological atlases.Proceedings of MICCAI, 2005: 427-434.
[10]Snellings A, Anderson D J, Aldridge J W. Use of Multichannel Recording Electrodes and Independent Component Analysis for Target Localization in Deep Brain Structures. Proceedings of the 1st International IEEE EMBS Conference on Neural Engineering Capri Island, Italy- March, 2003: 20-22.
[11]胡小吾, 周晓平, 王来兴, 等. 苍白球腹后部毁损术中的靶点定位方法探讨. 第二军医大学学报, 2001, 22(8): 755- 757.
[12]Foltynie T, Zrinzo L, Martinez-Torres I, et al. MRI-guided STN DBS in Parkinson's disease without microelectrode recording:ef fi cacy and safety. JNNP, 2011, 82(4): 358-363.
[13]林志国, 付宜利, 刘鹏飞. 中国人脑立体定向MRI解剖图谱.上海:上海科学技术出版社,2008.
[14]Lia L N, Edson O, Correia F, et al. The Human Nucleus Accumbens:Where Is It? A Stereotactic, Anatomical and Magnetic Resonance Imaging Study. Neuromodulation, 2008,11(1):13-22.
[15]Van den Elsen P A, Pol E J D, Viergever M A. Medical image matching-A review with classi fi cation. IEEE Eng. Med. Biol., 1993,12(1): 26-39.
[16]Pluim J P W, Maintz J B A, Viergever M A. Mutual-informationbased registration of medical images: A survey. IEEE Trans. Med.Imag., 2003, 22(8): 986-1004.
[17]Villéger A, Lemaire J-J, Boire J-Y. Localization of Target Structures through Data Fusion Applied to Neurostimulation. Proceedings of the 2005 IEEE Engineering in Medicine and Biology 27th Annual Conference Shanghai, China, September 1-4, 2005.
[18]Castro F, Pollo C, Meuli R, et al. A Cross Validation Study of Deep Brain Stimulation Targeting: From Experts to Atlas-Based,Segmentation-Based and Automatic Registration Algorithms. IEEE Trans. on Medical Imaging, 2006, 25(11): 1440-1450.
[19]胡小吾, 周晓平. 帕金森病的核团毁损术和脑深部刺激术研究进展. 中国微创外科杂志,2002, 2(4): 266-268.
[20]周晓平, 胡小吾, 姜秀峰, 等. 立体定向手术治疗帕金森病的临床研究. 第二军医大学学报, 2005, 26(2): 198-201.
[21]Ramya B, Welch E B, Benoit M D, et al. Effect of MR Distortion on Targeting for Deep-Brain Stimulation. IEEE Transactions on Biomedical Engineering, 2010, 57(7): 1729-1735.
[22]Toshiki O, Yoichi K, Kobayashi K, et al. Direction and Predictive Factors for the Shift of Brain Structure During Deep Brain Stimulation Electrode Implantation for Advanced Parkinson's Disease. Neuromodulation, 2008, 11(4): 302-310 .

