肾及肾透明细胞癌多b值扩散成像的单双指数拟合比较
王雪元,邢伟,胡春洪,丁玖乐,陈杰,孙军
1.苏州大学附属第一医院影像科,苏州 215000
2.苏州大学附属第三医院 (常州市第一人民医院) 影像科,常州 213003
肾癌是最常见的肾脏占位性的恶性肿瘤,有时与乏脂性错构瘤鉴别诊断困难。目前很多学者报道了扩散成像技术(diffusion weighted imaging,DWI)在肾脏病变方面的应用[1-2]。但是都是基于组织信号的衰减呈单指数模型。据报道,很多腹部器官或组织的多b值衰减信号受到微灌注的影响,随着b值的增大呈非单指数函数衰减[3]。双指数函数分析属于最多见的一种。虽然有学者报道其在肾脏占位性病变和慢性肾病病变中的应用[3-4],但均未有学者从统计学的角度比较说明:是否双指数函数更适合描述肾实质和肾占位性病变的DWI信号随b值的变化?因此,笔者回顾性分析肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)患者的多b值DWI,比较肾实质和CCRCC的单指数和双指数函数拟合度,探讨更适合描述肾实质和CCRCC的DWI信号随b值变化的数学函数模型。
1 材料与方法
1.1 一般资料
回顾性分析2011年7月至2012年4月在我院行MRI检查并经病理证实的肾透明细胞癌患者32例,其中男23例,女9例,中位年龄58岁。所有患者的多b值DWI成像资料,经过仔细对比未见明显呼吸运动伪影。
1.2 MR扫描方法
采用Siemens Verio 3.0 T超导型成像仪。所有的患者在取仰卧位,采用腹部相控线圈采集信号。MR扫描方法包括用于定位的常规序列和多b值DWI,最后行增强横断面T1WI扫描。常规序列包括:冠状面和横断面的T2WI(采用半傅立叶采集单次激发快速自旋回波序列:TR 700 ms,TE 96 ms,层厚6.0 mm,层间距0.6 mm);横断面的T1WI (快速扰相梯度回波:TR 161.0 ms,TE 2.5 ms,层厚6.0 mm,层间距0.6 mm)。7个b值 的横断面EPI-DWI,采用了局部斜位多层面技术实现小视野(field of view,FOV)成像,b值分别为0、200、400、600、800、1000、1200 s/mm2,TR 3100 ms,TE 76 ms,采集带宽1158 Hz/Px,FOV 280 mm× 86 mm,矩阵216×40,回波链40,层数12,层厚6.0 mm,层间距0.6 mm,RF激励类型 Low SAR,自由呼吸状态下扫描。增强序列[2D-T1WI增强序列,扫描参数同上;对比剂使用Gd-DTPA(广州康臣药业有限公司生产),用量0.2 ml/kg,注射流率为2 ml/s)。
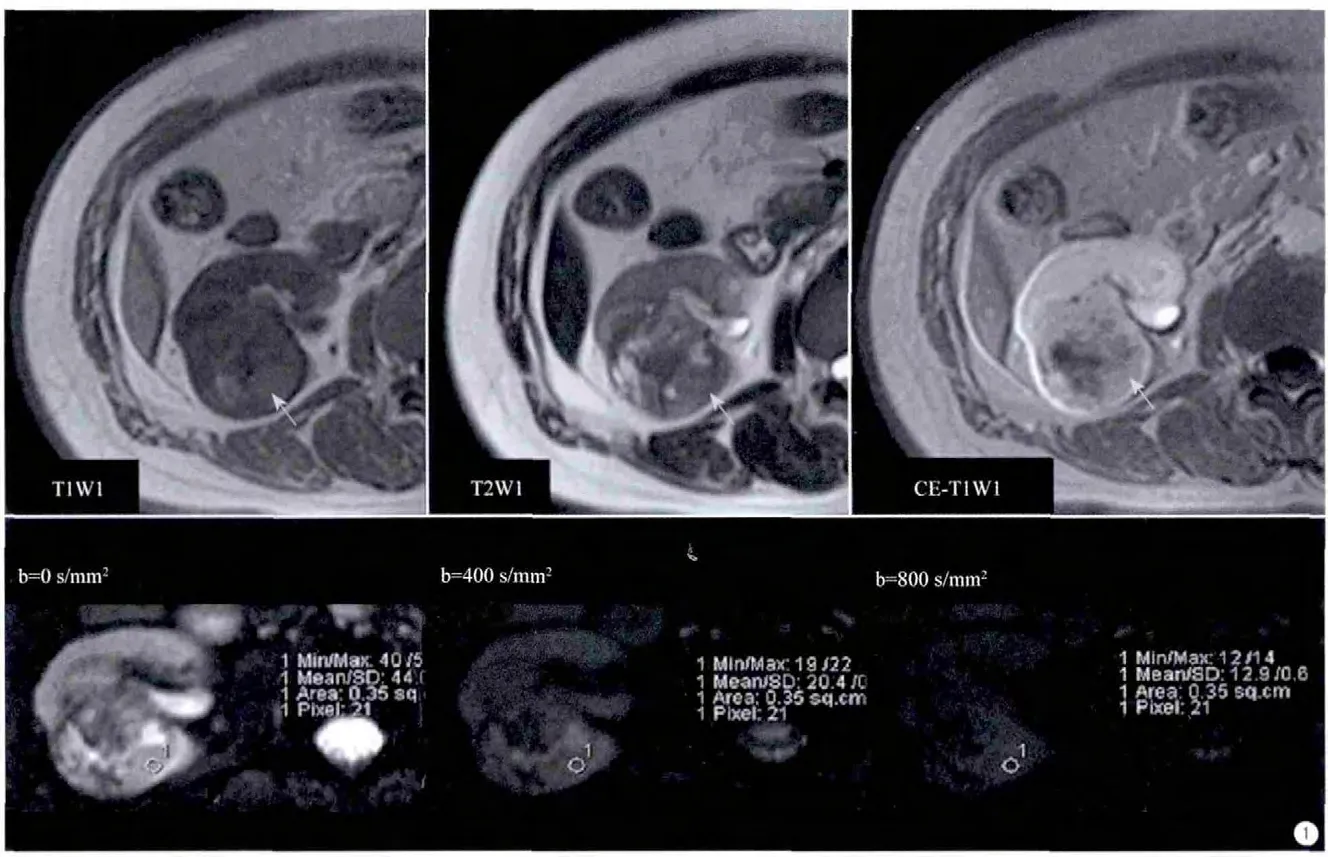
图1 男,70岁,右肾CCRCC。参照常规序列:等T1、等T2信号、明显强化区(箭),在多b= 0 s/mm2的DWI中选择CCRCC实质区的ROI,然后复制到其他b值的DWI中Fig.1 A 70 years old man with right CCRCC.The local focus of mass manifest as isointensity on T1WI and T2WI and marked enhanced (arrow).A ROI was spotted on the diffusion images at b=0 s/mm2, and was copped to others at the same plane but with different b values.
1.3 图像分析
所有的影像学资料由1名高年资医师在不知研究背景的前提下分析图像。分别在两种组织中勾画感兴趣区(region of interesting,ROI),分别为:(1)肿瘤实质;诊断标准:参照常规T1WI和T2WI呈等或低信号,增强后明显强化(图1);(2)肾脏实质。人类肾脏具有分叶结构,分叶间可见肾柱,为了避免干扰,此研究采用肾脏皮质代表肾脏实质。根据以上标准,在DWI (b=0 s/mm2)的图像中勾画ROI约0.35 cm×0.35 cm~0.45 cm×0.45 cm,然后复制到同层的其他b值图像中,分别依次记录不同b值的DWI信号强度。
1.4 数据分析
由于正常肾实质的DWI信号强度在高b值时更容易出现信噪比不足的可能,根据以往的图像处理经验,将两种组织的各b值(≤800 s/mm2,即5个b值)的DWI信号强度依次录入到GraphPad Prism软件包(http://www.graphpad.com),分别采用单指数(公式1)、双指数拟合(公式2),得到各两种拟合方法的拟合度定量参数R2[5]。
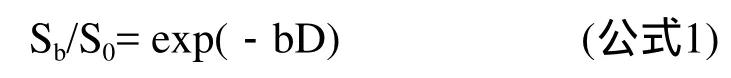

公式中,Sb为相应b值时的DWI信号强度,S0为b=0 s/mm2时的DWI信号强度,b为扩散因子,单位是s/mm2;Dfast、Dslow分别是快慢两种成分的扩散系数;F分别为快慢两种成分中快的成分所占的百分比;exp为指数函数运算。
1.5 统计学分析
各参数采用采用中位数(四分位区间)表示,同一种组织两种拟合方法间R2的比较采用Wilcoxon检验;同一种拟合方法两种组织间的R2比较采用Mann-Whitney检验。数据统计采用SPSS 13.0软件分析,当P<0.05时,认为有统计学差异。
2 结果
图2表明,肾脏CCRCC和肾实质的DWI信号强度均随着b值的增大而减小。经过单指数拟合,两种组织在各b值区的DWI信号变化均不能与拟合曲线重叠。但是经过双指数拟合后,两种组织的DWI信号变化基本与拟合曲线重叠。
32例肿瘤实质区的多b值DWI信号衰减的单、双指数拟合度参数R2的中位数(75%区间)分别为0.97 (0.96,1.00)和1.00 (1.00,1.00),组间存在统计学差异(W=-253,P=0.00);肾脏实质的多b值DWI信号衰减的单、双指数拟合度参数R2的中位数(75%区间)分别为0.98 (0.98,0.99)和1.00(1.00,1.00),组间存在统计学差异(W=-528,P=0.00)。单指数函数拟合在两种组织间的R2无统计学差异(U=301.5,P=0.26),双指数函数拟合在两种组织间的R2也无统计学差异(U=253.0,P=0.05)。
3 讨论
肾癌是最常见的肾脏恶性肿瘤。据报道,DWI在肾癌的分型[1],甚至是在透明细胞癌的分级中都有重要意义[6]。但是以上的研究成果都是在2个或3个b值的基础上,按照组织的DWI呈单指数函数衰减的理论计算定量参数表观扩散系数。其前提是这种组织的DWI信号随b值的衰减呈现单指数函数关系[7],但近几年的研究发现:胸部、腹腔实质器官的DWI信号随着b值的增加呈非单指数函数变化,其中以采用双指数函数的分析的最为多见[8-10]。因此,本研究以肾脏透明细胞癌患者的多b值DWI资料为研究材料,在统计学层面上定量分析是否双指数函数变化特征比单指数函数更适合描述腹部活体组织的DWI信号变化特征,为DWI间接地反映组织学本质特征奠定基础。
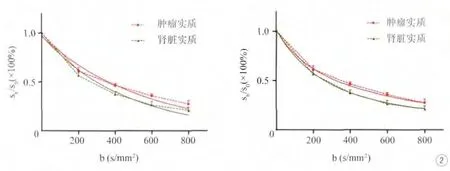
图2 肾实质和CCRCC实质区的多b值DWI信号的单、双指数拟合。随着b值的增大,肾实质(肾皮质)和CCRCC实质区的信号强度逐渐减小。与单指数拟合相比(左图),双指数拟合(右图)的拟合曲线(实线)与中位数连线(虚线)在各b值区的相似程度均有改善Fig.2 The fitting curves of monoexponential and biexponentials model used to multi-b DWI of renal parenchyma and CCRCC.The signal intensity of two tissues declined with increased b values.The fi tting curve of biexponential model (right) can overlap nearly the nonlinear trend of DWI with several b factors, and better than that of monoexponential model (left).
肾实质和CCRCC实质区的DWI信号随着b值的增大而减小。在多b值DWI成像的定量分析前,首先面临的问题是b值选择。当b≤200 s/mm2时,DWI信号减小的更快,多数学者将其理解为微血管灌注所致[4,9-12],而且建议在此b值区采用较小的b值间隔,但是该研究在此b值区只有200 s/mm2一个b值。即使在这样的条件下,双指数函数拟合度R2仍然高于单指数函数拟合,可见这种活体组织内的微血管灌注对低b值DWI的影响比较明显。根据以往肾脏占位的DWI研究,最大b值多选择在800 s/mm2[3]。在本研究中,当b值800 s/mm2时(图1),CCRCC实质区和肾实质的信号明显高于背景信号,满足了图像分析的基本要求。
单指数拟合是目前最常用的扩散成像定量分析的理论。在一般条件下,2个b值即可完成ADC的计算,不仅成像时间短,而且计算过程简单。双指数函数分析则对数据的要求相对较高。采用GraphPad Prism软件包进行双指数拟合,至少需要5个b值对应的DWI信号值,所以使用双指数函数分析的DWI的采集时间明显增加。但是两种方法都有一个共同点,即采用的b值越多,拟合的精度越高,得到的定量参数越准确。本研究中数据分析中恰好采用了5个b值,刚好满足双指数函数分析的。即使在5个b值的条件下,通过配对检验,双指数拟合的拟合度参数R2仍然明显高于单指数函数拟合。因此,有理由认为:双指数函数的数学函数模型更代表肾实质和CCRCC实质区的DWI信号随b值的变化特征。
肾透明细胞癌的分化程度存在差异,而且极其容易坏死,所以感兴趣内可能包含微小的坏死灶。因此推断:CCRCC的异质性比肾脏实质明显,在理论上其拟合精度应该低于肾实质。但统计结果证明:虽然CCRCC的双指数拟合度略低于肾实质,可是尚未达到统计学差异。推测其原因:CCRCC实质区的微小坏死灶较少,同时肿瘤的细胞的分化程度较相似,尚不足以导致明显差异。
本研究也存在一定的不足。首先,肾脏透明细胞癌极其容易坏死,尽管我们尽量避免ROI内存在坏死,但是由于是参考常规T1WI、T2WI及CE-T1WI,仍然不能排除ROI内较小的坏死灶;其次,小b值区(≤200 s/mm2)的b值较少,一定程度上减弱了拟合的精度。
总之,虽然双指数函数的应用前景尚不完全明朗[3],但是双指数函数的数学模型更适合描述肾实质和CCRCC实质区的多b值DWI信号变化特征,为进一步探讨多b值DWI间接反映组织的细胞学特征奠定了基础。
[References]
[1]Tsushima Y, Takahashi-Taketomi A, Endo K.Magnetic resonance(MR) differential diagnosis of breast tumors using apparent diffusion coefficient (ADC) on 1.5 T.J Magn Reson Imaging, 2009, 30(2):249-255.
[2]Sun J, Xing W, Chen J, et al.Correlation between apparent diffusion coefficient value and pathological grading in T1 b clear cell renal cell carcinoma.Chin J Radiol, 2012, 46(8): 682-686.孙军, 邢伟, 陈杰, 等.T1 b期肾透明细胞癌ADC值与病理分级相关性的研究.中华放射学杂志, 2012, 46(8): 682-686.
[3]Koh DM, Collins DJ, Orton MR.Intravoxel incoherent motion in body diffusion-weighted MRI: reality and challenges.AJR Am J Roentgenol, 2011, 196(6): 1351-1361.
[4]Rheinheimer S, Stieltjes B, Schneider F, et al.Investigation of renal lesions by diffusion-weighted magnetic resonance imaging applying intravoxel incoherent motion-derived parameters: initial experience.Eur J Radiol, 2011, 81(3): e310-e316.
[5]Blondin D, Lanzman RS, Klasen J, et al.Diffusion-attenuated MRI signal of renal allografts: comparison of two different statistical models.AJR Am J Roentgenol, 2011, 196(6): W701-W705.
[6]Yu X, Lin M, Ouyang H, et al.Application of ADC measurement in characterization of renal cell carcinomas with different pathological types and grades by 3.0 T diffusion-weighted MRI.Eur J Radiol, 2012,81(11): 3061-3066.
[7]Zhao Q, Zhou GJ, Qing Y, et al.The application of reduced FOV MR imaging in spinaldiseases.Chin J Magn Reson Imaging, 2012,3(4): 275-277.赵强, 周广金, 清源, 等.小视野扩散加权成像技术在脊柱及脊髓病变中的应用.磁共振成像, 2012, 3(4): 275-277.
[8]Koh DM, Collins DJ.Diffusion-weighted MRI in the body:applications and challenges in oncology.AJR Am J Roentgenol, 2007,188(6): 1622-1635.
[9]Lemke A, Laun FB, Simon D, et al.An in vivo verification of the intravoxel incoherent motion effect in diffusion-weighted imaging of the abdomen.Magn Reson Med, 2010, 64(6): 1580-1585.
[10]Luciani A, Vignaud A, Cavet M, et al.Liver cirrhosis: intravoxel incoherent motion MR imaging--pilot study.Radiology, 2008, 249(3):891-899.
[11]Le Bihan D, Breton E, Lallemand D, et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging.Radiology,1988, 168(2): 497-505.
[12]Chen X, Liang CH, Liu ZY.The application of diffusion-weighted magnetic resonance imaging in liver.Chin J Magn Reson Imaging,2013, 4(1): 76-80.陈鑫, 梁长虹, 刘再毅.MR扩散加权成像在肝脏中的应用.磁共振成像, 2013, 4(1): 76-80.

