替吉奥联合吉西他滨一线治疗晚期胰腺癌疗效观察
李 娜,李 薇,何 倩,靳 弟
(1.安徽医科大学第二附属医院,安徽合肥 230601;2.合肥工业大学控释药物研究所,安徽合肥 230009)
胰腺癌起病隐匿,恶性程度高,多数确诊时已属中晚期,可手术的患者仅占15%左右[1]。即使手术,大多数患者仍面临复发,故其生存期短。以化疗为主的综合治疗成为晚期及术后复发胰腺癌患者的主要治疗手段。但目前尚无标准的一线化疗方案,因此,迫切需要寻找有效的化疗药物或合适的化疗方案以改善本病的预后。
1 资料与方法
1.1 病例资料 收集2009年6月至2012年6月我科收治的晚期胰腺癌患者30例,其中男性17例,女性13例,中位年龄61岁,伴肝脏转移11例,腹腔淋巴结转移12例,颈部淋巴结转移2例,肺转移3例。局部晚期3例。体力状况ECOG=0分10例(28.6%),ECOG=1 分20 例(71.4%)。30 例患者中14例接受吉西他滨+S-1方案化疗(A组),16例接受单药吉西他滨化疗(B组)。两组患者在性别、年龄、ECOG评分、原发灶部位、转移部位等方面基本一致,具有可比性(表1)。
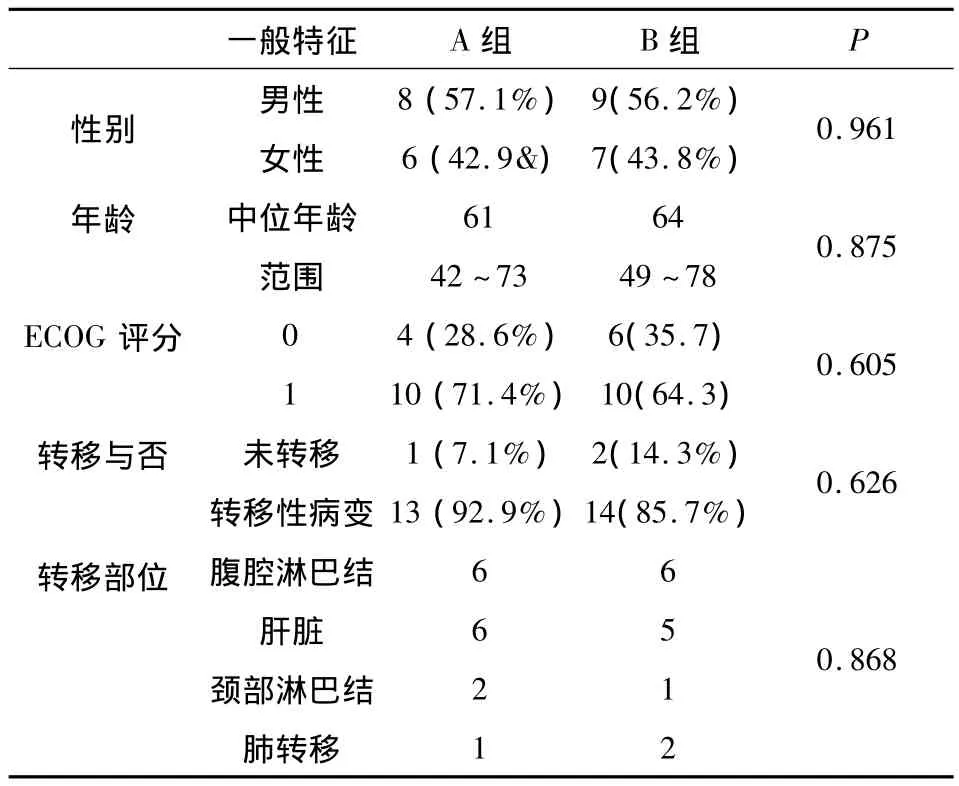
表1 患者一般资料(n=30)
1.2 入选标准 均符合以下标准:组织病理学明确诊断;局部晚期不可切除、术后复发或转移性病变,ECOG评分≤2分,预计生存期≥3个月;年龄18~75岁,能够口服给药;造血功能及心、肝和肾功能均正常;至少有1处CT或MR可测量的病灶;初治的晚期胰腺癌或术后辅助放(和/或)化疗半年后复发的患者。
1.3 排除标准 合并第二原发肿瘤,但经过适当治疗的宫颈原位癌或非恶性黑色素瘤、皮肤癌除外,患有精神疾病者;已知脑或软脑膜转移;伴有严重并发症(活动性消化道出血、肠梗阻)和未控制的内科疾患或感染、同时进行其他非化疗抗癌治疗(骨转移灶的放疗除外)。
1.4 治疗方法
1.4.1 用药剂量 A组方案:分别于第1天,第8天静脉滴注吉西他滨,剂量按1 000 mg·m-2(体表面积),控制每次30 min滴完;同时联合用药替吉奥(S-1),第1到第14天,每日2次,口服给药,按体表面积 <1.25 m240 mg/次,体表面积≥1.25 m2但 <1.5 m250 mg/次,体表面积 >1.5 m260 mg/次;B 组方案:单药吉西他滨第1天,第8天,第15天静脉滴注,剂量按1 000 mg·m-2(体表面积),控制每次30 min滴完。
1.4.2 化疗周期及调整 4周为一个疗程。每2个周期评价疗效,每周期评价毒副反应。对发生2级或以上不良反应(除脱发,恶心,呕吐,和贫血外)时应中断治疗直到不良反应恢复,第一次出现2级不良反应时不需要调整剂量,在第二次出现2级或第一次出现任何3级不良反应时,吉西他滨的剂量减少25%。出现与S-1相关的不良反应,S-1剂量降低20 mg·d-1,除非第一周期治疗后发生疾病进展,至少应接受2个疗程化疗。
1.5 疗效评价 化疗前、化疗2个周期后,或临床可疑肿瘤进展时进行CT或MRI检查。参照实体瘤疗效评价标准RECIST 1.0版对治疗效果进行评价分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。所有的PR和CR均应持续4周。
以CR+PR计算有效率(RR),CR+PR+SD计算疾病控制率(DCR)。PFS定义为从化疗第一天到肿瘤客观进展的时间,OS定义为治疗开始至患者死亡或末次随访的时间。
毒副反应评价:按照美国国立癌症研究院通用毒性标准(NCI-CTC)3.0 版进行评价[2]。
1.6 统计方法 采用 SPSS17.0进行统计分析。试验资料多为计数资料,两组间的比较:非等级资料行卡方检验;等级资料则为秩和检验;显著性水准α=0.05。此外,对长期疗效资料按Kaplan-Meier method乘积限法做生存分析,并对两组的生存率行Log-rank检验。
2 结果
2.1 近期疗效 A组14例患者总计化疗53个周期,平均3.9个周期,1例完成1个周期化疗后因同时发生IV度白细胞减低,IV血小板减低及III度口腔炎,不能耐受而改用其它方案化疗,未能评价近期疗效。B组16例患者总计化疗65个周期,平均4.0周期。A组和B组的RR分别为46.2%和18.8%;DCR分别为76.9%和37.5%。两组近期疗效整体比较(疗效等级资料秩和检验),差异有显著性(p=0.040);疾病控制率比较(卡方检验),也有统计学意义(P=0.034),见表2。

表2 两组患者近期疗效比较
2.2 远期疗效 随访15个月,截止至2013年07月30日,A组1例存活,无失访;B组无存活,2例失访。A组和B组的中位TTP分别为4.4月(95%CI:4.263~6.365 个月)和 3.9月(95%CI:3.669~4.706个月);两组中位 OS分别为9.4月(95%CI:8.167 ~10.71个月)和7.2月(95%CI:7.161 ~9.196月)。
以Kaplan-Meier乘积限法对两组生存资料做生存分析,得 AB两组6月生存率分别为 1.000、0.813;9月生存率分别为 0.615、0.203。显然 A 组明显优出。再经 Log-rank检验:χ2=5.33,P=0.021;精确 χ2=7.71,P=0.005,均提示试验组与对照组差异有显著性。
两组生存期资料见表3,生存分析见表4,Kaplan-Meier曲线见图1。

表3 两组生存期具体数据/月
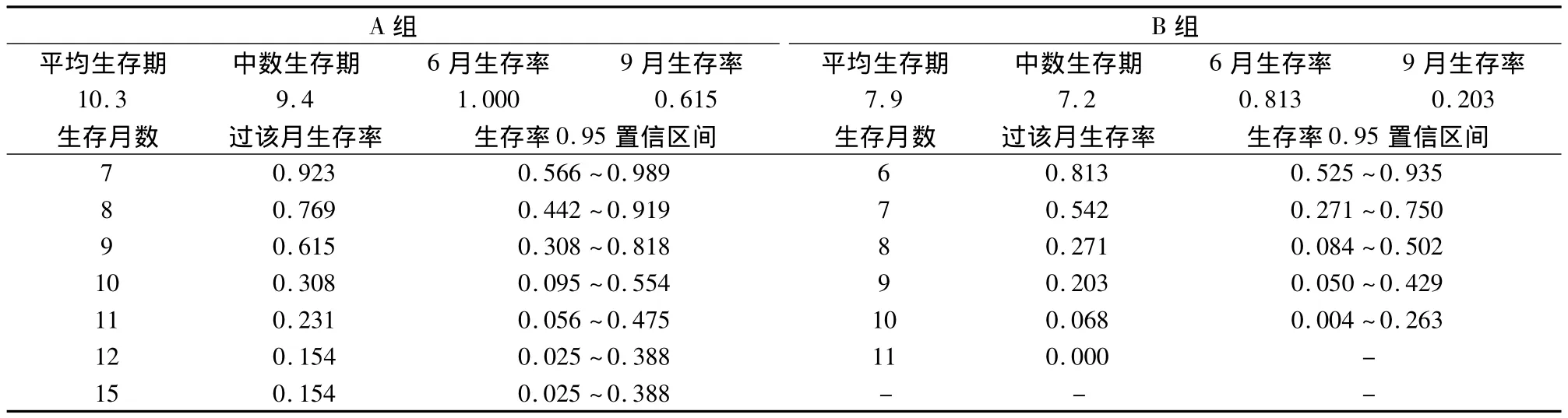
表4 两组生存率计算(Kaplan-Meier method乘积限法)
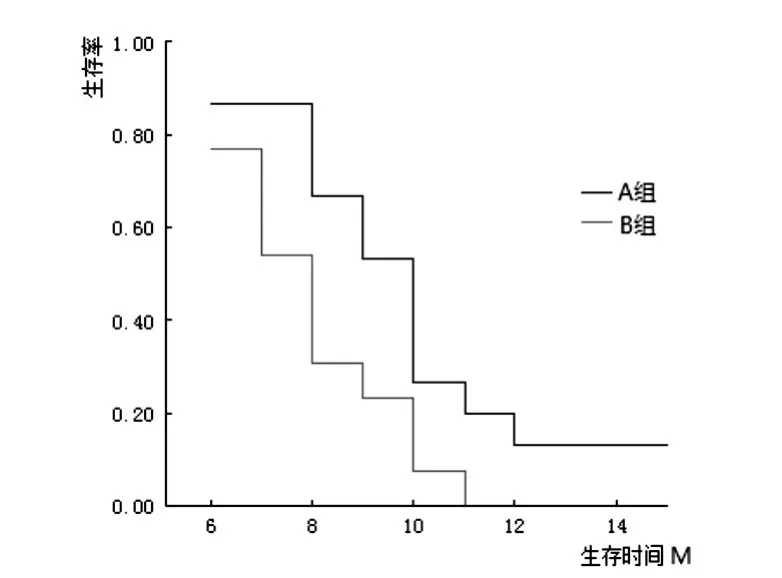
图1 两组Kaplan-Meier生存率曲线
2.3 不良反应 30例患者均可评价毒副反应,无治疗相关性死亡发生。A组有3例患者在化疗7个周期后因Ⅳ度骨髓抑制而换方案化疗,B组有1例在化疗4周期后因Ⅳ度白细胞减少而拒绝进一步化疗。两组患者的主要毒副反应为血液学毒性和消化道反应,A组白细胞减少及恶心、呕吐发生率显著高于B组(P<0.05)。A组血小板减少及贫血发生率高于 B 组(57.1%vs 37.5%,42.9%vs 25.0%)。B组便秘发生率稍高于A组(31.3%vs 28.6%),差异无统计学意义,见表5。
3 讨论
胰腺癌因其死亡率极高而被称为“癌中之王”,我国胰腺癌发病率呈持续上升趋势[3],据《2012中国肿瘤登记年报》[4]显示,胰腺癌已位居我国恶性肿瘤发病排行榜的第9位,发病率为8.19/10万5年生存率仅为4%。近十几年来,胰腺癌的治疗虽然在化疗、分子靶向药物、放疗以及外科技术等方面取得了一些进展,但是仍未能改善预后。局部晚期胰腺癌的治疗由于局部复发率和远处转移率高,仍然面临着临床挑战。
吉西他滨因其临床有效性明显高于5-Fu,一度被认为是晚期胰腺癌的标准治疗[5],尽管如此,OS仍<6个月。为了进一步提高吉西他滨治疗晚期胰腺癌的效果,许多药物被用于与吉西他滨联合治疗晚期胰腺癌,但大多研究的结果显示联合化疗较吉西他滨单药并没有明显的生存获益[6-9]。替吉奥是第三代氟脲嘧啶衍生物口服抗癌剂,是由替加氟(FT)、吉美嘧啶(CDHP)、奥替拉西钾(OXO)组成的复方制剂,按1∶0.4∶1(摩尔比值)组成。FT是5-Fu的前体药物,具有优良的口服生物利用度,能在活体内转化为5-Fu。CDHP能抑制在二氢嘧啶脱氢酶作用下从FT释放的5-Fu分解代谢,有助于长时间维持血中和肿瘤组织中的5-Fu有效浓度,具有与5-Fu持续静注类似的疗效。OXO能阻断5-Fu磷酸化,口服给药后在胃肠组织中的分布浓度很高,从而影响5-Fu在胃肠道的分布,降低其毒性作用。2012年,美国临床肿瘤学会研究的最新数据表明,S-1单药治疗晚期胰腺癌的疗效不低于GEM[10],并有研究显示S-1能改善吉西他滨难治性胰腺癌患者的预后[11]。为GS方案(吉西他滨+S-1)有可能提高晚期胰腺癌治疗的疗效及安全性提供了理论依据。Nakai Y 等[6,12]研究显示 GS 方案能显著延长晚期胰腺癌OS至>1年,明显高于吉西他滨单药。但也研究认为GS联合较吉西他滨或S-1单药并不能延长生存[13]。
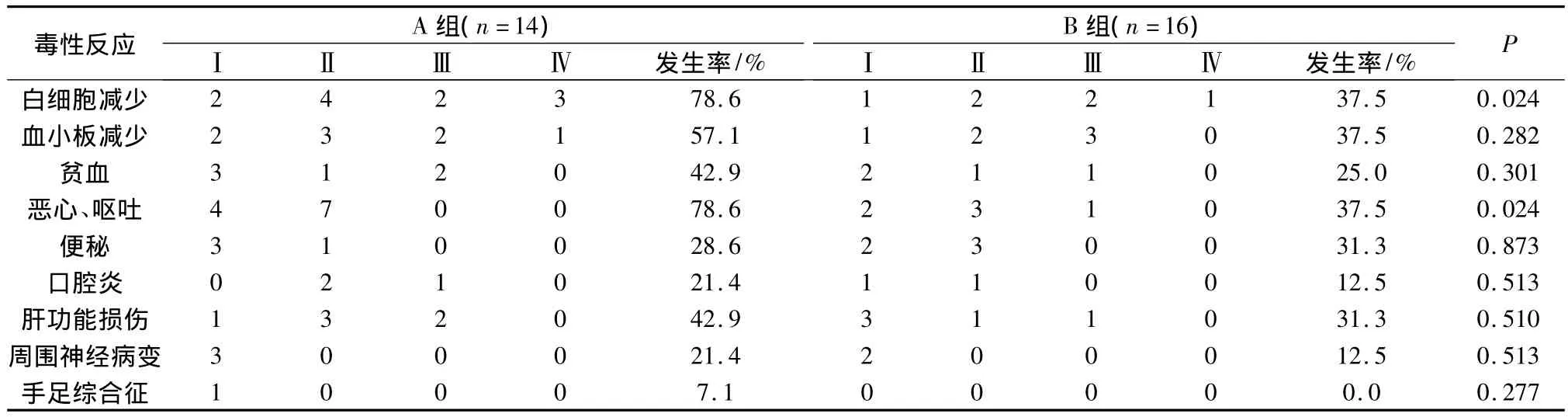
表5 治疗相关毒副反应
我们回顾分析了以吉西他滨为基础治疗的30例晚期胰腺癌,GS联合治疗总有效率达到46.2%,临床受益率76.9%,与单用吉西他滨相比,疗效明显提高。但联合化疗毒副反应亦有所增加,白细胞减少及恶心、呕吐发生率均远高于单药化疗(P=0.024),3/4级毒性反应主要表现为5例(35.7%)患者发生3/4级白细胞降低;3例(21.4%)3/4级血小板减少和2例(14.3%)3/4级贫血(14.3%);胃肠道毒性多较轻微,仅1例发生3级口腔炎;肝肾功能的损害少且轻微。与治疗相关的死亡病例未见,因此该方案的毒性是可以耐受和接受的。
综上所述,GS方案对于晚期胰腺癌,属于较安全、有效的方案,毒性反应可以耐受,具有较好的临床前景,值得进一步开展大样本、多中心、随机对照研究。
[1] Mancuso A,Calabro F,Sternberg CN.Current therapies and advances in the treatment of pancreatic cancer[J].Crit Rev Oncol Hematol,2006,58(3):231 -241.
[2] 孙 燕,石元凯.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2009:133-147.
[3] 马 臣,姜永晓,刘曙正,等.中国胰腺癌发病趋势分析和预测[J].中华流行病学杂志,2013,34(2):160 -163.
[4] 赫 捷,陈万青.2012中国肿瘤登记年报[J].
[5] Burris HA,3rd,Moore MJ,Andersen J,et al.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer:a randomized trial[J].J Clin Oncol,1997,15(6):2403 -2413.
[6] Ozaka M,Matsumura Y,Ishii H,et al.Randomized phase II study of gemcitabine and S-1 combination versus gemcitabine alone in the treatment of unresectable advanced pancreatic cancer(Japan Clinical Cancer Research Organization PC-01 study)[J].Cancer Chemother Pharmacol,2012,69(5):1197 -1204.
[7] Berlin JD,Catalano P,Thomas JP,et al.Phase III study of gemcitabine in combination with fluorouracil versus gemcitabine alone in patients with advanced pancreatic carcinoma:Eastern Cooperative Oncology Group Trial E2297[J].J Clin Oncol,2002,20(15):3270-3275.
[8] Colucci G,Giuliani F,Gebbia V,et al.Gemcitabine alone or with cisplatin for the treatment of patients with locally advanced and/or metastatic pancreatic carcinoma:a prospective,randomized phase III study of the Gruppo Oncologia dell'Italia Meridionale[J].Cancer,2002,94(4):902 -910.
[9] Louvet C,Andre T,Lledo G,et al.Gemcitabine combined with oxaliplatin in advanced pancreatic adenocarcinoma:final results of a GERCOR multicenter phase II study[J].J Clin Oncol,2002,20(6):1512-1518.
[10] Fukutomi A,Okusaka T,Sugimori K,et al.Updated results of the GEST study:Randomized phase III study of gemcitabine plus S-1(GS)versus S-1 versus gemcitabine(GEM)in unresectable advanced pancreatic cancer in Japan and Taiwan[J].Journal of Clinical Oncology,2012,30:130.
[11] Nakai Y,Isayama H,Sasaki T,et al.Impact of S-1 in patients with gemcitabine-refractory pancreatic cancer in Japan[J].Japanese Journal of Clinical Oncology,2010,40(8):774 -780.
[12] Nakai Y,Isayama H,Sasaki T,et al.A multicentre randomised phase II trial of gemcitabine alone vs gemcitabine and S-1 combination therapy in advanced pancreatic cancer:GEMSAP study[J].Br J Cancer,2012,106(12):1934 -1939.
[13] Ueno H,Ioka T,Ikeda M,et al.Randomized phase III study of gemcitabine plus S-1,S-1 alone,or gemcitabine alone in patients with locally advanced and metastatic pancreatic cancer in Japan and Taiwan:GEST study[J].J Clin Oncol,2013,31(13):1640 -1648.

