脂氧合酶OsRCI-1 正调控水稻对二化螟的抗性
姚张良 ,曹梦娇,王 霞,缪家顺,沈励泽,邓建宇,吴慧明,徐志宏,娄永根,周国鑫*
(1.浙江农林大学农业与食品科学学院植物保护系,浙江省农产品品质改良技术研究重点实验室,浙江临安,311300;2.浙江大学水稻生物学国家重点实验室,昆虫科学研究所,浙江杭州,310058)
植物脂氧合酶 LOXs (linoleate:oxygen oxidoreductase,EC1.13.11.12)将亚油酸(linoleic acid)和亚麻酸(linolenic acid)氧化成C-9 或C-13 氢过氧化物,这些物质经不同支路代谢生成一系列具有生物活性的脂氧化产物-脂氧合素(Oxylipins) (Wasternack and Hause,2013)。研究表明,植物脂氧合素(Oxylipins)在植物抵御非生物胁和生物胁迫的信号传导中起关键作用,同时一些植物脂氧合素(Oxylipins)本身就是抗虫防御化学物质,此外Oxylipins 也在植物生长发育、器官形态建成、开花繁殖中具有重要作用(Demmig-Adams et al.,2013)。其中,茉莉酸(Jasmonic acid,JA) 和绿叶 气味分 (Green leaf volatiles,GLVs)是近二十年来植物抗虫防御反应中研究的较多、较深入的2种植物脂氧合素(Oxylipins),这两类物质虽然其本身没有杀虫活性,但可作为信号分子诱导植物产生抗虫免疫防御反应(Demmig-Adams et al.,2013)。研究表明,植物脂氧合酶(LOXs)是茉莉酸(JA)和绿叶性气味分子(GLVs)生物合成途径中的关键酶(Wasternack and Hause,2013)。
在植物中,脂氧合酶由一个基因家族编码,家族中各LOX 基因表达模式、催化特性、生物学功能存在巨大差异。不同的LOX 基因催化产物往往只用于特定的代谢支路,如玉米ZmLOX8 和ZmLOX10 定位于不同的亚细胞器中,分别特异性地为茉莉酸 (JA)途径和绿叶性气味分子(GLVs)生物合成提供底物 (Christensen et al.,2013)。虽然4 个拟南芥13-LOX 基因AtLOX2、AtLOX3、AtLOX4 和AtLOX6 都参与机械损伤诱导的茉莉酸合成,但是只有AtLOX6 是拟南芥叶片应答远距离机械损伤信号诱导早期茉莉酸积累所必须的(Chauvin et al.,2013)。可见,家族中各LOX基因编码蛋白的生化活性、生物学功能存在巨大差异。
与拟南芥、烟草、玉米等相似,水稻脂氧合酶基因家族也由多个基因成员组成,水稻基因组至少存在15 个LOX 基因(Agrawal et al.,2004)。已有的研究表明,水稻LOX 基因成员的生物学功能存在多样性,不同LOX 基因分别在粮食陈化、抗病虫中起着重要作用。水稻种子中有3 个脂氧合酶同工酶sLOX-1、sLOX-2 和sLOX-3,缺失sLOX-1 或sLOX-2 的水稻种子陈化速度显著减慢;缺失sLOX-3 水稻种子对陈化速度没有影响,但是缺失sLOX-3 水稻不易吸引谷蠹Rhizopertha dominica 为害(Zhang et al.,2007)。
在水稻脂氧合酶基因调控水稻抗虫诱导防御反应方面,Wang 等2008年报道OsLOX1 具有C9/13-LOX活性,参与水稻体内茉莉酸(JA)和绿叶性气味分子(GLVs)的生成,正调控对褐飞虱的抗性。我们先前的研究发现OsHI-LOX 仅具有C13-LOX 活性,其参与虫害诱导的茉莉酸(JA)合成,但不参与水稻绿叶性气味(GLVs)的释放(Zhou et al.,2009)。非常有趣的是,反义抑制OsHI-LOX 突变体削弱了机械损伤和昆虫取食诱导的JA 合成,降低对咀嚼式口器昆虫二化螟Chilo suppressalia Walker 和稻纵叶螟Cnaphalocrosis medinalis Guenee 的抗性,但是却增加了对刺吸式口器昆虫褐飞虱(Nilaparvata lugens Stål)的抗性(Zhou et al.,2009)。我们最近的研究表明Osr9-LOX1 是一个仅有C9 催化活性的脂氧合酶,反义抑制Osr9-LOX1 基因突变体植株as-r9lox1 表现为更加抗二化螟,Osr9-LOX1 可以通过调控13-LOX 途径影响水稻对昆虫的诱导抗性(Zhou et al.,2014)。研究表明,水稻LOX 基因家族中有8 个成员被二化螟取食胁迫调控(Zhou et al.,2011),其中OsHI-LOX、OsLOX1 和Osr9-LOX1 的抗虫功能已被较好的研究(Wang et al.,2008;Zhou et al.,2009;Zhou et al.,2014)。可见,水稻脂氧合酶家族基因生物功能存在差异,在虫害诱导的水稻防御反应中扮演不同的角色。
水稻是重要的粮食作物,世界上一半以上的人口以水稻为主粮(Cheng et al.,2013)。在我国,水稻是最主要的粮食作物,水稻生产直接关系到我国的粮食安全。二化螟 (Striped stem borer,SSB)是水稻的主要害虫之一。本文克隆了一个虫害胁迫诱导水稻LOX 基因OsRCI-1,研究了其在二化螟取食为害后的时序表达谱;并通过农杆菌介导的水稻遗传转化技术获得了OsRCI-1 基因沉默水稻突变体ir-rci;利用获得的突变体,检测了水稻OsRCI-1 基因对二化螟生长发育的影响。
1 材料与方法
1.1 水稻品种和实验昆虫
供试水稻品种为秀水11 (XS11)及OsRCI-1的RNA 干扰基因沉默株系ir-rci。水稻种子于光照培养箱催芽后,移入组培瓶(直径6.5 cm,高9.0 cm),置于温室(温度28±2℃,湿度60%±10%,光照L∶D=16∶8)培养10 d,后移栽到盛土的塑料杯中,每杯移栽1 株。移栽的水稻苗在温室(温度28±2℃、湿度60%±10%、光照L∶D=16∶8)中生长,每天浇水,每周施浓度1 g/L的尿素水溶液10 mL,35-40 d 后用于各种实验。
二化螟幼虫采自中国水稻研究所农场(浙江富阳),在室内 (温度26± 2℃、湿度70%±10%、光照L∶D=18∶6),以Taichung Native 1(TN1)水稻幼苗饲养和繁殖至少1 代后用于各种实验。
1.2 二化螟取食为害后的水稻脂氧合酶基因表达分析
移栽后35-40 d 水稻XS11 用自来水冲洗干净,每株水稻茎杆接饥饿2 h 的二化螟3 龄幼虫1头,待二化螟钻入水稻茎杆1/2 体长开始计时,在二化螟为害后0、0.5、1、2、4、8、12、24 和48 h 剪下二化螟为害处2-3 cm 长水稻茎杆,迅速除去二化螟幼虫,立即放液氮冷冻,后置-80℃冰箱保存备用。
植物总RNA 用SV Total RNA Isolation System(Promega)试剂盒提取,具体方法参照试剂盒说明书。100 ng 总RNA 以ReverTra Ace qPCR RT Kit(Toyobo)试剂盒合成cDNA,具体方法参照试剂盒说明书。虫害诱导水稻脂氧合酶基因OsHI-LOX 2(LOC _ Os03g52860)、OsHI-LOX 3 (LOC _Os08g39850)和OsRCI-1 (LOC_ Os12g37260)表达丰度检测以TaqMAN 定量PCR 法进行,以OsACT 基因(LOC_ Os03g50885)作为内参基因,定量PCR 所用试剂盒为Premix Ex TaqTM Kit(TaKaRa),所用引物及探针序列见表1。

表1 QRT-PCR 引物及探针Table 1 Primers and probes used for QRT-PCR of target genes
1.3 水稻OsRCI-1 基因的克隆和序列分析
根据 TIGR (http://rice.plantbiology.msu.edu/)数据库中LOC_ Os12g37260 的序列设计特异性引物RCI-F:5'-ATGCTCACGGCCACGCACGCA GACTC-3'和RCI-R:5'-TCAAATTGAGATG CTGTTGGGGA-3'。PCR 反应总 积20 μL:cDNA 1 μL,特异性引物各1 μL,dNTP 2 μL,2×buffer 10 μL,PrimeSTAR HS DNA Polymerase(TakaRa)0.2 μL,ddH2O 4.8 μL。反应程序为:98℃10 s,50℃1 min,68℃3 min,5 次循环;98℃10 s,72℃3 min,35 次循环;最后72℃延伸10 min。扩增出目的片段,用AxyPrepTM DNA Gel Extraction Kit (Axygen)割胶试剂盒回收,后经加A 后连接入pGEM-T Easy (Promega)载体,挑选4 个阳性克隆送南京金斯瑞生物科技有限公司测序鉴定。序列用Prosite 软件(http://www.expasy.org/)和NetPhosK 1.0 软件 (http://www.cbs.dtu.dk)进行蛋白基序(Motif)、功能结构域、磷酸化位点分析。
1.4 RNAi 载体的构建与遗传转化
OsRCI-1 基因的特异性片段分别正向和反向连接入植物表达载体内含子(intron)的两端,组合的编码序列置于CaMV 35S 启动子和NOS 终止子之间以获得一个完整的RNAi 表达框。正向序列插入,根据测序结果设计特异性引物iRC +F:5'-ATGGTCGACCGCCCCTTCTTCCTTCTCCA-3',iRC +R:5'-CTTGGTACCGTCCTGCTTCAAGCTCA CCGT-3' (下划线分别是SalI 和KpnI 的酶切位点);以获得的OsRCI 质粒为模板,反应为体系20 μL (特异性引物各1 μL,dNTP 2 μL,2×buffer 10 μL,PrimeSTAR HS DNAPolymerase 0.2 μL,ddH2O 补足),反应程序 (98℃ 10 s,66℃ 20 s,反应循环35 次,最后72℃延伸5 min),扩增出的217 bp 目的片段,电泳割胶回收后经SalI 和KpnI 双酶切后与经同样内切酶消化的载体连接,构建的载体经酶切及测序验证。在此基础上,以特异性引物 iRC-F:5'-CTAGGATCCCGCCCCTTCTTCCTTCTCCA-3',iRC-R:5'-GACTCTAGAGTCCTGCTTCAAGC TCACCGT-3' (下划线分别是BamHI 和XbaI 的酶切位点),扩增出目的片段,电泳割胶回收经BamHI 和XbaI 双酶切后克隆进载体的XbaI 和BamHI 的位点,筛选阳性克隆送南京金斯瑞生物科技有限公司测序确定。
构建的OsRCI-1 基因的RNAi 植物表达载体pRNAi-RCI 质粒1 μg 采用电击法导入农杆菌工程菌株EHA105,阳性克隆经PCR 及测序鉴定,获得含质粒pRNAi-RCI 的工程农杆菌用于水稻的遗传转化。
农杆菌介导的遗传转化参考Hier 等的方法进行(Hiei et al.,1994)。含pRNAi-RCI 质粒的工程农杆菌单克隆接种于YEP 液体培养基,于28℃,250 rpm 条件下在温控摇床培养至OD=0.5,菌液离心后以侵染培养基重悬获得侵染用菌液,将水稻XS11 成熟胚诱导的愈伤组织置于侵染菌液30 min 后,取出愈伤组织在滤纸上晾干后放置共培养基上25℃暗培养2 d;之后,将愈伤组织置含潮霉素的抗性培养基上筛选,获得的抗性愈伤经预分化、分化、生根后获得OsRCI-1 的RNAi突变体水稻。
1.5 OsRCI-1 的RNAi 突变体目的基因OsRCI-1沉默效果监测
因为茉莉酸能诱导 OsRCI-1 的表达(Schaffrath et al.,2000)。对野生型XS11 和突变体植株ir-rci 水稻均匀喷洒2 mL 茉莉酸溶液(100 μg/mL),处理6 h 后,剪取倒数第2 完全伸展叶,立即浸入液氮冷冻后置-80℃冰箱保存。植物总RNA 提取、cDNA 合成以及定量PCR 见方法材料与方法1.2。
1.6 二化螟的生物测定
野生型XS11 和突变体植株ir-rci,每株接入二化螟2 头初孵幼虫,将接虫后的水稻放入人工气候室内(温度28±2℃、湿度60%±10%、光照L∶D=16∶8)继续培养,13 d 后从各株水稻中剥出二化螟并称重,各处理至少30 个重复。
1.7 数据分析
根据实验设计和统计分析原理,对所得的实验数据用Statistica 6.0 (StatSoft)软件进行t-test检验分析。
2 结果与分析
2.1 虫害诱导水稻LOX 基因在二化螟取食后的时序表达特征

图1 二化螟处理水稻茎杆水稻LOX 基因的表达特征Fig.1 Relative expression levels of three herbivore-induced riceLOX in SSB-infested rice plants
本研究选择3 个受虫害诱导LOX 基因(Zhou et al.,2011),并对其mRNA 表达特征进行了分析(如图1)。结果表明,3 个受虫害诱导的水稻脂氧合酶中,OsHI-LOX 2 (LOC_ Os03g52860) (图1A)在水稻茎杆中的相对表达量较高,而OsHI-LOX 3 (LOC_ Os08g39850) (图1B)相对表达量最低。二化螟取食处理都能显著地诱导这3 个LOX基因的表达,其中OsHI-LOX 2 (图1A)和OsHI-LOX 3 (图1B)分别在二化螟取食8 h 和4 h 后mRNA 水平开始显著积累,并且之后一直持续不断增加。而OsRCI-1 (LOC_ Os12g37260)表达水平与0h 对照相比,二化螟处理后0.5 h 即显著地增加,随着二化螟取食时间推移其表达量不断的积累(图1C),说明该基因在二化螟取食初期即对防御信号作出了应答,并一直保持较高的表达水平,因此我们选择该基因作进一步研究。
2.2 水稻OsRCI-1 基因的克隆和序列分析
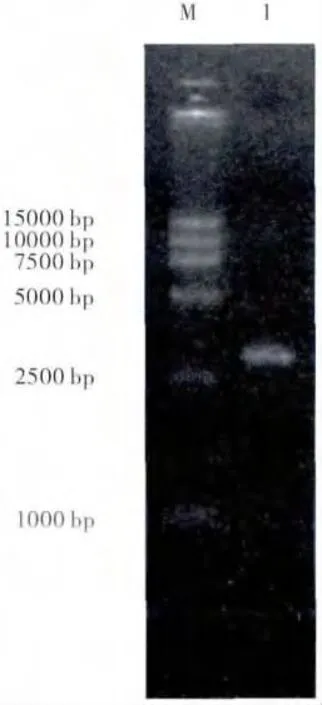
图2 OsRCI-1 基因PCR 产物电泳检测Fig.2 Electrophoresis analysis ofOsRCI-1 PCR product
以RCI-F 和RCI-R 为引物,用高保真DNA Taq 酶扩增出一条约2800 bp 的特异性条带(如图2)。割胶回收该条带,连接入pGEM-T easy 克隆载体,挑选4 个阳性克隆送南京金斯瑞生物科技有限公司测序。测序结果进行拼接获得2769 bp 序列(图3),推测编码922 个氨基酸,预测编码蛋白分子量为105 kDa。序列在NCBI 网站进行Blast比对分析,发现其基因序列与日本栽培稻(Kusabue)的OsRCI-1 基因(AJ270938)序列完全一致。ExPASy 网站Prosite 软件进行蛋白功能域扫描,发现了编码的蛋白只有LIPOXYGENASE 一个Motif (如图3A),表明克隆的OsRCI-1 具有脂氧合酶(lipoxygenase)的功能。蛋白磷酸化在水稻抗虫防御信号传导中起非常重要的作用,因此用NetPhosK 1.0 软件对OsRCI-1 蛋白磷酸化位点进行了分析,发现有13 个位点可被蛋白激酶PKC所磷酸化(表2)。
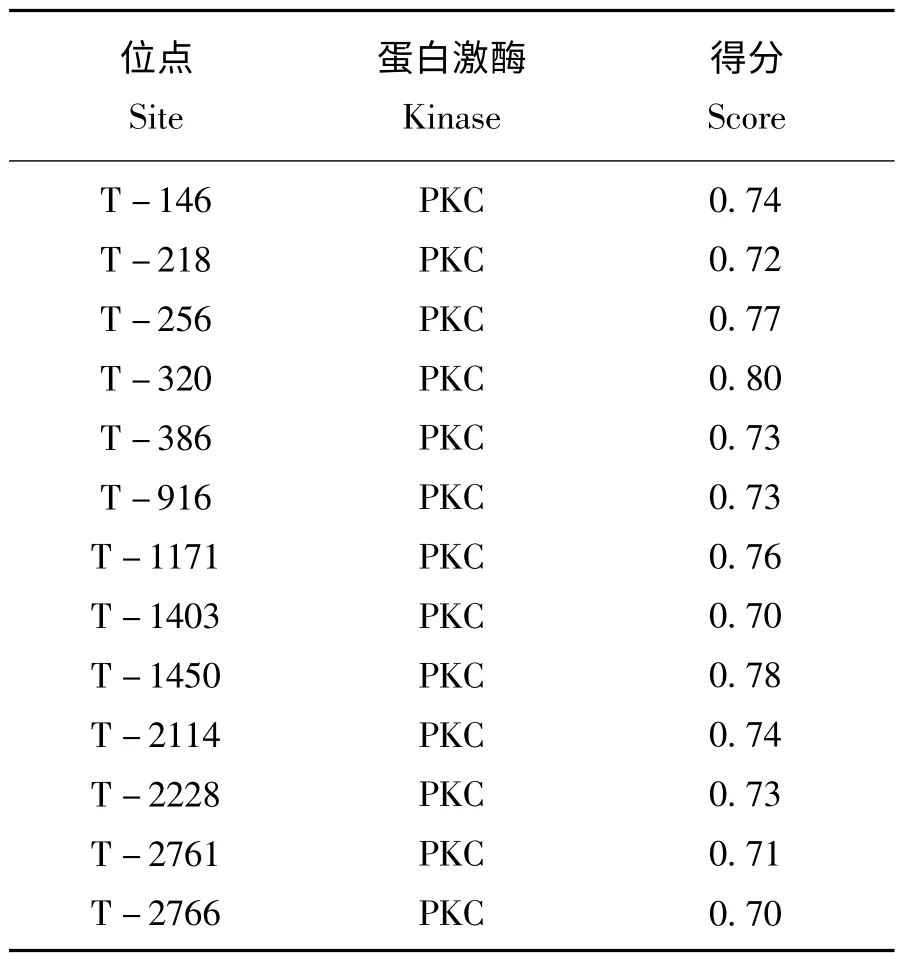
表2 OsRCI-1 蛋白可被PKC 蛋白激酶磷酸化的位点Table 2 The putative phosphorylation site of OsRCI-1 by protein kinase PKC
2.3 载体的构建与遗传转化
为了进一步明确OsRCI-1 的抗虫功能,我们设计了引物扩增出一段217 bp 的OsRCI-1 特异性片段(图3 下划线序列),分别正向和反向插在内含子(intron)的两端,构成目的基因片段互补发夹结构(图4),将该发夹结构区置于CaMV35 启动子和NOS 终止子之间,构建沉默OsRCI-1 的RNAi 植物表达载体pRNAi-RCI。RNAi 载体pRNAi-RCI 转入农杆菌EHA105,阳性克隆经菌落PCR 验证后,用于水稻胚性愈伤侵染。获得的抗性愈伤经潮霉素抗性筛选、分化和生根,获得RNAi 的水稻株系用于后续研究(图5)。

图3 克隆的OsRCI-1 基因序列和推导的氨基酸序列及其结构域Fig 3 Sequence ofOsRCI-1 and its deduced amino acid sequence and it’s motif

图4 水稻基因RCI-1 沉默原理Fig.4 The rice geneRCI-1 silencing principle

图5 转基因突变体的获得Fig.5 Construction of transgenic plants
2.4 突变体株系中目的基因表达被显著抑制
为了明确RNAi 突变体株系中目的基因OsRCI-1 的转录水平,我们利用QRT-PCR 对RNAi 突变体株系ir-rci-1 和ir-rci-2 进行了检测。结果表明,这两个株系中OsRCI-1 基因的表达量显著降低,ir-rci-1 和ir-rci-2 中目的基因表达丰度分别只有野生型XS11 表达量的47.73% 和32.33% (如图6)。
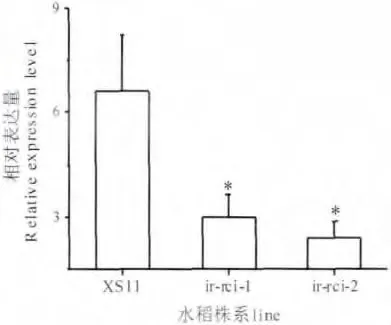
图6 突变体ir-rci 和野生型中OsRCI-1 基因的相对表达量(n=5;*,P<0.05,t-test)Fig.6 The relative expression level ofOsRCI-1 gene in ansgenic rice plants and WT line (n=5;*,P<0.05,t-test)
2.5 抑制OsRCI-1 表达降低水稻对二化螟直接抗性
为了明确RNAi 的两个株系ir-rci-1 和ir-rci-2 对二化螟生长发育的影响,测定了二化螟初孵幼虫在野生型水稻和RNAi 突变体ir-rci 株系的生长情况。在接入二化螟初孵幼虫13d 后,剥出二化螟称重,结果表明取食ir-rci-1 和ir-rci-2株系的二化螟的体重分别为取食野生型XS11 的1.58 倍和2.15 倍(图7 A)。野生型水稻对二化螟取食为害的耐害能力明显比ir-rci 品系要强,二化螟为害13d 后两个突变体品系ir-rci 生长被完全抑制,表现为枯心并且外侧叶子枯黄,而野生型水稻仅外叶鞘发黄(如图7B)。
3 结论与讨论
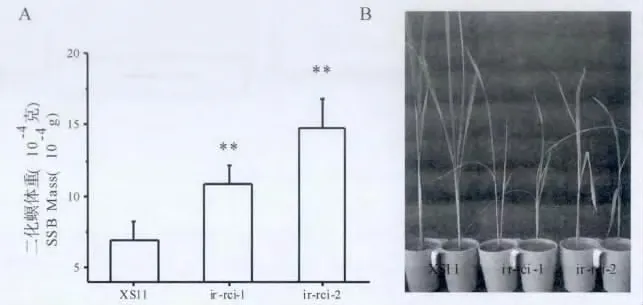
图7 突变体ir-rci 和野生型XS11 水稻对二化螟的抗性Fig.7 The resistance of ir-rci lines and WT plants to SSB infestation
本研究用QRT-PCR 检测了水稻3 个脂氧合酶基因OsHI-LOX 2/LOC_ Os03g52860、OsHI-LOX 3/LOC_ Os08g39850 和 OsRCI-1/LOC _Os12g37260 在二化螟取食后的表达动态,结果表明3 个基因均被二化螟取食胁迫信号所诱导,该结果与Zhou 等2011年的结论一致(Zhou et al.,2011)。此外,这3 个水稻LOX 基因虽然都能被二化螟取食诱导,但是其诱导表达动态存在差异,表明这3 个LOX 基因可能在水稻诱导抗虫防御反应中存在差异。其中,OsRCI-1 基因表现出对二化螟取食信号快速及持续应答反应,我们推测该基因可能在水稻对二化螟的防御反应中起重要的作用,并对该基因进行了详细研究。从秀水11 水稻品种中克隆的OsRCI-1 经测序与日本栽培稻(Kusabue)的OsRCI-1 基因序列完全一致。前人的研究表明,用植物获得性抗性诱导化合物benzol(1,2,3)thiadiazole-7-carbothioic acid S-methyl ester (BTH)和2,6-dichloroisonicotinic acid (INA)处理均能诱导水稻体内OsRCI-1 的积累(Schaffrath et al.,2000)。并且过量表达OsRCI-1 基因,会导致水稻叶片病程相关蛋白OsPR1 的积累(Zabbai et al.,2004),说明OsRCI-1 基因可能与水稻抗病性密切相关。机械损伤处理不能诱导OsRCI-1 表达(Schaffrath et al.,2000),但能被二化螟取食所诱导(图1),说明OsRCI-1 是二化螟取食胁迫信号调控的特异性基因,能特异识别二化螟取食所释放的特异诱导信号。OsRCI-1 是定位于叶绿体13-LOX 催化活性脂氧合酶,用该信号途径的产物茉莉酸处理能显著增加水稻叶片OsRCI-1 表达 (Schaffrath et al.,2000;Zabbai et al.,2004),水稻中OsRCI-1 介导的防御反应途径可能存在一个正反馈调控的机制。
RNAi 抑制OsRCI-1 基因表达,导致水稻对二化螟的抗性减弱,植物的耐害性降低,OsRCI-1 沉默的两个株系ir-rci-1 和ir-rci-2 明显的对二化螟取食更加敏感(图7)。这一结果与我们先前研究水稻13-LOX 基因OsHI-LOX 正调控对二化螟抗性的功能相类似(Zhou et al.,2009),但是OsRCI-1 催化产物是否供给水稻体内茉莉酸(JA)或绿叶性气味(GLVs)合成还需要进一步的实验证实。与水稻OsHI-LOX 和OsRCI-1 相反,水稻Osr9-LOX1 基因负调控水稻对二化螟的抗性,并且Osr9-LOX1 是通过调控13-LOX 途径影响水稻对昆虫的诱导抗性 (Zhou et al.,2014)。反义抑制OsHI-LOX 基因突变体植株aslox 表现为对二化螟更加敏感是由于as-lox 中虫害诱导茉莉酸合成受到抑制,导致抗虫物质蛋白酶抑制剂(TrypPIs)合成减少(Zhou et al.,2009)。OsRCI-1 的RNAi 水稻突变体ir-rci 对二化螟取食表现为更加敏感,是否也是由于虫害诱导茉莉酸合成减少导致抗虫防御物质TrypPI 含量降低,即OsRCI-1 基因介导的水稻诱导抗性产生机制还有待进一步研究。
References)
Agrawal GK,Tamogami S,Han O,et al.Rice octadecanoid pathway[J].Biochemical and Biophysical Research Communications,2004,(317)1:1-15.
Chauvin A,Caldelari D,Wolfender JL,et al.Four 13-lipoxygenases contribute to rapid jasmonate synthesis in wounded Arabidopsis thaliana leaves:a role for lipoxygenase 6 in responses to long-distance wound signals [J].New Phytologist,2013,(197)2:566-575.
Cheng XY,Zhu LL,He GC.Towards understanding of molecular interactions between rice and the brown planthopper [J].Molecular Plant,2013,(6)3:621-634.
Christensen SA,Nemchenko A,Borrego E,et al.The maize lipoxygenase,ZmLOX10,mediates green leaf volatile,jasmonate and herbivore-induced plant volatile production for defense against insect attack [J].Plant Journal,2013,(74)1:59-73.
Demmig-Adams B,Cohu CM,Amiard V,et al.Emerging trade-offs-impact of photoprotectants (PsbS,xanthophylls,and vitamin E)on oxylipins as regulators of development and defense [J].New Phytologist,2013,(197)3:720-729.
Hiei Y,Ohta S,Komari T,et al.Efficient transformation of rice (Oryza sativa L.)mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA [J].Plant Journal,1994,(6)2:271-282.
Schaffrath U,Zabbai F,Dudler R.Characterization of RCI-1,a chloroplastic rice lipoxygenase whose synthesis is induced by chemical plant resistance activators [J].European Journal of Biochemistry,2000,(267)19:5935-5942.
Wang R,Shen W,Liu L,et al.A novel lipoxygenase gene from developing rice seeds confers dual position specificity and responds to wounding and insect attack [J].Plant Molecular Biology,2008,(66)4:401-414.
Wasternack C,Hause B.Jasmonates:biosynthesis,perception,signal transduction and action in plant stress response,growth and development.An update to the 2007 review in Annals of Botany[J].Annals of Botany,2013,(111)6:1021-1058.
Zabbai F,Jarosch B,Schaffrath U.Over-expression of chloroplastic lipoxygenase RCI1 causes PR1 transcript accumulation in transiently transformed rice [J].Physiological and Molecular Plant Pathology,2004,(64)1:37-43.
Zhang Y,Yu Z,Lu Y,et al.Effect of the absence of lipoxygenase isoenzymes on the storage characteristics of rice grains [J].Journal of Stored Products Research,2007,(43)1:87-91.
Zhou G,Qi J,Ren N,et al.Silencing OsHI-LOX makes rice more susceptible to chewing herbivores,but enhances resistance to a phloem feeder [J].Plant Journal,2009,(60)4:638-648.
Zhou G,Ren N,Qi J,et al.The 9-lipoxygenase Osr9-LOX1 interacts with the 13-lipoxygenase-mediated pathway to regulate resistance to chewing and piercing-sucking herbivores in rice[J].Physiologia Plantarum,2014,doi:10.1111/ppl.12148.
Zhou G,Wang X,Yan F,et al.Genome-wide transcriptional changes and defence-related chemical profiling of rice in response to infestation by the rice striped stem borer Chilo suppressalis [J].Physiologia Plantarum,2011,(143)1:21-40.

