甲基苯丙胺所致的大鼠神经毒性损伤及nNOS抑制剂的保护作用
徐静涛,张 付,杨幸怡,谢卫兵,李丽增,刘 超,王慧君
(1.南方医科大学基础医学院法医学系暨南方医科大学司法鉴定中心,广东广州 510515;2.广东省公安厅公安部法医病理重点实验室,广东广州 510050;3.广州市公安局刑事科学技术研究所,广东广州 510030)
甲基苯丙胺(methamphetamine,METH)俗称“冰毒”,属于苯丙胺类兴奋剂,是最具代表性和最常见的新型毒品。2000年以后,迅速成为我国滥用增长速度最快的毒品,吸毒人群年轻化和非法制造冰毒业的存在,使我国冰毒滥用已成为严重的社会问题[1-2]。目前,关于METH的神经毒性机制,国内外研究结果尚未完全明确。现阶段的研究结果显示,多种机制参与了METH的神经毒性,主要包括氧化应激、神经元凋亡、兴奋性毒性、线粒体功能障碍等[3-5],其中氧化应激是METH所致神经毒性损伤的重要作用机制之一[6-7]。
本实验室运用蛋白质组学的方法,对METH注射后大鼠纹状体、额叶皮质、海马等部位的差异表达蛋白质进行鉴定和分析,发现了一种新型的NO合成调节酶二甲基精氨酸二甲基氨基水解酶1(DDAH1)表达上调,提出了 DDAH1/ADMA/NOS系统可能是NO过表达引起的中枢神经系统损伤的重要途径[8]。
氧化应激是METH神经毒性损伤作用的重要机制之一。METH作用后导致神经元型一氧化氮合酶(nNOS)活性增强;同时,我们课题组的一项研究结果也显示,METH可导致脑组织中NO浓度上升[9]。氧化应激过程中生成的过量NO和自由基生成毒性产物ONOO-,可能对神经元产生损伤作用。为了进一步明确NOS在METH中毒模型中的作用及其与METH神经毒性的关系,本研究通过构建加入METH和nNOS特异性的抑制剂7-硝基吲唑(7-nitroindazole,7-NI)的大鼠模型,进一步完善DDAH1/ADMA/NOS通路的神经毒性作用机制,为进一步研究nNOS活性变化与METH神经毒性的关系提供思路。
1 材料与方法
1.1 实验动物 SD大鼠24只,♂,体质量(300±5)g,购自南方医科大学实验动物中心。
1.2 主要试剂和仪器 盐酸甲基苯丙胺购自中国药品生物制品鉴定所(批号:171212,200803),纯度大于99%;7-NI购自Sigma公司;兔抗鼠nNOS多克隆抗体(1∶1 000稀释)、辣根过氧化物酶标记羊抗兔IgG(1∶8 000稀释)均购自北京博奥森生物公司;Tunel荧光法检测试剂盒购自罗氏公司。高速冷冻离心机购自Sigma-Aldrich公司;琼脂凝胶电泳仪购自Jun-Yi公司;荧光显微镜购自Olympus公司。
1.3 实验方法
1.3.1 动物分组及处理 大鼠随机分为4组,每组6只动物。动物单笼饲养,自由饮水、取食。实验前先在饲养室适应3 d。提前将216 mg METH溶解于48 ml纯水中,720 mg的7-NI溶解于30 ml的溶液(DMSO ∶异丙醇 ∶纯水 =1∶3∶6)中,在注射METH前30 min给SD鼠进行腹腔注射含有7-NI的混合液。第1组(生理盐水组):腹腔注射生理盐水,早晚各1次,连续注射3 d;第2组(METH组):腹腔注射METH,15 mg·kg-1,早晚各1次7.5 mg·kg-1,连续注射3 d;第3组(METH+7-NI组):METH注射方法同第2组,并且提前30 min在腹腔注射7-NI,注射剂量为50 mg·kg-1;第4组(7-NI组):腹腔注射生理盐水方法同第1组,并且提前30 min腹腔注射7-NI,剂量为50 mg·kg-1。末次注射后24 h,2%戊巴比妥麻醉,用4℃生理盐水进行脑部灌输,断头处死动物,迅速开颅完整剥离脑组织。沿中线切开,将脑组织分离为左右两个半球,放入-80℃冰箱保存。
1.3.2 行为学变化的研究 注射METH溶液后,立刻观察大鼠的行为学情况,并记录相关变化,对大鼠的刻板行为评分参照相关文献方法[10]。评分标准为:0分:静止不动,几乎或根本没有活动;1分:正常活动,偶尔有向前的运动;2分:活动伴随反复的向前探索;3分:持续地向前探索;4分:重复地抬头、摇头或旋转;5分:迅速地摇头、旋转或摇头的背腹运动。
1.3.3 大鼠纹状体的提取和处理 分别取每组6个样品的一侧脑半球,放在DEPC水处理过的培养皿上,将玻片置于冰盒上,在一侧脑半球距中线1 mm和3 mm处作矢状切面,取两切口之间的脑组织(为距中线1~3 mm之间,厚度为2 mm的脑组织片)[11],平放于培养皿上分离切取纹状体,-80℃冰箱保存。
1.3.4 Western blot检测大鼠纹状体nNOS和硝基化蛋白表达 将每组6个脑半球中纹状体中部分组织两两混合,移入匀浆器,加入裂解液;高速冷冻离心机15 000 r·min-1,4℃离心10 min;取上清液,加4倍体积冷丙酮-20℃过夜,15 000 r·min-14℃离心30 min;将电泳分离的蛋白转移到PVDF膜上,室温下用5%脱脂奶粉TBST缓冲液封闭1 h。一抗分别为兔抗鼠nNOS多克隆抗体(1∶1 000稀释)和兔抗鼠3-硝基酪氨酸单克隆抗体(美国Abcam公司,1 ∶1 000稀释),0.1 ml/cm2膜面积,4℃孵育过夜,然后,加入二抗(辣根过氧化物酶标记羊抗兔IgG,1∶8 000稀释),室温孵育90 min,常规漂洗。将PVDF膜用发光试剂ECL显色,暗室中曝光到X线片上。凝胶成像系统扫描分析结果。
1.3.5 酶联免疫分析(ELISA)法检测纹状体DA含量 按照ELISA试剂盒说明书的要求,检测各组组织的DA含量,以空白孔进行调零,在450 nm波长处,使用酶标仪测量各孔的吸光度,所得数据经电脑软件处理得到各组DA含量。
1.3.6 应用Tunel荧光法检测细胞凋亡 每组随机取3个待测的脑半球,在Bregma-0.36 mm处冠切,冰冻切片浸入固定液,室温固定30 min,然后室温封闭10 min,浸入通透液中冰上(2~8℃)促渗2 min。阳性对照组织样本再加入DNase I反应液,室温处理30 min后,加入TdT反应液,37℃反应60 min,阴性对照样本在标记反应的过程中不添加TdT酶反应液。将处理好的样本滴加Mounting Media封片剂。绿色荧光滤光片465~495 nm波长下激发荧光。双染细胞核 (DAPI和 TUNEL),DAPI染蓝色荧光,TUNEL染绿色荧光,经由Merged后,重叠部位即为细胞进行凋亡的位置。每个切片取4个视野,分别统计凋亡细胞数和细胞总数,并计算出细胞凋亡率。
1.3.7 统计学处理 实验结果的统计学处理用SPSS 13.0软件进行。行为学结果不同分组间指标值比较采用析因设计的重复测量方差分析,重复因素为注射次数,当资料不满足球形检验时采用Greenhouse-Geisser法;采用调整的基于估计边缘均值的LSD法进行不同分组间指标值的多重比较。其余各结果比较均采用单因素方差分析(One-way-ANOVA),组间比较根据方差齐性检验结果采用LSD法或Dunnett T3法分析。
2 结果
2.1 大鼠行为学改变 对照组和7-NI组大鼠注射生理盐水后,行为活动与正常大鼠无异。METH组和METH+7-NI组大鼠注射METH后约10 min开始出现行为和活动异常,主要表现为运动增多、不自主的扭头和点头、啮齿(磨牙)、立毛、遇响动或轻微刺激易激惹、自发转圈运动、翘尾,个别动物啃咬前肢皮肤、搔抓胸前部皮肤等,出现自残行为。行为活动异常持续至注射后约4 h,之后动物表现为倦怠、蜷缩,活动减少。析因设计的重复测量方差分析结果表明:不同分组间指标值差异有显著性(F=710.109,P<0.01);不同注射次数间指标值差异无显著性(F=2.157,P>0.05);分组与注射次数间的交互效应不明显(F=0.611,P>0.05),即分组间的差别不随注射次数的不同而改变,如轮廓Fig 1显示。采用调整的基于估计边缘均值的LSD法进行不同分组间指标值的多重比较,METH组、METH+7-NI组的指标值均明显高于7-NI、Control组(P<0.01),METH、METH+7-NI组间差异无显著性(P>0.05),7-NI、Control组间差异无显著性(P>0.05)。

Fig 1 Profile plots of stereotyped behavior of rats
2.2 大鼠纹状体nNOS蛋白和硝基化蛋白的表达情况 大鼠纹状体nNOS蛋白Western blot结果如Fig 2所示,METH组和METH+7-NI组均发现目的蛋白条带,生理盐水组和7-NI组均未发现目的蛋白条带。METH组纹状体中nNOS蛋白表达水平较生理盐水组明显升高(P<0.01),而METH+7-NI组nNOS表达水平较METH组明显降低,相差约3.91倍(P<0.01)。大鼠纹状体硝基化蛋白Western blot结果如Fig 3所示,生理状态下硝基化蛋白有少量的表达;在METH毒性作用下,50 ku和80 ku范围处,硝基化蛋白表达明显升高,总体升高水平约为对照组的3.62倍(P<0.01);7-NI可有效降低硝基化蛋白的表达,与METH组相比相差约2.17倍(P<0.01)。
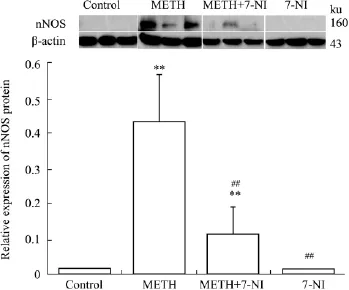
Fig 2 Relative expression of nNOS protein
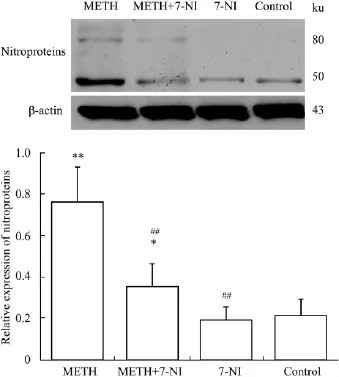
Fig 3 Relative expression of nitroproteins
2.3 纹状体DA含量 各组间比较采用单因素方差分析,经方差齐性检验,方差齐,多重比较采用Shapiro-Wilk法,结果见Fig 4。各组间比较差异有显著性(F=30.575,P<0.01),METH组与其他各组相比,DA明显降低(P<0.01),而METH+7-NI组、7-NI组与对照组比较,DA无差异(P>0.05)。
2.4 Tunel法检测大鼠纹状体细胞凋亡情况Tunel结果表明(Fig 5),各组间比较差异有显著性(F=192.786,P<0.01),METH 神经毒性作用可引起神经细胞发生大量的凋亡(33.23%,P<0.01),而7-NI对凋亡具有明显的保护作用,可使凋亡率下降至12.91%,约为2.57倍(P<0.01)。

Fig 4 DA contents in striatum of rats
3 讨论
METH的分子结构与DA非常相似,能够通过多巴胺能神经元轴突细胞膜的多巴胺转运体(DAT)进入胞内,引起突触小泡内所储存的DA和5-羟色胺(5-HT)大量释放进入细胞质内和突触间隙内,从而引发一系列的神经毒性作用[12]。在众多损伤机制中,氧化应激反应与DA的大量释放之间关系最为密切:过量的DA可引起醌类和超氧化物自由基的不断生成,通过氧化作用对神经细胞及末梢产生广泛性的损伤[13]。氧化应激损伤的分子机制主要依赖于两种有害氧化成分的大量形成,即活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)。

Fig 5 Protective effect of 7-NI on apoptosis in striatum of rats treated with METH by Tunel stain
一氧化氮合酶(nitric oxide synthase,NOS)是体内催化合成一氧化氮的一组蛋白酶,其中nNOS主要分布于神经细胞,调节中枢神经系统内NO浓度。NO主要由精氨酸经NOS分解产生,正常生理条件下,NO作为一种神经递质,在大脑内存在一定的浓度,可调制神经细胞的可塑性,并参与记忆和学习过程[14-16]。病理条件下,NO可与氧自由基反应生成过氧亚硝酸盐(ONOO-),引起脂质、蛋白质及DNA氧化,还可使蛋白质酪氨酸残基发生硝基化,导致细胞功能异常[17]。在中枢神经系统中,METH可诱导NO大量生成[18],随即产生具有强氧化性的神经毒素ONOO-[19]。而ONOO-的主要毒理作用就是针对蛋白质的3位酪氨酸进行硝基化修饰,形成3-硝基酪氨酸(3-NT)。正常水平的3-NT有助于维持蛋白质的生理功能,而过度的硝基化作用则倾向于抑制和破坏蛋白质的功能[20],这可能是METH神经毒性的重要分子机制。
本研究运用Western blot方法,证明METH导致大鼠纹状体nNOS蛋白表达增高以及部分硝基化蛋白水平升高,说明METH通过影响nNOS的活性,导致脑组织内NO生成增加,从而引发损伤性的蛋白质硝基化作用。尽管研究结果显示过量NO会对神经系统造成损害,但为了进一步验证NOS活性升高和METH的神经毒性相关性,我们应用了nNOS特异性的抑制剂7-NI,探讨NOS活性变化与METH神经毒性的关系。
我们的结果显示,在METH给药前预先给动物注射7-NI,能明显抑制METH导致的纹状体DA含量减少,纹状体内DA量的变化是评价METH神经毒性的主要指标。通过Tunel法进行凋亡细胞染色,我们发现METH能明显增加大鼠纹状体细胞凋亡率,考虑上述毒性作用可能由于METH致使机体产生氧化应激反应,多巴胺通道转运功能障碍,毒性产物蓄积,最后导致神经元凋亡[21-23]。预先给予7-NI保护剂组与METH组相比,凋亡细胞明显减少,但尚未降至对照组水平。该结果进一步证实了NOS是METH引起细胞凋亡一个关键因素,7-NI对其有一定程度的保护作用。但由于METH所致的神经细胞的凋亡是多因素、多途径共同作用的结果,单纯抑制NOS尚不足以使细胞凋亡的程度下降至正常水平。
以往相关研究表明,7-NI能够在小鼠体内有效保护METH诱导的神经毒性作用,可以缓解DA耗竭和DAT异常下降,并且能够降低小鼠死亡率,以上结论为我们的研究起到了有益的补充和支持[24-25]。在此基础上,本研究进一步证明,METH诱导的大鼠纹状体凋亡与nNOS及其下游的蛋白质硝基化作用可能具有相关性,这一成果属于首次发现,为今后进一步探索氧化应激作用在METH神经毒性中的分子病理机制提供了可靠依据。
本研究发现,大鼠腹腔注射METH后,出现交感神经兴奋、刻板运动、运动增多、精神改变、易激惹等行为,甚至出现自残现象。METH应用7-NI预处理后,对刻板行为无明显改善,可能是由于METH的神经毒性损害是多因素、多途径参与的过程,单独抑制NOS活性不能完全改善其毒性损害的行为学表现。
总之,本实验研究结果初步显示,METH可导致nNOS活性增高、蛋白质硝基化水平升高、DA含量的降低及细胞凋亡增多等多种神经毒性表现,而nNOS特异抑制剂7-NI能部分减轻其神经毒性作用,但对于动物刻板行为没有保护作用。这些结果为今后应用此动物模型进一步研究nNOS下游通路的作用机制奠定了良好的基础。
[1]丛敏超,鲍彦平,吕宪祥,等.我国药物滥用监测工作调研[J].中国药物依赖性杂志,2013,22(5):386-93.
[1]Cong C M,Bao Y P,LÜ X X,et al.The research on the status of national drug abuse surveillance system[J].Chin J Drug Depend,2013,22(5):386-93.
[2]何荣功.十年来我国毒品滥用趋势与特点的实证分析—兼论我国毒品治理方向的调整[J].辽宁大学学报:哲学社会科学版,2012,40(2):117-23.
[2]He R G.An empirical analysis on the trends and features about abuse of drug in China in the past decade[J].J Liaoning Univ(Philosophy and Social Sciences),2012,40(2):117-23.
[3]Murphy A N,Fiskum G,Beal M F.Mitochondria in neurodegeneration:bioenergetic function in cell life and death[J].J Cereb Blood Flow Met,1999,19(3):231-45.
[4]Deng X,Cai N S,McCoy M T,et al.Methamphetamine induces apoptosis in an immortalized rat striatal cell line by activating the mitochondrial cell death pathway[J].Neuropharmacology,2002,42(6):837-45.
[5]Kita T,Wagner G C,Nakashima T.Current research on methamphetamine-induced neurotoxicity:animal models of monoamine disruption[J].J Pharmacol Sci,2003,92(3):178-95.
[6]宋健文,刘增甲,谭晓辉,等.N-乙酰半胱氨酸减轻大鼠纹状体甲基苯丙胺神经毒性[J].中国药理学通报,2009,25(6):765-9.
[6]Song J W,Liu Z J,Tan X H,et al.N-acetylcysteine attenuates methamphetamine induced neurotoxicity in rat striatum[J].Chin Pharmacol Bull,2009,25(6):765-9.
[7]王双双,杨敏慧,何 琼,等.甲基苯丙胺致大鼠神经毒性及纹状体硝化作用的改变[J].中国药理学通报,2010,26(3):317-20.
[7]Wang S S,Yang M H,He Q,et al.Methamphetamine neurotoxicity and changes of nitration in rats striatum[J].Chin Pharmacol Bull,2010,26(3):317-20.
[8]Li X F,Wang H J,Qiu P M,et al.Proteomic profiling of proteins associated with methamphetamine-induced neurotoxicity in different regions of rat brain[J].Neurochem Int,2008,52(1-2):256-64.
[9]陈 汉,王慧君,李学锋,等.甲基苯丙胺对大鼠脑组织中NO,SOD和MDA的影响[J].中国药物依赖性杂志,2007,16(2):102-4.
[9]Chen H,Wang H J,Li X F,et al.Change of NO,SOD and MDA in methamphetamine-treated rat brain and their correlation[J].Chin J Drug Depend,2007,16(2):102-4.
[10]Sams-Dodd F.Phencyclidine-induced stereotyped behaviour and social isolation in rats:a possible animal model of schizophrenia[J].Behav Pharmacol,1996,7(1):3-23.
[11]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1985:109-28.
[11]Bao X M,Shu X Y.The rat brain in stereotaxic coordinates[M].Beijing:People's Medical Publishing House,1985:109-28.
[12]Iversen L.Neurotransmitter transporters and their impact on the development of psychopharmacology[J].Br J Pharmacol,2006,147(Suppl 1):S82-8.
[13]LaVoie M J,Hastings T G.Dopamine quinone formation and protein modification associated with the striatal neurotoxicity of methamphetamine:evidence against a role for extracellular dopamine[J].J Neurosci,1999,19(4):1484-91.
[14]Susswein A J,Katzoff A,Miller N,et al.Nitric oxide and memory[J].Neuroscientist,2004,10(2):153-62.
[15]Ledo A,Frade J,Barbosa R M,et al.Nitric oxide in brain:diffusion,targets and concentration dynamics in hippocampal subregions[J].Mol Aspects Med,2004,25(1-2):75-89.
[16]Huang E P.Synaptic plasticity:a role for nitric oxide in LTP[J].Curr Biol,1997,7(3):R141-3.
[17]Liu D,Ling X,Wen J,et al.The role of reactive nitrogen species in secondary spinal cord injury:formation of nitric oxide,peroxynitrite,and nitrated protein[J].J Neurochem,2000,75(5):2144-54.
[18]Itzhak Y,Ali S F.Role of nitrergic system in behavioral and neurotoxic effects of amphetamine analogs [J].Pharmacol Ther,2006,109(1-2):246-62.
[19]Pacher P,Beckman J S,Liaudet L.Nitric oxide and peroxynitrite in health and disease[J].Physiol Rev,2007,87(1):315-424.
[20]Lopes M A,Meisel A,Carvalho F D,et al.Neuronal nitric oxide synthase is a key factor in doxorubicin-induced toxicity to rat-isolated cortical neurons[J].Neurotox Res,2011,19(1):14-22.
[21]Fleckenstein A E,Volz T J,Riddle E L,et al.New insights into the mechanism of action of amphetamines[J].Annu Rev Pharmacol Toxicol,2007,47:681-98.
[22]Wink D A,Mitchell J B.Chemical biology of nitric oxide:Insights into regulatory,cytotoxic,and cytoprotective mechanisms of nitric oxide[J].Free Radic Biol Med,1998,25(4-5):434-56.
[23]Brown G C.Regulation of mitochondrial respiration by nitrix oxide inhibition of cytochrome c oxidase[J].Biochim Biophys Acta,2001,1054(1):46-57.
[24]Itzhak Y,Ali S F.The neuronal nitric oxide synthase inhibitor,7-nitroindazole,protects against methamphetamine-induced neurotoxicityin vivo[J].J Neurochem,1996,67(4):1770-3.
[25]Di Monte D A,Royland J E,Jakowec M W,et al.Role of nitric oxide in methamphetamine neurotoxicity:protection by 7-nitroindazole,an inhibitor of neuronal nitric oxide synthase[J].J Neurochem,1996,67(6):2443-50.

