延安地区马铃薯纺锤块茎类病毒的RT-PCR检测与序列分析
冯光惠,杜虎平,李夏隆,亢福仁
(榆林学院生命科学学院,陕西榆林 719000)
马铃薯纺锤块茎类病毒(Potato spindle tuber viroid,PSTVd)是由类病毒(viroid)引起的危害马铃薯产量和品质的主要病害,PSTVd通常减产20% ~60%,严重可导致马铃薯种质退化,与马铃薯X病毒、Y病毒等病毒复合侵染时减产更严重,给农民造成巨大的经济损失。PSTVd极易通过种薯(苗)、花粉、种子、机械或昆虫等多种途径传播,侵染后潜伏期长并持续感染,不能经过茎尖脱毒除去,因而筛选无毒马铃薯种苗是减轻病害、保持优良种质、提高马铃薯产量和品质的有效措施。建立快速、灵敏、准确的类病毒检测技术是保证无毒种苗(薯)生产的关键[1]。
PSTVd是一种无蛋白质外壳的侵染性单链环状RNA分子。由于没有蛋白质外壳,不具有抗原性,不能采用血清学方法检测。近年来,RT-PCR检测技术广泛应用于马铃薯各种病毒和纺锤块茎类病毒的检测,在病毒或类病毒含量极低时也可以快速检测,该方法具有灵敏、快速、准确度高、特异性强等优点,适用于马铃薯及其他植物病毒或类病毒的检测。国内研究者采用RT-PCR方法检测了不同地区的马铃薯纺锤块茎类病毒。董代幸等[2]检测了乌鲁木齐地区的马铃薯纺锤块茎类病毒,并扩增出251 bp的目的片段,与国内外已报道的核酸序列同源性达93.6% ~99.2%;吴志明等[3]检测了河北地区的马铃薯纺锤块茎类病毒,并扩增出360 bp的目的片段,与国内外已报道的核酸序列同源性达98%以上;吕典秋等[4]检测了东北地区的马铃薯纺锤块茎类病毒,扩增出359 bp的目的片段,在与国外序列比较中发现了互换和突变现象。在RT-PCR检测技术基础上,王中康等[5]和 Nie等[6]应用多重 RT -PCR技术分别检测了马铃薯PVX、PVY、PVA、PVS、PLRV 5种病毒和1种纺锤类病毒(PSTVd),极大地提高了马铃薯病毒和类病毒的检测效率。
延安地区的马铃薯种植面积约占陕西省马铃薯种植总面积的20%,马铃薯是带动地方农业经济发展的重要农作物,每年不断增加脱毒种薯种植面积和引进新品种,随着种植年代的增加,病毒在马铃薯体内不断积累,严重影响马铃薯的产量和品质。目前尚未见用RT-PCR法检测和分析延安地区马铃薯纺锤块茎类病毒的报道。本试验以延安地区不同乡镇种植2~3代的疑似带病毒马铃薯为研究对象,采用RT-PCR方法检测该地区的马铃薯纺锤块茎类病毒(PSTVd),并对PSTVd基因序列进行分析,了解PSTVd的变异程度,以期为脱毒马铃薯的种苗(薯)繁育和推广种植提供依据。
1 材料与方法
1.1 材料
(1)样品的采集。在马铃薯生长盛期至成熟期,采集马铃薯疑似带病毒植株叶片,于常温下保存于保湿组织培养瓶中,运回实验室后于4℃冰箱保存。马铃薯样品信息见表1。

表1 本研究中所用马铃薯样品信息
(2)仪器与试剂。主要仪器有PCR仪、高速冷冻离心机、电泳系统、凝胶成像系统。Trizol试剂及cDNA合成试剂盒、DNA胶回收试剂盒、pGEMTeasy载体、Taq DNA 聚合酶、dNTP、10×buffer均购自北京全式金生物科技有限公司。
(3)引物设计。根据GenBank数据库中登录的马铃薯纺锤块茎类病毒基因组序列,利用引物设计软件Primer 5设计1对特异引物,上游引物为5'-GAAACCTGGAGCGAACTG-3',下游引物为5'-CG GTTCCAAGGGCTAAAC-3'。预期扩增片段长度为251 bp,引物由南京金斯瑞生物科技有限公司合成,将其用灭菌TE(pH 8.0)稀释至浓度为10 μmol/L。
1.2 方法
(1)马铃薯纺锤块茎类病毒的RT-PCR检测。
马铃薯总RNA的提取。采用Trizol法,参照文献[7]方法进行,略做改动。具体步骤是:称取0.1 g马铃薯叶片在研钵中用液氮研磨,取1.5 mL离心管加入1 mL Trizol液,将研磨液与Trizol液混合均匀;4℃、12 000 r/min离心15 min;转移上清液至另一离心管中,加入0.2 mL氯仿,涡旋混匀,室温放置5 min,4℃、12 000 r/min 离心 15 min;取上清液(水相)于另一离心管中,按上清液体积分别加入1/2体积的异戊醇、0.8 mol/L柠檬酸钠和1.2 mol/L氯化钠,混合均匀,室温放置5~10 min,4℃、12 000 r/min离心8 min,弃上清液,用1 mL 75%的乙醇洗涤沉淀2次,4℃、12 000 r/min离心15 min,小心倒掉乙醇,室温自然干燥后溶于用 DEPC处理过的ddH2O,于-80℃条件下保存。
cDNA的合成。按照cDNA合成试剂盒说明书操作,对提取的马铃薯叶片总RNA进行反转录。具体反应体系如下:马铃薯总RNA 5 μL,Anchored Oligo(dT)18(0.5 μg/μL)1 μL,2 × ES Reaction Mix 10 μL,EasyScript RT Enzyme Mix 1 μL,加 RNase -free Water至20 μL。混匀后,水浴锅中42℃孵育30 min,PCR仪中于85℃条件下加热失活5 min。
PCR反应及产物检测。PCR反应体系:cDNA 3 μL,上游引物 1 μL,下游引物 1 μL,10 × buffer 5 μL,2.5 mmol/L dNTPs 4 μL,Taq DNA 聚合酶1 μL,加ddH2O至 50 μL。PCR反应程序:94℃ 5min;94℃ 30 s,60℃ 30 s,72℃ 30 s,35 个循环;72℃10 min。取 6 μL PCR 扩增产物与 1 μL Loading Buffer混匀,用1.5%的琼脂糖凝胶电泳检测PCR产物,于凝胶成像系统中照相。
(2)克隆及序列分析。用DNA胶回收试剂盒回收纯化PCR产物,将其与pGEM-Teasy载体连接过夜,转化大肠杆菌Trans1-T1感受态细胞,在加有IPTG和X-gal的LB平板上筛选白色菌落,于LB液体培养基中培养,采用碱裂解法提取质粒,采用EcoRⅠ和HindⅢ限制性内切酶对重组质粒进行鉴定。将含目的条带的阳性重组质粒送南京金斯瑞生物科技有限公司测序。用DNAstar软件分析类病毒基因序列相似性,并与GenBank中搜索国内外14个不同地区(表2)的马铃薯纺锤块茎类病毒基因进行序列相似性分析。

表2 国内外14个不同地区马铃薯纺锤块茎类病毒序列的信息
2 结果与分析
2.1 马铃薯纺锤块茎类病毒的RT-PCR检测
对采自延安地区8个县(区)不同乡镇马铃薯叶片所含纺锤块茎类病毒的 RT-PCR产物用1.5%的琼脂糖凝胶电泳进行检测,结果发现均能扩增出预期长度的目的条带(图1),表明这些马铃薯植株均感染了PSTVd。

图1 马铃薯纺锤块茎类病毒的RT-PCR检测结果
2.2 马铃薯纺锤块茎类病毒的序列一致性分析
用DNAstar软件对马铃薯纺锤块茎类病毒序列进行分析,结果表明,延安地区8个县(区)各乡镇PSTVd序列大小为247~251 bp,出现少量碱基突变或缺失,并对编码的氨基酸产生影响,该地区8个采样点之间的序列一致性也有所差异,处在98.2% ~99.7%之间,表明该地区部分乡镇的PSTVd基因序列发生了一定程度的变异。其中,志丹县顺宁镇、安塞县化子坪镇和宝塔区万花乡之间的序列一致性为99.7%;子长县栾家坪乡和延川县马家河乡之间的序列一致性为99.5%;宜川县丹川镇、富县直罗镇、吴起县铁边城镇和其它乡镇之间的序列一致性相对较低。就地理位置而言,延安地区中南部的宜川县丹川镇、富县直罗镇的PSTVd变异程度较高,北部县区各乡镇的PSTVd变异较轻。以志丹县顺宁镇、延川县马家河乡、宜川县丹川镇、富县直罗镇的马铃薯纺锤块茎类病毒基因序列为对照,与国内外其他地区14个样品的PSTVd基因进行比较,序列一致性在80.4% ~99.2%(表3)。
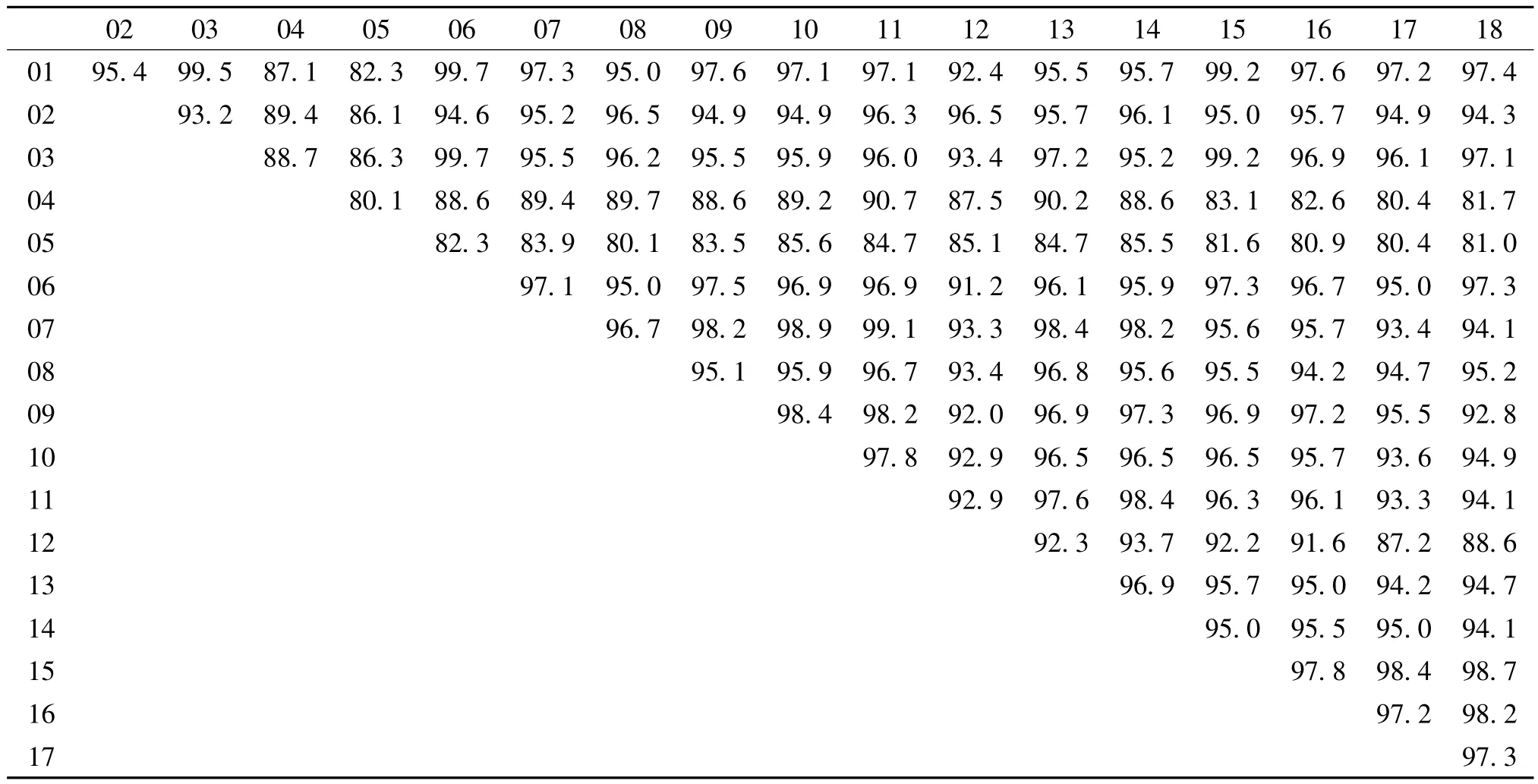
表3 马铃薯纺锤块茎类病毒的序列一致性分析
3 讨论
本研究调查发现,延安地区8个县(区)不同乡镇最近几年都在推广种植脱毒马铃薯,但一级脱毒种薯种植2~3年后,马铃薯植株出现不同症状,产量也呈逐年下降趋势,说明马铃薯单一病毒(类病毒)或各种复合病毒在马铃薯体内存在。原因之一是地方检疫部门对马铃薯脱毒苗及各级种薯的检验检疫监督不严,造成将带毒种薯发放给农民种植;二是脱毒马铃薯都是通过茎尖剥离组织培养脱毒的,而马铃薯纺锤块茎类病毒很难通过茎尖剥离脱毒,造成多数脱毒种苗(薯)脱除了病毒,实际还携带类病毒,只是单独类病毒对产量和品质的影响不够明显,在田间种植2~3代后,与其他病毒复合感染,从而造成产量和品质明显下降。
RT-PCR分子检测技术可快速、准确地检测马铃薯的带毒情况,是近年来国内外应用较为普遍的病毒检测技术,该技术的应用对脱毒马铃薯种薯的推广及马铃薯产业的发展具有重要意义。笔者认为,在普通RT-PCR体系中,只要提取的马铃薯总RNA品质高,在检测不同种类的病毒和类病毒时,设计不同的特异引物,就能扩增出预期的目的条带,而且不会发生假阴性现象,检测效果好。另外,在用RT-PCR检测类病毒PSTVd以及常见的6种病毒PVX、PVY、PVS、PVA、PVM 和 PLRV 时,可通过改变PCR反应体系中的温度,从而在PCR仪中实现多种病毒的同步检测。
通过克隆测序,可了解马铃薯病毒或类病毒的变异程度。马铃薯不同病毒或类病毒的变异也有差异,本试验研究延安地区8县(区)不同乡镇马铃薯纺锤类病毒基因的序列一致性在98.2%~99.7%,而同为陕北地区的榆林10县区不同乡镇的PSTVd的序列一致性均在99.7%以上,病毒变异率高低以及不同地区病毒变异率差异大小是否会对马铃薯的产量和品质产生影响,单一病毒或类病毒及复合病毒感染对产量和品质的影响关系都有待进一步研究。
[1]Navarro B,Silletti MR,Serio FD.Identification and characterization of potato spindle tuber viroid infecting tomato in Italy[J].Journal of Plant Pathology,2009,91(3):723-726.
[2]董代幸,罗 明,王丽丽,等.乌鲁木齐地区马铃薯纺锤块茎类病毒的检测与序列分析[J].西北农业学报,2010,19(9):38 -42.
[3]吴志明,贾晓梅,谢晓亮,等.马铃薯纺锤块茎类病毒RT-PCR检测及全序列分析[J].华北农学报,2003,18(S1):63-65.
[4]吕典秋,李学湛,杨希才,等.马铃薯纺锤块茎类病毒(PSTVd)东北分离物的核苷酸序列分析[J].农业生物技术学报,2005,13(1):131 -132.
[5]王中康,夏玉先,袁 青,等.马铃薯种苗复合感染病毒多重RT-PCR同步快速检测[J].植物病理学报,2005,35(2):109 -115.
[6]Nie X,Singh RP.A novel usage of random primers for multiplex RT-PCR detection of virus and viroid in aphids,leaves,and tubers[J].Journal of Virological Methods,2001,91(1):37 -49.
[7]Courtney EJ,Amy OC,David KW.Evaluation of isolation methods and RNA integrity for bacterial RNA quantitation[J].Journal of Microbiological Methods,2008,75(2):318-324.

