云南白药结合宫腔水囊压迫治疗产后出血的疗效分析
覃亦伟
产后出血(postpartum hemorrhage,PPH)是目前分娩严重的并发症之一,在我国是孕产妇死亡的首要原因,发病率占分娩总数的2%~3%,是产科现代医学防治的重要课题[1]。在产科出血的常见病因中,胎盘因素约占20%,常是由于胎盘粘连和胎盘部分植入造成的,如何快速、有效和安全的止血是抢救产后出血成功的关键[2]。既往治疗多采用单纯宫腔水囊压迫,本研究运用云南白药的止血抗炎机制,结合宫腔水囊压迫治疗胎盘胎膜残留性产后出血,取得较好疗效,现报道如下。
1 资料与方法
1.1 一般资料 选择2013年1月-2014年1月南方医科大学附属花都医院围产医学中心收治的因胎盘残留原因所致产后出血患者68例。年龄24~42岁,平均(30±5)岁,68例患者均达到产后出血诊断标准,阴道出血量超过800 mL,平均(650±220)mL,经B超检查确诊由于胎盘残留引起,残留胎盘面积>3 cm。将患者随机分为对照组(单纯水囊组,n=32)和试验组(云南白药纱布垫+水囊组,n=36),入选患者均无云南白药过敏史及严重内科合并症。出血早期均先采用按摩子宫、加大缩宫素剂量,无效。
1.2 方法 首先两组患者均经阴放置时先插尿管测量尿量,取截石位,窥阴器或阴道拉钩暴露宫颈,在无菌操作下,置入水囊,试验组加用外部折叠4~6层用云南白药20 g+生理盐水50 mL的液体浸润的无菌纱布垫,以不影响水囊扩张为宜,面积10 cm ×10 cm,于水囊侧胎盘胎膜残留处贴敷。将两组均送至宫底部,用50 mL注射器经注水口缓慢注入生理盐水400~500 mL,通过宫颈未见出血,说明填塞已成功,无需再注入液体。将末端折起扎紧并包裹浸有甲硝唑注射液的纱布卷塞于阴道内,确保水囊位置不变。两组均重点观察出血情况,严密观察生命体征、宫底高度、子宫出血情况。常规应用足量广谱抗生素3~5 d预防感染,静脉注射宫缩剂、止血剂,纠正贫血,抗休克治疗,保持外阴清洁。宫腔水囊留置12 h后,如果出血明显减少,则每10分钟自水囊抽水30~50 mL,观察10 min,出血量<10 mL,可逐渐抽水直至取出水囊。如出血量10~20 mL,观察1 h后如无出血可继续抽水。如出血量>20 mL,立即注水30~50 mL,观察2 h后无出血再继续抽水,最晚24 h 取出水囊[3]。
1.3 观察指标 操作所需时间、止血显效时间、留置时间;取出过程阴道出血量、取出后12、24 h阴道出血量;血性恶露持续时间、1周内残留物排除(<3 cm)及产褥病率。阴道出血量估计按称重法计算(1.05 g=1 mL)[4]。
1.4 统计学处理 所有数据均应用 SPSS 19.0软件进行统计学分析。计量资料符合正态分布的用(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组操作所需时间、止血显效时间、留置时间比较 两组操作时间比较差异无统计学意义,试验组止血显效时间及留置时间均少于对照组,差异有统计学意义(P<0.01),见表1。
表1 两组操作所需时间、止血显效时间、留置时间比较(±s)
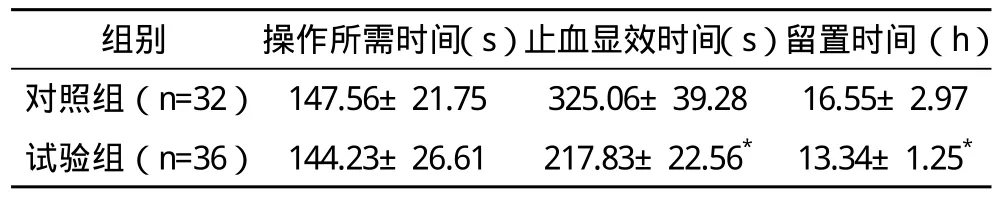
表1 两组操作所需时间、止血显效时间、留置时间比较(±s)
*与对照组比较,P<0.01
?
2.2 两组间取出过程阴道出血量、取出后12 h、24 h阴道出血量比较 两组24 h留置出血量、取出过程阴道出血量、取出后12 h、24 h阴道出血量比较差异均有统计学意义(P<0.01)。见表2。
表2 两组取出过程阴道出血量、取出后12 h、24 h阴道出血量比较(±s)mL
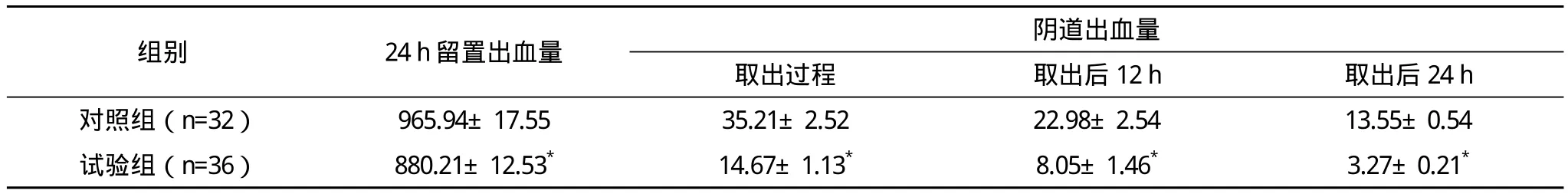
表2 两组取出过程阴道出血量、取出后12 h、24 h阴道出血量比较(±s)mL
*与对照组比较,P<0.01
组别 24 h留置出血量 阴道出血量取出过程 取出后12 h 取出后24 h对照组(n=32)965.94±17.55 35.21±2.52 22.98±2.54 13.55±0.54试验组(n=36)880.21±12.53* 14.67±1.13* 8.05±1.46* 3.27±0.21*
2.3 两组血性恶露持续时间、1周内残留物排除(<3 cm)及产褥病率比较 两组血性恶露持续时间、1周内残留物排除及产褥病率比较差异均有统计学意义(P<0.01)。见表 3。
表3 两组血性恶露持续时间、1周内残留物排除(<3 cm)及产褥病率比较(±s)
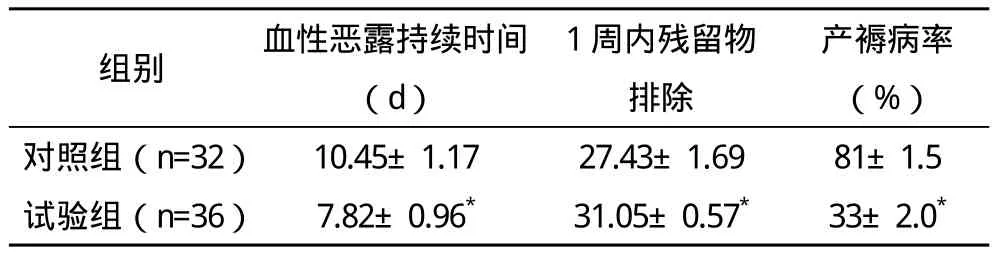
表3 两组血性恶露持续时间、1周内残留物排除(<3 cm)及产褥病率比较(±s)
*与对照组比较,P<0.01
组别 血性恶露持续时间(d)1周内残留物排除产褥病率(%)对照组(n=32)10.45±1.17 27.43±1.69 81±1.5试验组(n=36)7.82±0.96* 31.05±0.57* 33±2.0*
3 讨论
产后出血是产科急危重症中最为常见的一种疾病,若处理不及时或不当,会严重危及产妇生命[5]。胎盘残留引起的产后出血多是由于胎盘剥离面残留血管出血和由于胎盘残留引起宫缩乏力导致产后出血,常规在出血量>800 mL推荐使用宫腔内水囊压迫止血,水囊填塞宫腔是利用球囊流体静力学的原理,通过水囊内的压力超过子宫血管内压力,迫使接近水囊壁的血管闭锁,而压迫子宫静脉窦而达到止血目的[6]。胎盘胎膜残留性产后出血应用宫腔水囊压迫止血正是常规治疗的一种有效方法,宫腔水囊压迫止血法是通过导管注水使水囊逐渐增大,对宫腔产生一定的压力和机械性刺激,压迫宫腔创面,促使子宫收缩而止血,同时通过宫腔水囊压迫,迫使接近水囊的宫壁血管闭锁,使宫体部达到物理止血的目的。水囊压迫使整个宫腔充分扩张,宫腔压力高于动脉压,压迫子宫内膜表面的静脉渗血,使出血停止或减少;同时宫腔扩张刺激子宫肌层反射性引起子宫收缩,起到止血的作用[7]。
本研究中对照组采用单纯水囊压迫,试验组在应用水囊压迫同时加用云南白药纱布垫[8],因为云南白药为中成药,具有止血、消炎、愈创、活血化瘀的功效,作用于创面能诱导血小板的释放和聚集[9],缩短出、凝血时间和凝血酶原时间,且能抑制炎性物质的释放。产后出血主要为子宫创面大出血,用浸有云南白药的纱布垫加水囊填塞压迫宫腔,纱布垫与子宫内膜胎盘胎膜残留处充分接触[10],云南白药直接作用于出血创面并迅速吸收,促使血液凝固,加速止血,不会出现血管内异常凝血。水囊膨胀压迫宫壁减少了内膜表面静脉渗血,且压迫面积广泛,不会残留死腔造成隐性出血,也不影响子宫的节律性收缩[11]。
在本研究结果显示,对照组操作所需时间为(147.56±21.75)s,试验组为(144.23±26.61)s,两组比较差异无统计学意义(P>0.05)。而试验组止血显效时间为(217.83±22.56)s,留置时间为(13.34±1.25)h,24 h留置出血量为(880.21±12.53)mL,取出过程阴道出血量为(14.67±1.13)mL,取出后12、24 h阴道出血量分别为(8.05±1.46)mL、(3.27±0.21)mL,血性恶露持续时间为(7.82±0.96)d,1周内残留物排除(<3 cm)为(31.05±0.57),产褥病率为(33±2.0)%,与对照组比较差异均有统计学意义(P<0.01)。说明试验组止血效果明显,在留置时间和住院时间方面明显缩短,可降低子宫感染发生风险。
综上所述,两种方法均能及时地控制胎盘残留性产后出血,而云南白药结合宫腔水囊压迫止血操作更有效快速[12],可在短时间内控制出血,术后易于观察出血情况,且并发症少[13]。云南白药结合宫腔水囊压迫止血是一种简便有效的止血方法[14],对于治疗胎盘因素所致的产后出血效果良好[15-17],且操作简单、取材方便、费用低廉、起效快、无不良反应,值得在产科临床予以推广使用。
[1]Powers R W,Jeyabalan A,Clifton R G,et al.Soluble fms-Like tyrosine kinase 1 (sFlt1),endoglin and placental growth factor (PlGF)in preeclampsia among high risk pregnancies[J].PLOS One,2010,5(10):62-64.
[2]George E M,Arany M,Cockrell K,et al.Induction of heme oxygenase-1 attenuates sFlt-1-induced hypertension in pregnant rats[J].Am J Physiol Regul Integr Comp Physiol,2011,301(5):495-500.
[3]田彩虹.妇产科涉及的医疗护理安全问题与管理对策[J].中国医学创新,2013,10(5):84-85.
[4]George E M,Cockrell K,Aranay M,et al.Induction of heme oxygenase 1 attenuates placental ischemia-induced hypertension[J].Hypertension,2011,57(5):941-948.
[5]Cornely O A,Kreyssig C,Hemphill L,et al.Pilot study of extracorporeal removal of soluble fms-like tyrosine kinase 1 in preeclampsia[J].Circulation,2011,124(8):940-950.
[6]Yu J,Shixia C Z,Wu Y,et al.Inhibin A,activin A,placental growth factor and uterine artery Doppler pulsatility index in the prediction of pre-eclampsia[J].Ultrasound Obstet Gynecol,2011,37(5):528-533.
[7]Mikat B,Zeller A,Scherag A,et al.β-hCG and PAPP-A in First Trimester:Predictive Factors for Preeclampsia?[J].Hypertens Pregnancy,2011,31(2):261-267.
[8]Akolekar R,Veduta A,Minekawa R,et al.Maternal plasma P-selectin at 11 to 13 weeks of gestation in hypertensive disorders of pregnancy[J].Hypertens Pregnancy,2011,30(3):311-321.
[9]Verlohren S,Herraiz I,Lapaire O,et al.The sFlt-1/PlGF ratio in different types of hypertensive pregnancy disorders and its prognostic potential in preeclamptic patients[J].Am J Obstet Gynecol,2012 ,206(1):58-62.
[10]Vaisbuch E,Romero R,Mazaki-Tovi S,et al.Retinol binding Protein 4-a novel association with early-onset preeclampsia[J].J Perinat Med,2010,38(14):129-139.
[11]Tosun M,Celik H,Avci B,et al.Maternal and umbilical serum levels of interleukin-6,interleukin-8,and tumor necrosis factor-α in normal pregnancies and in pregnancies complicated by preeclampsia[J].J Matern Fetal Neonatal Med,2010,23(15):880-886.
[12]陈尚轩.探讨产后出血的有效预防与护理体会[J].中国医学创新,2013,10(1):51-52.
[13]Bell M J.A historical overview of Preeelampsia-eclampsia[J].J Obstet Gynecol Neonatal Nurs,2010,39(45):510-518.
[14]F Gary Cunningham.Williams manual of obstetrics[M].23rd edition.McGraw-Hill,2005:144-152.
[15]Kårehed K,Wikström A K,Olsson AK,et al.Fibrinogen and histidine-rich glycoprotein in early-onset preeclampsia[J].Acta Obstet Gynecol Scand,2010,89(1):131-139.
[16]Yu J,Shixia C Z ,Wu Y,et al.The study of inhibin A,activin A,Placental growth factor and uterine artery Doppler pulsatility index to predict pre-eclampsia[J].Ultrasound Obstet Gynecol,2010,24(14):456.
[17]Vaisbuch E,Romero R,Mazaki-Tovi S,et al.Retinol binding Protein 4-a novel association with early-onset preeclampsia[J].J Perinat Med,2010,38(36):129-139.

