七叶皂苷钠对急性肺损伤模型大鼠的保护作用
王岑立,陈淑梅,李晓雯,周广,叶小群(.宁波镇海第二医院,浙江宁波35207;2.南昌大学第二附属医院,南昌 330006)
急性肺损伤(Acute lung injury,ALI)是临床常见危重症,病死率高。虽然导致急性肺损伤病因多样,如严重感染、休克、创伤等,但各种原因引起的急性肺损伤具有共同的病理基础,即肺泡毛细血管急性损伤,通透性增强,肺间质淤血、渗出、水肿,肺泡透明膜形成和肺泡萎缩,从而造成肺通气与血比例失调,分流量增加,导致严重缺氧状态[1]。现今已对急性肺损伤进行大量基础和临床研究,但干预手段和方法较有限。七叶皂苷是由欧洲七叶树、日本七叶树、中华七叶天师栗的果实娑罗子中提取的一类三萜皂苷化合物,具有减缓组织水肿、恢复血管通透性、抗炎等功效,临床上广泛应用于各种原因引起的肺水肿、创伤或手术所致肿胀的治疗;最近研究发现七叶皂苷钠可保护上皮细胞,减轻低氧和炎症对其的损伤[2],故笔者推测七叶皂苷钠可能减缓急性肺损伤。本研究旨在通过油酸致大鼠急性肺损伤模型观察七叶皂苷钠对其的保护作用。
1 材料
1.1 仪器
Allegra 25R型离心机(美国Beckman公司);ELX800型酶标仪(美国Bio-Tek公司);202-00A型电热恒温烤箱(上海叶拓仪器仪表有限公司);CKX3型倒置相差显微镜(日本Olympus公司);1658型蛋白电泳仪(美国Bio-Rad公司)。
1.2 药品与试剂
七叶皂苷钠注射液(哈尔滨圣泰制药股份有限公司,批号:2010060202);肿瘤坏死因子(TNF)-α试剂盒(美国Sigma公司);水通道蛋白(AQP)1兔抗鼠抗体(武汉博士德生物工程有限公司);超敏ECL化学发光试剂盒(江苏碧云天生物技术有限公司)。
1.3 动物
清洁级SD大鼠45只,♀♂兼用,体质量200~250 g,购自第三军医大学新桥医院动物房[实验动物使用许可证号:SCXK(渝)2009-004]。
2 方法
2.1 复制模型与分组、给药
大鼠尾静脉缓慢注射油酸(0.1 ml/kg)以复制急性肺损伤模型。45只SD大鼠随机均分为3组,即正常对照(等容生理盐水)组、模型(等容生理盐水)组、七叶皂苷钠(5 mg/kg)组,复制模型30 min后尾iv给药,
2.2 大鼠肺组织湿/干质量比(W/D)的测定
大鼠尾iv给药12 h后,麻醉开胸,剪取右肺上叶相同部位,用滤纸吸去水分和血迹称湿质量,再置电热恒温烤箱中,烘烤48 h至干质量恒定称质量,计算W/D。
2.3 肺组织病理学观察
大鼠处死后,剪取左肺,切0.5 cm3组织块,4%多聚甲醛固定24 h,组织脱水12 h,石蜡包埋,HE染色,光镜下观察大鼠肺组织病理学。
2.4 酶联免疫吸附(ELISA)法检测大鼠血清TNF-α含量
大鼠处死前取动脉血2 ml,室温自然凝固10~20 min,以离心半径为25 cm、3 500 r/min离心20 min,得血清,-70℃贮藏,备用。按ELISA测试盒说明书步骤进行检测。
2.5 Western blot法检测大鼠肺组织AQP1蛋白的表达
大鼠处死后,分离相同肺组织,提取总蛋白,BCA法测定蛋白质量浓度。制备SDS-PAGE凝胶,每孔加样40 μg进行电泳。300 mA湿转25 min,将PVDF膜放入5%脱脂奶粉中室温封闭2 h,分别加入兔抗鼠AQP1抗体(1∶100,V/V)及兔抗GAPDH抗体(1∶5 000,V/V)的稀释液中4℃过夜,用TBST洗涤3次,每次5 min,然后放入二抗(辣根酶标记山羊抗兔,1∶5 000,V/V)室温孵育1 h,TBST洗涤3次,每次5 min,用ECL化学发光法检测蛋白表达水平。所得蛋白条带图片使用Image-Pro Plus 10.0进行分析,以同一标本GAPDH的产物光密度(OD)作为内参,校正各自目的蛋白的OD,按公式(相对值=目标蛋白产物的OD/GAPDH的OD)计算出相对值。
2.6 统计学方法
数据以±s表示,采用SPSS13.0软件处理分析实验数据。两组均数间比较用配对t检验。P<0.05为差异有统计学意义。
3 结果
3.1 七叶皂苷钠对模型大鼠肺组织W/D的影响
与正常对照组比较,模型组大鼠肺组织W/D升高,差异有统计学意义(P<0.05);与模型组比较,七叶皂苷钠组大鼠肺组织W/D降低,差异有统计学意义(P<0.05)。七叶皂苷钠对模型大鼠肺组织W/D的影响见表1。
3.2 七叶皂苷钠对模型大鼠肺组织病理切片的影响
正常对照组大鼠肺泡腔内无分泌物,肺泡壁结构完整,无炎性细胞浸润及红细胞渗出;模型组大鼠肺组织变化明显,可见肺间质及肺泡水肿,肺泡腔内有浆液性渗出物及大量炎性细胞、红细胞渗出,部分肺间隔增厚;七叶皂苷钠组大鼠肺组织水肿程度明显下降,肺泡腔内炎症细胞渗出减轻。大鼠肺组织病理切片见图1。
表1 七叶皂苷钠对模型大鼠肺组织W/D的影响(±s,n=15)Tab 1 Effects of aescinate sodium on W/D of model rats(±s,n=15)
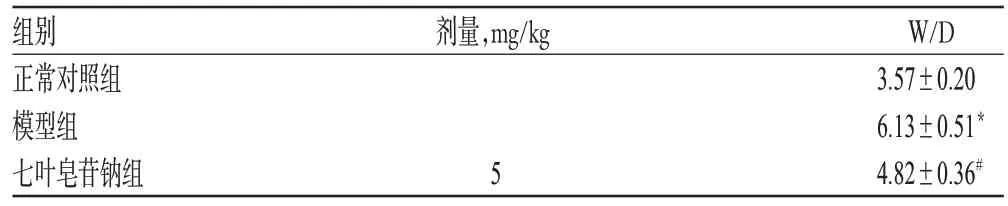
表1 七叶皂苷钠对模型大鼠肺组织W/D的影响(±s,n=15)Tab 1 Effects of aescinate sodium on W/D of model rats(±s,n=15)
与正常对照组比较:*P<0.05;与模型组比较:#P<0.05vs.normal control group:*P<0.05;vs.model group:#P<0.05
组别正常对照组模型组七叶皂苷钠组W/D 3.57±0.20 6.13±0.51*4.82±0.36#剂量,mg/kg 5
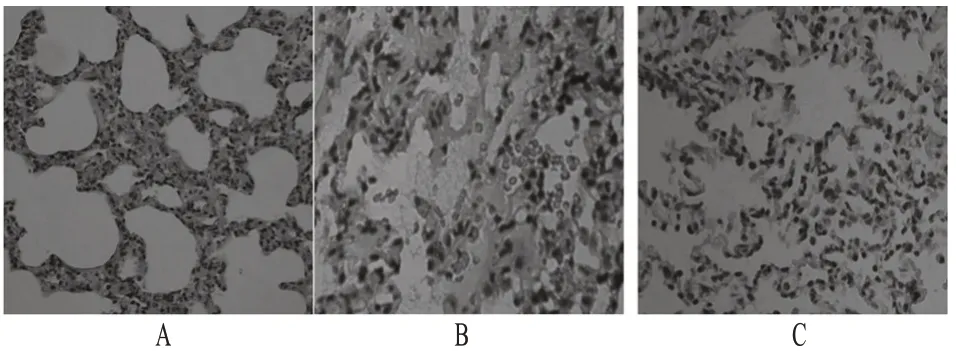
图1 大鼠肺组织病理切片Fig 1 Histological detection of lung tissue in rats
3.3 七叶皂苷钠对模型大鼠血清TNF-α含量的影响
与正常对照组比较,模型组大鼠血清TNF-α含量增加,差异有统计学意义(P<0.05);与模型组比较,七叶皂苷钠组大鼠血清TNF-α含量减少,差异有统计学意义(P<0.05)。七叶皂苷钠对模型大鼠血清TNF-α含量的影响见表2。
表2 七叶皂苷钠对模型大鼠血清中TNF-α含量的影响(±s,n=15)Tan 2 Effects of aescinate sodium on TNF-α concentration in serum of model rat(s±s,n=15)

表2 七叶皂苷钠对模型大鼠血清中TNF-α含量的影响(±s,n=15)Tan 2 Effects of aescinate sodium on TNF-α concentration in serum of model rat(s±s,n=15)
与正常对照组比较:*P<0.05;与模型组比较:#P<0.05vs.normal control group:*P<0.05;vs.model group:#P<0.05
组别正常对照组模型组七叶皂苷钠组TNF-α,ng/L 120.43±4.31 184.31±6.35*163.02±5.45#剂量,mg/kg 5
3.4 七叶皂苷钠对模型大鼠肺组织AQP1蛋白表达的影响
与正常对照组比较,模型组大鼠肺组织AQP1蛋白表达增强,差异有统计学意义(P<0.05);与模型组比较,七叶皂苷钠组大鼠肺组织AQP1蛋白表达减弱,差异有统计学意义(P<0.05)。AQP1蛋白的表达见图2。
4 讨论
急性肺损伤是一组以肺容积减少、肺顺应性降低、严重的通气/血流比例失调为病理生理特征的病变,其病理基础是通透性肺水肿,表现为急性进行性加重的呼吸困难、顽固性低氧血症及肺水肿,其发病机制仍未完全阐明,尚无有效的治疗及阻止病程进展的良好方法[1]。临床虽采取机械通气及支持对症为主的传统治疗,但由于缺乏早期、敏感的诊断指标,病死率接近40%。因此,通过检测其早期血清及肺组织的炎性相关因子或蛋白(如TNF-α、AQP1)对急性肺损伤的诊断与治疗具有积极的意义。
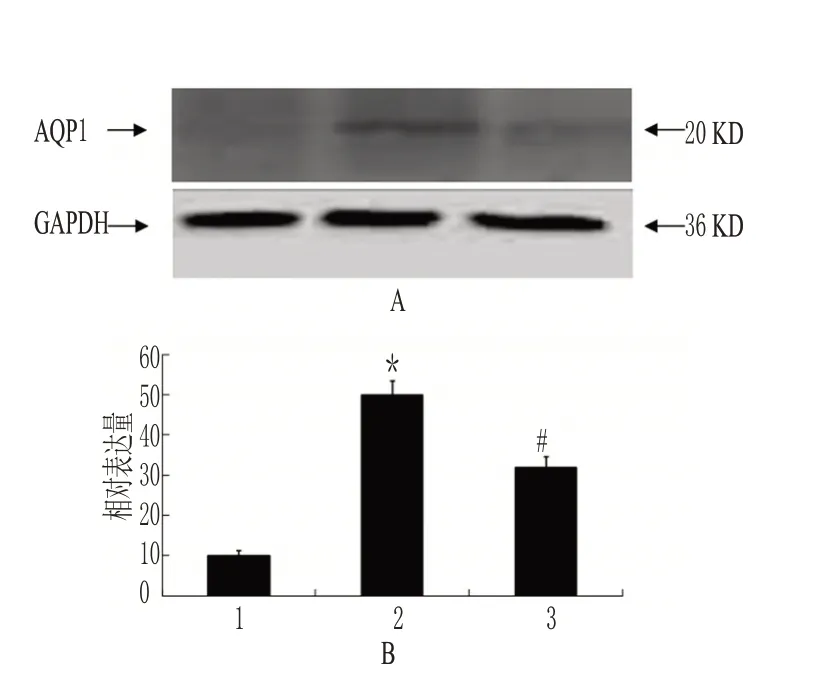
图2 AQP1蛋白的表达Fig 2 Protein expression of AQP1
七叶皂苷钠是从七叶树科植物天师栗的干燥成熟种子中获取的三萜皂苷化合物,可降低毛细血管通透性、抗渗出及增加静脉张力、抗炎和改善血液循环。研究证实,七叶皂苷钠在治疗毛细血管通透性增高的疾病中具有类似地塞米松的持久抗炎作用,同时与之相比并无明显提高脾脏指数、胸腺指数、淋巴细胞计数及血清TNF-α水平等效应[2]。研究表明,七叶皂苷钠具有抗氧化、清除自由基功能,可减少组织细胞能量的消耗,维持血管内皮细胞的功能,并且七叶皂苷钠可通过激活内皮细胞,增加对中性粒细胞的黏附性而减少中性粒细胞的渗出,有效减少活性氧的生成和清除氧自由基[3]。此外,研究还发现,七叶皂苷钠还可增强血管壁张力和收缩性,改善微循环,促进淋巴回流,改善毛细血管血液淤滞状态,明显增强胸部淋巴流速[4]。这些作用机制有助于改善肺水肿,减少肺泡液体渗出及促进液体从肺毛细血管的重吸收。
本研究结果表明,与正常对照组比较,模型组大鼠肺组织中肺泡腔内炎性细胞渗出增加,且W/D、TNF-α含量明显上升,AQP1蛋白表达明显增强。与模型组比较,七叶皂苷钠组大鼠肺组织W/D降低,提示大鼠肺组织含水量明显下降,揭示七叶皂苷钠对减轻模型大鼠肺水肿有一定意义。其作用机制可能与以下相关:(1)七叶皂苷钠系含多酯键的三萜皂苷化合物,可触发血浆促肾上腺皮质激素、皮质类固醇及其受体的释放,有利于肺微血管内皮细胞(PMEC)屏障的修复,改善微循环及组织血供,消除局部肿胀[5-6];(2)清除氧自由基,抑制脂质过氧化反应[6];(3)皮质类固醇及其受体的释放引发下游前列腺素F2α的分泌,拮抗前列腺素(PGE)1、缓激肽及5羟色胺(5-HT)等炎性介质,发挥抗炎、抗水肿作用[7]。
随着急性肺损伤的进一步研究,AQP在肺水肿进展中的作用越来越受到重视。到目前为止,在人类各组织上共发现13种不同的AQP,其中表达于呼吸系统的有6种(AQP1、AQP3、AQP4、AQP5、AQP8、AQP9),分别表达于呼吸系统的不同部位[8-9]。AQP1是最早发现且对其结构研究最清楚的水通道蛋白,广泛分布于PMEC中,是水分子的快速转运通道,在病理条件下与肺组织液体转运息息相关,参与了多种肺水肿疾病的进展,且在肺组织中的表达受TNF-α的调控[10]。各类原因导致的急性肺损伤不仅造成PMEC屏障的破坏,同时伴随肺组织水转运的失衡。然而,针对AQP的表达仍有分歧。以往的研究发现,TNF-α与AQP1呈负相关,急性肺损伤时位于PMEC的AQP1表达下调,可致使肺泡-毛细血管间水转运受阻,大量液体积聚肺泡腔及肺间质[11]。然而Lai KM等[12]研究发现,炎症因子亦可诱导AQP1上调表达;Alexander JJ等[13]的研究指出,在脓毒血症致大鼠脑损伤模型中,TNF-α可通过TNF受体1上调AQP4的表达,引起脑水肿等,与Jang AS等[14]在博来霉素诱发的肺损伤中AQP5上调表达相一致。在本研究中,七叶皂苷钠组大鼠肺组织TNF-α和AQP1蛋白表达较模型组都有明显下降,可推测七叶皂苷钠可能通过抑制血清TNF-α的产生,继而影响AQP1蛋白表达,从而达到减轻肺水肿的目的,但其机制仍不清楚。AQP的表达高低可能与损伤的部位及作用时间有关,但尚需严密的实验证实。
综上所述,七叶皂苷钠可有效抑制急性肺损伤,其可能是通过抑制TNF-α间接下调AQP1的表达从而轻肺水肿程度,但其分子机制仍需深入研究。
[1]中华医学会重症医学分会.急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南:2006[J].中华内科杂志,2007,46(5):430.
[2]Wang T,Fu F,Zhang L,et al.Effects of escin on acute inflammation and the immune system in mice[J].Pharmacol Rep,2009,61(4):697.
[3]Guillaume M,Padioleau F.Vcinotonic effect vascular protection antiflammatory and free radical scavenging properties of horse chestnut extract[J].Arzneimittelforachung,1994,44(1):25.
[4]余志红,苏萍,王奕.七叶皂苷钠治疗慢性静脉功能不全的研究[J].中国实验方剂学杂志,2011,7(11):220.
[5]Yune TY,Kim SJ,Lee SM,et al.Systemic administration of 17 beta-estradiol reduces apoptotic cell death and improves functional recovery following traumatic spinal cord injury in rats[J].J Neurotrauma,2008,21(3):293.
[6]Xin W,Zhang L,Fan H,et al.Escin attenuates acute lung injury induced by endotoxin in mice[J].Eur J Pharm Sci,2011,42(1/2):73.
[7]王金光,郑启新,郭晓东.重组人红细胞生成素与β-七叶皂苷钠治疗大鼠脊髓损伤的实验研究[J].中国脊柱脊髓杂志,2003,13(11):674.
[8]Castle NA.Aquaporins as targets for drug discovery[J].Drug Discovery Today,2005,10(7):485.
[9]Verkerkam AS,Matthay MA,Song Y.Aquaporin water channels and lung physiology[J].Am J Physiol Lung Cell Mol Physiol,2000,278(5):L867.
[10]Agre P,Kozono D.Aquaporin water channels:molecular mechanisms for human diseases[J].FEBS Lett,2003,555(1):72.
[11]King LS,Agre P.Pathophysiology of the aquaporin water channels[J].Annu Rev Physiol,1996,58:619.
[12]Lai KN,Leung JC,Metz CN,et al.Role for macrophage migration inhibitory factor in acute respiratory distress syndrome[J].J Pathol,2003,199(4):496.
[13]Alexander JJ,Jacob A,Cunningham P,et al.TNF is a key mediator of septic encephalopathy acting through its receptor,TNF receptor-1[J].Neurochem Int,2008,52(3):447.
[14]Jang AS,Lee JU,Choi IS,et al.Expression of nitric oxide synthase,aquaporin 1 and aquaporin 5 in rat after bleomycin inhalation[J].Intensive Care Med,2004,30(3):489.
——过敏性休克和肺水肿的抢救流程

