壬基酚聚氧乙烯醚络合碘消毒液的研制及其效果和安全性评价
黄道望,向红菊,胡焰,王霞,易利丹,彭六保,李健和#(.桑植县人民医院,湖南桑植4700;.中南大学湘雅二医院药学部,长沙 400;3.中南大学药学院,长沙 4003)
碘是一种常用的消毒剂,可广泛用于皮肤、黏膜、器械、物品的消毒。但元素碘存在异臭味、水溶解度小、刺激性大、易升华、易引起黄染和过敏反应等缺点,故将碘与高分子化合物构成络合碘。根据载体的不同,其可分为许多种类,其中尤以聚维酮碘和聚醇醚碘应用最广泛[1-4]。有研究表明,聚维酮碘杀灭细菌繁殖体所需浓度比聚醇醚碘高1倍,杀灭真菌(白色念珠菌)所需浓度比聚醇醚碘高3倍[4]。壬基酚聚氧乙烯醚TX-10为一种非离子表面活性剂,具有良好的乳化性、水溶性和分散性,可与碘络合生成聚醇醚碘的水溶液,适用于皮肤及创面消毒,可杀灭医院感染常见细菌、肠道致病菌、化脓性球菌、致病性酵母菌等[5-6]。基于元素碘的不足以及壬基酚聚氧乙烯醚络合碘的特点,中南大学湘雅二医院药学部研制开发了壬基酚聚氧乙烯醚络合碘消毒液,其碘载于表面活性剂所形成的胶粒束中央,在水中可逐渐解聚释放出游离碘,从而发挥持久的杀菌作用,应用于临床医疗和护理消毒等领域取得了满意疗效。现将其处方工艺、稳定性、有效性及安全性评价结果报道如下。
1 材料
1.1 仪器
BHC-ⅡA2生物安全柜(阿尔泰实验室设备北京有限公司);AE200电子分析天平[梅特勒-托利多仪器(上海)有限公司];pHS-3C精密pH计(深圳市三诺电子仪器有限公司)。
1.2 药品、试剂与培养基
碘(天津市津云制碘厂,批号:20120123,纯度:99.6%);壬基酚聚氧乙烯醚TX-10(深圳泰达化工有限公司,批号:20120214,纯度:99.6%);亚硫酸氢钠(北京天坛生物制品股份有限公司,批号:20120225,纯度:99.8%);环磷酰胺(山西普德药业有限公司,批号:20110301,纯度:99.7%);壬基酚聚氧乙烯醚络合碘消毒液样品(中南大学湘雅二医院药学部研制,批号:20121008、20121010、20121012,规格:500 ml/瓶);胰蛋白胨大豆琼脂培养基(青岛海博生物技术有限公司,批号:20120425);沙堡氏琼脂培养基(上海信然生物技术有限公司,批号:20120806)。
1.3 细菌
金黄色葡萄球菌(ATCC6538)、大肠埃希菌(ATCC8099)、铜绿假单胞菌(ATCC15442)、白色念珠菌(ATCC10231)均由军事医学科学院提供。
1.4 动物
健康白色家兔,♂,体质量2.0~2.4 kg;SPF级昆明种小鼠,♀♂各半,体质量18.0~22.0 g。动物均由长沙东创实验动物科技服务部提供,使用许可证号:SYXK(湘)2010-0011。
2 方法与结果
2.1 处方工艺
2.1.1 处方。6.5 g碘,50 g壬基酚聚氧乙烯醚TX-10,0.475 g亚硫酸氢钠,纯化水加至1000 ml。
2.1.2 工艺。称取50 g壬基酚聚氧乙烯醚TX-10加入配料罐中,温度控制在(40±2)℃,然后将碘6.5 g慢慢加入其中,加完后继续搅拌5 h以上,至络合反应充分完全,加亚硫酸氢钠0.475 g使溶液澄清,补加纯化水至1000 ml,搅匀,取样测定药液pH和有效碘含量合格后,灌装,贴签,包装,即得。
2.2 质量控制
2.2.1 性状。本品为黄棕色至红棕色澄明液体,有碘气味。经检测批号为20121008、20121010、20121012的样品均为棕色澄明液体,有碘气味,均符合规定。
2.2.2 鉴别。取本品1~5滴,置于试管中,加水10 ml与淀粉指示液1 ml混合后,即显深蓝色。经检测批号为20121008、20121010、20121012的样品均呈正反应,均符合规定。
2.2.3 pH。取本品,依法[7]检查,pH应为2.0~4.0。经检测批号为20121008、20121010、20121012的样品pH分别为2.52、2.47、2.38,均符合规定。
2.2.4 装量。取本品,依法[7]检查,应符合规定。经检测批号为20121008、20121010、20121012的样品装量均符合规定。
2.2.5 有效碘含量测定。精密量取本品25 ml,置于100 ml碘量瓶中并加入36%醋酸溶液5滴,用0.1 mol/L硫代硫酸钠滴定液滴定,边滴边摇匀,待溶液呈淡黄色时加入5 g/L淀粉溶液10滴(溶液立即变蓝色),继续滴定至蓝色消失,并将滴定的结果用空白试验校正。每1 ml硫代硫酸钠滴定液(0.1 mol/L)相当于12.69 mg的碘。经测定批号为20121008、20121010、20121012的样品中的有效碘含量分别为5276、5210、5195 mg/L,均在有效碘含量范围(4500~5500 mg/L)之内,符合企业规定。
2.3 稳定性试验
依据2002年版《消毒技术规范》[8]要求,将批号为20121008的样品置于37℃温箱90 d,测定其0 d和90 d时的有效碘含量,考察样品的稳定性。结果0 d和90 d的有效碘平均含量分别为5276 mg/L和5140 mg/L,其有效碘下降率为2.58%,按有效碘下降率不超过10%暂定该产品有效期为2年。
2.4 杀灭微生物效果试验
2.4.1 菌悬液制备。分别取经24 h培养的新鲜斜面培养物金黄色葡萄球菌(第5代)、大肠埃希菌(第6代)、铜绿假单胞菌(第6代)、白色念珠菌(第5代),均先用磷酸盐缓冲液(PBS缓冲液)或热塑性淀粉洗下菌苔,混匀。将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌均用含3%的牛血清白蛋白PBS缓冲液进行对倍稀释,使回收菌落数均达1×107~5×107CFU/ml;白色念珠菌用含3%的牛血清白蛋白PBS缓冲液进行对倍稀释,使回收菌落数达1×106~5×106CFU/ml。
2.4.2 中和剂鉴定试验。试验在(20±1)℃温度下进行。用胰蛋白胨生理盐水(0.9%氯化钠注射液)稀释样品,使稀释后含有效碘2641 mg/L(1∶1稀释液,V/V),将其与其他待试液置(20±1)℃温度下预温5 min,再参照2002年版《消毒技术规范》[8]中和剂鉴定试验的分组方法分为6组进行中和效果试验测定。试验菌为金黄色葡萄球菌、白色念珠菌,拟选中和剂为含0.3%硫代硫酸钠、1.0%聚山梨酯80和0.1%卵磷脂的PBS缓冲液,杀菌作用时间为0.5 min,中和作用时间为10 min。金黄色葡萄球菌用胰蛋白胨大豆琼脂培养基、白色念珠菌用沙堡氏琼脂培养基倾皿计数,试验重复3次,结果详见表1。

表1 中和剂鉴定试验结果Tab 1 Results of neutralizer identification test
由表1可见,金黄色葡萄球菌第1、2组无菌生长,第3、4、5组平均回收菌落数组间误差率[组间误差率=(3组间平均回收菌落数-各组平均回收菌落数)的绝对值之和/(3组间回收菌落平均数×3)×100%]为3.14%,第6组无菌生长;将消毒液和中和剂均以1∶9(V/V)稀释后重做第1、2组试验,结果第1组无菌生长,第2组平均回收菌落数为80 CFU/ml(3次结果分别为90、70、80 CFU/ml)。白色念珠菌第1、2组无菌生长,第3、4、5组平均回收菌落数组间误差率为3.09%,第6组无菌生长;将消毒液和中和剂均以1∶9(V/V)稀释后重做第1、2组试验,结果第1组无菌生长,第2组平均回收菌落数为73 CFU/ml(3次结果分别为60、70、90 CFU/ml)。表明中和剂可中和残留的含有效碘为2110 mg/L的样品(1∶1稀释液,V/V)对金黄色葡萄球菌和白色念珠菌的杀灭作用,且中和剂及中和产物对试验菌的生长和培养基均无不良影响。
2.4.3 悬液定量杀菌试验。试验在(20±1)℃温度下进行。取4.0 ml含有效碘2110 mg/L的样品加入灭菌试管内,分别加入1.0 ml的金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌及白色念珠菌菌悬液,作用0.5、1.5、3.0 min后,将菌药混悬液取0.5 ml加入4.5 ml中和剂内,中和10 min后,分别取样,其中金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌用胰蛋白胨大豆琼脂培养基,白色念珠菌用沙堡氏琼脂培养基倾皿检验残留活菌数。试验同时设阳性对照(稀释液代替样品)组、阴性对照(样品)组,试验重复3次。结果,阴性对照组无菌生长,其他结果详见表2[表中,杀灭对数值(KL)=阳性对照组平均活菌浓度的对数值(N0)-阴性对照组活菌浓度对数值(Nx)]。
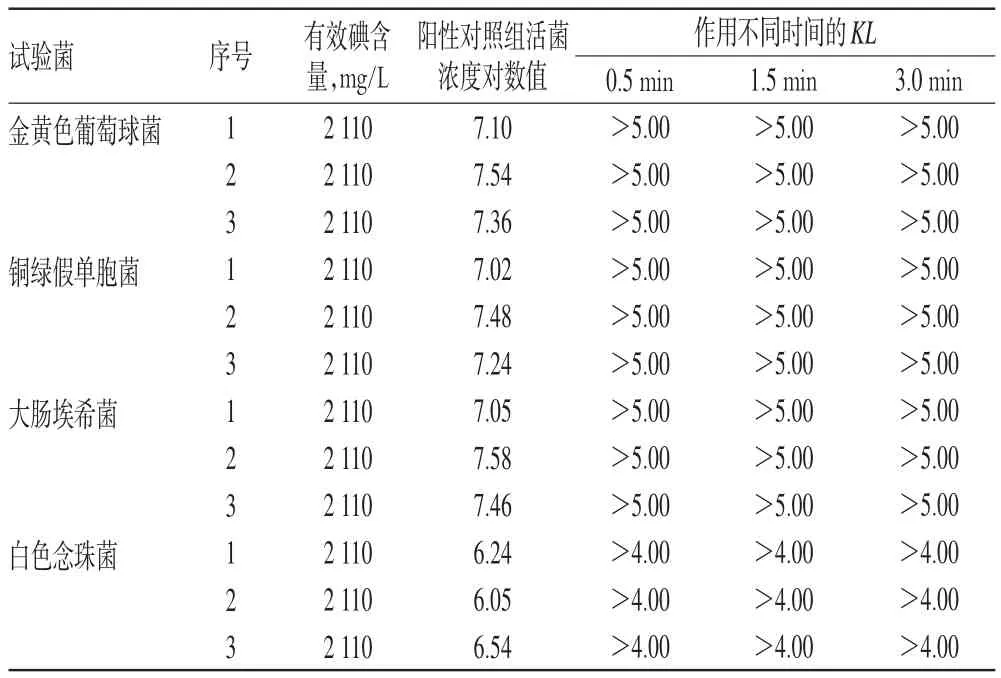
表2 消毒液对4种试验菌的杀灭效果Tab 2 Killing effect of the disinfectant on 4 kinds of test strain
由表2可见,含有效碘2110 mg/L的样品作用0.5 min对金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌的KL各次均>5.00,对白色念珠菌的KL各次均>4.00。
2.5 皮肤消毒现场试验
依据2002年版《消毒技术规范》[8]要求,在局部100级空气洁净试验室、温度21~23℃、湿度60%~65%条件下,将规格版(5.0 cm×5.0 cm)固定在受试者(已签署知情同意书)左臂内侧中段表面,将无菌棉签在含10 ml 0.1%聚山梨酯80的0.03 mol/L PBS缓冲液的试管(pH 7.2)中浸湿,在规格版框定的区域内,横向往返涂擦10遍,纵向往返涂擦3遍;同时用含有效碘2638 mg/L的样品(1∶1稀释液,V/V)对右臂内侧进行消毒,作用1.0 min后,用中和剂代替PBS缓冲液,方法同上采样。结果本品经30人次皮肤消毒现场试验,其作用1.0 min对皮肤上自然菌的平均最低KL为1.21(>1.00)。
2.6 急性经口毒性实验
依据2002年版《消毒技术规范》[8]要求,采用一次最大限度试验,设剂量为5000 mg/kg。实验条件为屏蔽环境,温度22~24℃,湿度50%~56%。实验时称取样品12.50 g,加蒸馏水定容至50 ml,混匀,按0.2 ml/10 g给昆明种小鼠一次性经口灌胃,灌胃前禁食16 h,灌胃后连续观察14 d,记录中毒表现及死亡情况。结果灌胃后小鼠无明显中毒表现,观察14 d无死亡。实验末处死全部小鼠进行解剖,肝、肾、脾、胃、肠、心、肺等主要脏器未见肉眼可见的异常改变。在本实验条件下,样品对昆明种小鼠的急性经口半数致死量均>5000 mg/kg。根据2002年版《消毒技术规范》[8]中急性毒性分级标准,本品属实际无毒级。
2.7 刺激实验
2.7.1 多次皮肤刺激实验。依据2002年版《消毒技术规范》[8]要求,在温度22~24℃、湿度50%~54%条件下,取家兔3只,实验前24 h将其背部脊柱两侧的毛剪掉,去毛范围左右各约3 cm×3 cm;次日,将样品0.5 ml均匀涂抹于一侧去毛皮肤表面,另一侧去毛皮肤作为空白对照;涂抹4 h后,用蒸馏水清除残留样品。每天涂抹1次,连续涂抹14 d。必要时剪毛,不损伤皮肤。在每次涂抹后24 h观察结果,按2002年版《消毒技术规范》[8]中的规定进行皮肤刺激反应评分。实验结束后,计算每天每只家兔的平均积分并进行皮肤刺激强度评价,实验结果见表3。

表3 多次皮肤刺激实验结果Tab 3 Results of repeated skin irritation test
根据表3中的实验结果以及2002年版《消毒技术规范》[8]中的皮肤刺激强度分级标准,在本实验条件下,本品对家兔的多次皮肤刺激强度属无刺激性。
2.7.2 一次破损皮肤刺激实验。依据2002年版《消毒技术规范》[8]要求,在温度22~23℃、湿度52%~54%条件下,取家兔3只,实验前24 h,将家兔背部脊柱两侧的毛剪掉,去毛范围左右各约3 cm×3 cm。次日,在涂样品前,在去毛皮肤上,用75%乙醇清洁、消毒暴露皮肤,待乙醇挥发后,用注射针头在皮区内划一个“井”形的破损伤口,将0.5 ml样品滴于2.5 cm×2.5 cm大小的4层纱布上,敷贴在一侧破损皮肤表面,然后用一层油纸覆盖,再用无刺激性胶布固定,作为受试组;另一侧去毛破损皮肤用等量生理盐水作为对照组,同法处理。敷用4 h后,用蒸馏水除去残留样品,分别于去除样品后1、24、48 h,观察皮肤局部反应,按2002年版《消毒技术规范》[8]中的规定进行刺激反应评分和刺激强度评价。结果1、24、48 h时受试组与对照组红斑、水肿的评分均为0分,各时间点样品对家兔的一次破损皮肤刺激反应的最高评分均值为0分。根据2002年版《消毒技术规范》[8]中的皮肤刺激强度分级标准,在本实验条件下,本品对家兔的一次破损皮肤刺激强度属无刺激性。
2.7.3 阴道黏膜刺激实验。依据2002年版《消毒技术规范》[8]要求,温度22~24℃、湿度50%~54%条件下,取家兔6只,分为染毒组和对照组,每组3只。将长度为8 cm左右的钝头软管与2 ml注射器连接,注满样品备用。每只家兔准备一套。将家兔仰面固定,暴露会阴和阴道口,将导管用样品或生理盐水湿润后轻柔地插入阴道(4~5 cm),并用注射器缓慢注入2 ml样品,抽出导管,完成染毒,为染毒组;对照组家兔用生理盐水作同法处理。染毒后24 h,采用气栓法处死家兔,剖腹取出完整的阴道,纵向切开,肉眼观察是否有充血、水肿等表现。然后将阴道置于10%福尔马林溶液中固定24 h以上,选取阴道两端和中央3个部位的组织制片,苏木精-伊红(HE)染色后,进行组织病理学检查,按2002年版《消毒技术规范》[8]中的阴道黏膜刺激反应评分标准对刺激反应进行评分。结果在本实验条件下,肉眼观察阴道无充血、水肿等异常表现;染毒组和对照组对家兔阴道黏膜刺激反应评分的总评分分别为7分和4分,两组的平均评分分别为0.78分和0.44分。本品对家兔阴道黏膜刺激实验的刺激指数(染毒组平均评分-对照组平均评分)为0.34分,属无刺激性。
2.7.4 急性眼刺激实验。依据2002年版《消毒技术规范》[8]要求,在温度22~23℃、湿度50%~54%条件下,取家兔3只,吸取样品0.1 ml,滴入家兔左侧眼结膜囊内,另一侧眼以生理盐水作为对照组。滴样品后,将眼被动闭合4 s,30 s后用生理盐水冲洗。于滴眼后1 h和1、2、3、7、14、21 d肉眼观察家兔眼结膜、虹膜和角膜的损伤与恢复情况。如果3 d内未出现刺激反应,或第7天、第14天眼睛刺激反应完全恢复,即可提前终止实验;必要时,用2%荧光素钠溶液、放大镜检查角膜及虹膜变化。按2002年版《消毒技术规范》[8]中急性眼刺激反应的评分标准对家兔角膜、虹膜和结膜的急性刺激反应进行评分,并分别计算每只家兔在3个不同观察时间(1、2、3 d)的角膜损害、虹膜损害、结膜充血和结膜水肿4个方面的平均评分(即每只家兔的1、2、3 d评分之和除以观察数3)。分别以家兔眼角膜、虹膜和结膜充血、水肿的平均评分和恢复时间,按眼刺激反应分级标准判定样品对眼睛的刺激程度。结果染毒后1 h,染毒组2只家兔眼结膜血管充血呈鲜红色,眼结膜轻微水肿,角膜、虹膜无损伤;2 d内表现完全消失,故观察7 d终止实验。对照组在上述3个不同观察时间均未见角膜与虹膜损害、结膜充血和结膜水肿。在本实验条件下,样品对家兔的急性眼刺激实验的平均评分为:角膜损害0分,虹膜损害0分,结膜充血<1分,结膜水肿<1分。根据2002年版《消毒技术规范》[8]的眼刺激强度分级标准,本品属无刺激性。
2.8 微核实验
依据2002年版《消毒技术规范》[8]要求,在屏蔽环境、温度23~24℃、湿度50%~56%条件下,采用经口灌胃30 h染毒法进行动物染毒。取SPF级昆明种小鼠50只,按体质量随机分为5组,每组10只,♀♂各半。以40 mg/kg剂量的环磷酰胺为阳性对照组,蒸馏水为阴性对照组,样品3个剂量分别为5000、2000、500 mg/kg(高、中、低剂量)组,分别取样品12.50、5.00、1.25 g加蒸馏水定容至50 ml,间隔24 h给小鼠灌胃2次,每次灌胃0.2 ml/10 g。末次给药后6 h颈椎脱臼处死小鼠,取胸骨骨髓用小牛血清稀释涂片,甲醇固定,Giemsa染色。在光学显微镜下,每只小鼠计数1000个嗜多染红细胞(PCE),观察含有微核的PCE数,计算微核率(以‰计);每只小鼠计数200个PCE,计算PCE与成熟红细胞的比例(PCE/NCE)。采用SPSS 11.0软件统计分析,实验结果见表4。
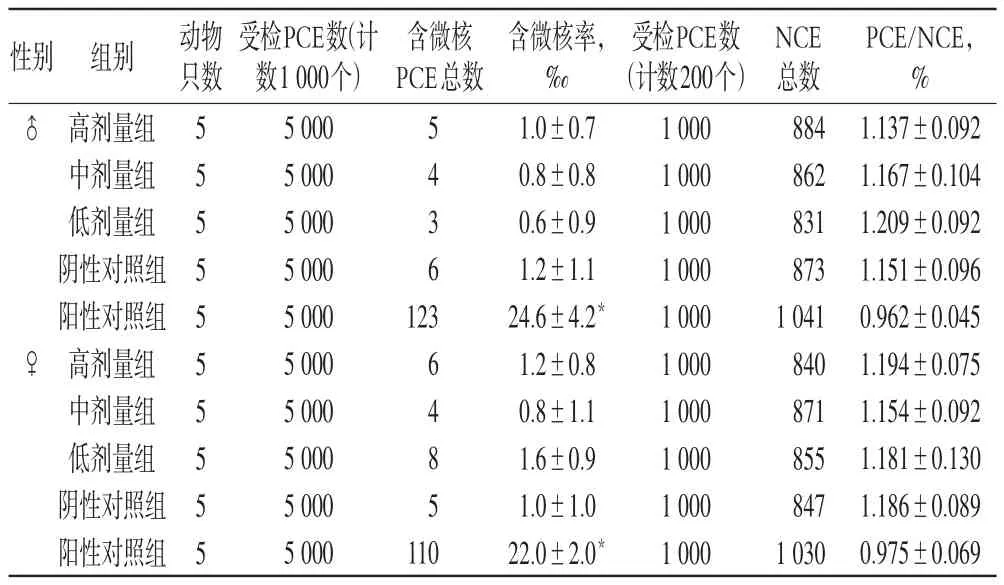
表4 小鼠骨髓嗜多染红细胞微核实验结果Tab 4 Results of bone marrow polychromatic erythrocyte micronucleus test in mice
表4中的结果表明,样品各剂量组含微核率与阴性对照组比较差异无统计学意义,而阳性对照组与阴性对照组比较差异有统计学意义(P<0.01)。在本实验条件下,小鼠微核实验结果为阴性,说明本品属无染色体损伤性。
3 讨论
制备聚醇醚碘消毒剂,可选用聚醇醚和磺酸的混合物,其优点是用量较少,使用量是碘的5.6倍,其中磺酸占20%。磺酸价格比较便宜,是聚醇醚的60%,但磺酸需加氢氧化钠制成钠盐,反应过程温度升高,需要冷却、降温,操作比较麻烦,同时质量难以控制;磺酸分子中支链较多,微生物难以降解,有可能造成环境污染。而本产品单独使用聚醇醚作为载体,其用量是碘的7.6倍,虽然用量较多,但操作简单,减少了磺酸对环境的污染。本产品处方合理,制备工艺简单,产品性质稳定,杀菌效果良好,无刺激性。
[1]Capriotti K,Capriotti JA.Topical iodophor preparations:chemistry,microbiology,and clinical utility[J].Dermatol Online J,2012,18(11):1.
[2]李忠铭,杜金萍,甘学兵.聚醚碘制备工艺研究[J].武汉理工大学学报,2006,28(5):60.
[3]王欣,崔志敏.碘伏消毒液的配制及性质研究[J].化工时刊,2003,17(1):43.
[4]邱洪流,谢琴,谢帆.两种碘伏消毒液杀菌效果比较研究[J].中国消毒学杂志,2006,23(6):555.
[5]郭睿劼,王晓东.高浓度碘伏的制备及其稳定性研究[J].中国消毒学杂志,2009,26(4):368.
[6]张万国,张忠敏,葛莉娟.一种壬基酚聚氧乙烯醚络合碘消毒液及其制备方法:中国,CN101785477A[P].2010-07-28.
[7]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录44、89.
[8]卫生部法制与监督司.消毒技术规范[S].2002-11-15.

