多中心药物临床试验管理信息系统的开发Δ
范儒泽,陈文戈,林忠晓,陈冠全,王启章(.广东工业大学/广东省计算机集成制造重点实验室,广州50090;2.广东华南药物临床评价中心,广州 50663)
目前,我国新药临床研究主要为多中心合作方式,临床研究传统的管理多为各中心采用纸质记录人工管理的模式,该方式存在项目管理缺乏时效性、数据记录不完整、数据传输不同步[1]、设计方案随意修改、数据锁存和盲态审核不执行[2]、统计分析不专业、试验药物管理不规范[3]等诸多问题,导致申办方和监管部门的项目核查困难、研究者无法进行实时跟踪项目进程[4]、受试者多次重复参加试验[5]等现象时有发生,影响了药物临床试验的研究过程质量和结果的可靠性。为满足《药物临床试验管理规范》及提高管理效率的迫切需求,笔者研究了一套基于J2EE跨平台技术体系的多中心药物临床试验管理信息系统(简称GCP系统),以下对其进行详细介绍。
1 系统需求及流程分析
1.1 多中心药物临床试验信息化管理需求
为满足多中心药物临床试验协同管理的需要,应建立包含药物临床试验项目信息管理和数据管理功能的多中心GCP系统,其中项目信息管理模块应包含项目基本信息、药物临床试验过程文档、关键流程定义、关键监控节点参数设置、进度、异常预警、质控、关联动态信息[含受试者、相关处方、试验药品、检化验信息、严重不良反应(Serious adverse events,SAE)等]管理功能。而数据管理模块中则应包括电子病历报告表(Case report form,CRF)设计功能,并实现电子CRF数据采集、数据二次录入、数据一致性检查、质疑管理、数据修改痕迹管理、电子CRF表数据导出等功能。可使多个国家药物临床试验机构通过互联网应用多中心GCP系统,从而以合作项目为纽带实现相关数据传输和信息交互,满足其日常管理工作的网络化与信息化。
1.2 多中心协同药物临床试验项目及数据管理流程分析
多中心GCP系统中项目信息管理过程包括药物临床试验从立项准备到项目完成的全过程,一般有:项目准备、药品试验批文、制订试验方案、成立伦理委员会、批准方案、药物临床试验项目立项、试验用药登记、受试者入选登记、诊疗开处方、发放试验药品、受试者检验、完成CRF表、CRF审核、项目质控等。而数据管理流程是指在临床试验过程中,从数据产生前的准备、数据记录、数据录入、数据核查、数据质控、数据监督、数据保存至数据库锁定前整个动态管理的过程。GCP中数据管理的主要过程一般包括:CRF表设计(CRF流程设计、自定义CRF表、自动生成录入界面等)、数据录入(基于WEB跨地域在线录入、结构化录入、二次录入等)、数据核查(数据质量核查、逻辑核查、时间序列核查、质疑管理、抽样检查等)、业务辅助管理(CRF状态跟踪、数据锁库、编号管理、实时监控事件、工作报表等)、查询统计(基本查询、高级查询、汇总绘图、高级汇总、数据导出)。多中心GCP系统中项目及数据管理主要流程如图1所示。
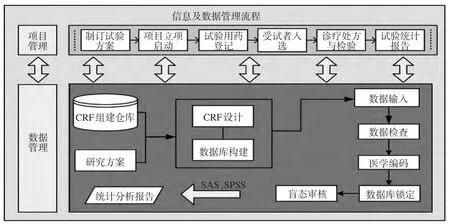
图1 多中心GCP系统中项目信息及数据管理流程图Fig 1 Project and data management process flow diagram in multicenter GCPsystem
2 系统功能及技术架构
2.1 系统功能设计及实现方案
多中心GCP系统主要包括项目CRF设计、受试者管理信息、药品管理、监管查询、综合查询、检查管理、项目信息管理及系统平台管理等,整体结构见图2。
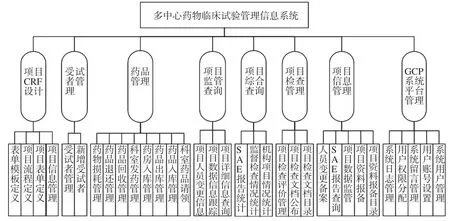
图2 多中心GCP系统功能树Fig 2 Function tree of multicenter GCPsystem
2.2 技术架构
多中心GCP系统整体架构如图3所示。
多中心GCP系统可分为两大体系、五层结构,两大体系是指标准规范体系和信息安全体系,五层结构是由指基础层、数据层、支撑层、应用层和表现层。
其中,两大体系中标准规范体系是平台实现互联互通、信息共享、业务协同的基础;信息安全体系建设则是在适当的信息安全体系和框架指导下进行的一项系统工程,包括:安全管理体系、安全防护体系、响应恢复体系等。
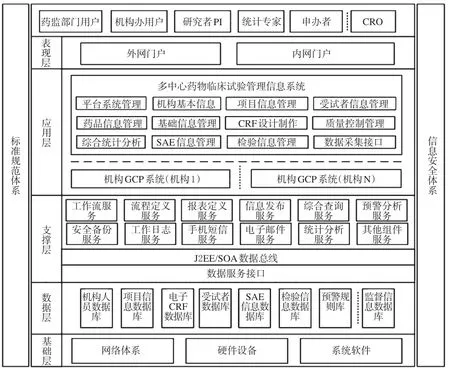
图3 多中心GCP系统整体结构图Fig 3 Overall structure diagram of multicenter GCPsystem
五层结构中基础层由网络体系、硬件设备和系统软件组成;数据层负责数据信息的存储、维护和优化;支撑层为实现应用层与数据层之间的沟通以及其他业务系统间进行数据交换提供公共的服务,包括:工作流服务、流程定义服务、报表定义服务、信息发布服务、综合查询服务、统计分析服务、安全备份服务、工作日志服务、手机短信服务、电子邮件服务、预警分析服务和其他组件服务;应用层由各主要功能模块组成,包括:平台系统管理、机构基本信息、项目信息管理、受试者信息管理、药品信息管理、CRF设计制作、质量控制管理、综合统计分析、SAE信息管理、检验信息管理及数据采集接口等功能子系统组成;表现层分为外网门户和内网门户,通过统一的门户网站访问,系统可为机构办、研究者、申办者、合同研究组织(Contract research organization,CRO,新药研发合同外包服务机构)、统计专家及药监部门等用户提供经授权后的安全访问服务,统一登陆门户网站具有用户管理、单点登陆、个性化服务和信息发布等功能。
2.3 数据库设计
数据库设计是整个设计的基础,也是支持系统功能的核心,其包括详细的数据分析、设计参数的制订、数据库编程、数据库测试以及确认等。本文采用Power Designer数据库设计工具完成系统主要数据库的设计建模。主要数据库结构设计实体-联系(E-R)模型图见图4,数据库运行环境见表1。

图4 系统主要功能E-R模型图Fig 4 E-R model figure of main system function

表1 数据库运行环境Tab 1 The database operating environment
3 系统实现示例
用户接口及界面设计将充分考虑人体结构特征及视觉特征进行优化,使界面友好、美观,操作符合日常工作流程需要,且易学习、易操作,系统提示和帮助信息准确、及时。
3.1 项目信息管理
项目信息管理:包含了项目基本信息、项目参与机构、机构研究人员、试验药物信息、人员变更备案、项目观察病种、项目参与用户等详细信息,见图5。

图5 项目信息管理界面Fig 5 Interface of project information management
项目信息流程定义:包含了上述项目信息管理等详细内容,若要详细了解某项目的流程定义,则选中该条记录,点击“项目信息流程定义”右键,见图6。
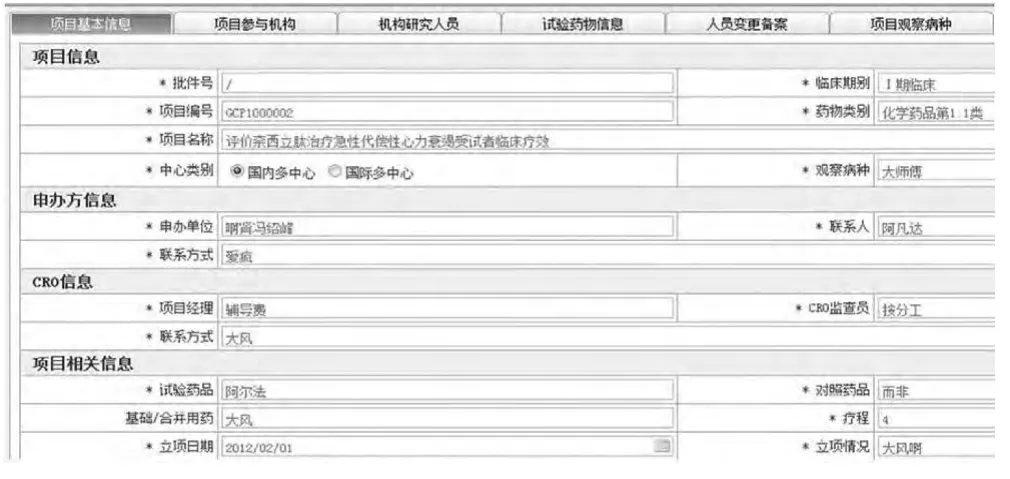
图6 项目信息流程定义界面Fig 6 Interface of project information process definition
3.2 电子CRF表的设计、双份录入原型界面
可以设计与纸质CRF相同的电子CRF,能设置相应变量的属性,如变量的范围、编码、逻辑关系和跳转设定;同时CRF的设计可以保证从CRF自动产生临床数据库,并保证计算机上的电子数据符合临床试验中保存和保留记录的适用管理要求,与文字记录同样可信。操作界面由“表单控件箱”“表单预设值”“表单字段列表”“子表单列表”“操作窗口”等部分组成。本系统可以直接将Word文档的表单直接复制粘贴在“操作窗口”,方便快捷。字段赋值包括3个步骤:表单控件箱中的控件选择、表单预设值、表单字段列表的数据捆绑。项目表单赋值主界面见图7。
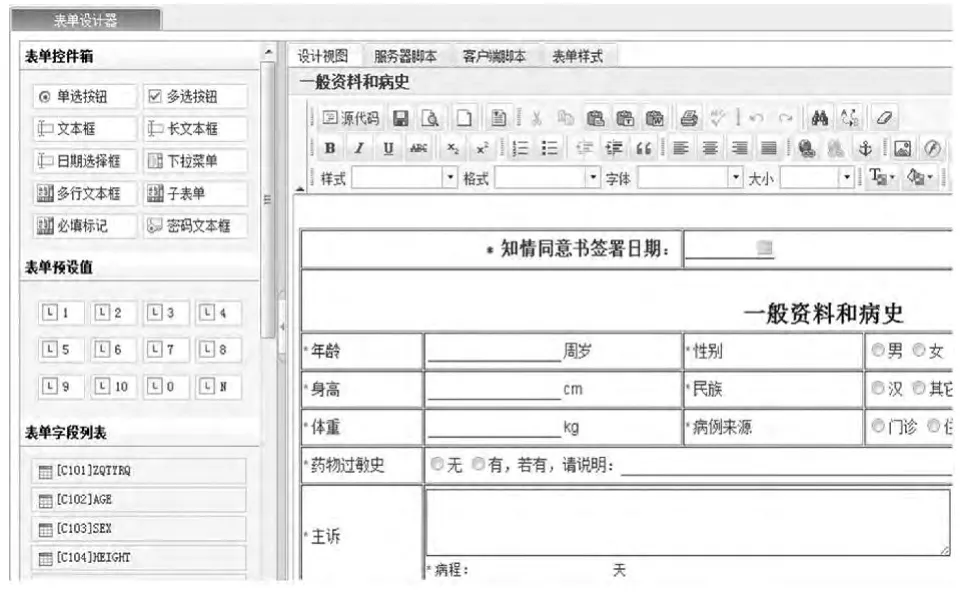
图7 项目表单赋值主界面Fig 7 Main interface of project assignment form
多中心GCP系统有方便友好的数据录入界面,对不符合格式的录入给予及时验证和提醒,以提高数据录入速度,减少数据录入差错;系统能保证两次数据录入的独立性,能够识别不同的录入人员,确保由不同的人进行二次录入,详见图8。
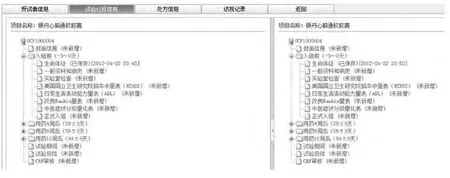
图8 电子CRF双份录入界面Fig 8 Interface of electronic CRF double input
4 结语
本文报道的多中心GCP系统适用于广域网络环境下多中心的药物临床试验信息化管理,可满足制药企业或其新药研发机构、CRO、医院内国家药物临床试验研究机构相关药物临床试验项目及数据的信息管理需求,有助于提高管理效率和规范性,从而满足国家《药物临床试验质量管理规范》的要求,同时,也可为政府药监系统中药物临床试验监管部门对药物临床试验过程关键信息的非现场监管提供支持。
[1]邵明义.中药新药临床试验数据管理系统的设计及应用研究[D].成都:成都中医药大学,2009:55-57.
[2]曾石,王明霞.GCP执行与监管国际化 中国探索中前进:“新药临床评价研究技术平台”课题建设及药物GCP研讨会报道[J].中国处方药,2010(102):30.
[3]张倩.药物临床试验质量管理规范之试验药物标准操作规程[J].中国中医药现代远程教育,2012,10(9):93.
[4]李秋艳,翁维良,李睿,等.中医临床研究的联合监查与质量控制[J].中国中医药信息杂志,2010,17(1):8.
[5]张琼,邱晓春.GCP和国内实施概况[J].医学信息:中旬刊,2011,24(7):3489.

