百草枯致肺纤维化大鼠肺组织中Smo、Gli1的表达变化及意义
周媛媛,曾凡军
(1三峡大学第一临床医学院,湖北宜昌443000;2宜昌市中心人民医院)
百草枯(PQ)是联吡啶类除草剂,中毒后出现的不可逆的肺间质纤维化是主要致死原因,病死率高达80%,但中毒机制不明。Sonic hedgehog(SHH)信号途径是肺脏结构形成和发育过程中重要的信号转导途径[1],其在肝、肾等器官纤维化过程中均存在异常活化现象[2]。SHH途径是否参与PQ所致肺纤维化目前尚不清楚。Smo和Gli1是SHH途径的2个重要分子[3~5],本研究通过检测 PQ致大鼠肺纤维化后Smo和Gli1的表达,探索SHH信号途径在PQ致大鼠肺纤维化中的作用,进一步了解PQ致肺纤维化的中毒机制。
1 材料与方法
1.1 材料 PQ农药购于郑州沙隆达植物保护技术有限公司(农药登记证号:PD20090712)。雄性SD健康大鼠40只,来自三峡大学医学院实验动物中心,SPF 级,体质量(255±25)g。
1.2 分组及模型制备方法 40只雄性SD大鼠随机分为2组:PQ组、生理盐水对照组(NS组),每组20只。PQ组一次性腹腔注入PQ农药40 mg/kg;NS组一次性腹腔注射生理盐水40 mL/kg。21 d后处死大鼠,开胸取右肺组织。
1.3 大鼠肺组织病理组织学检查 观察两组大鼠肺组织外观后,石蜡切片HE染色,在光学显微镜下观察肺组织病理学改变。
1.4 Smo和Gli1免疫组化检测 采用SP法。免疫组化试剂盒购自武汉博士德公司,免疫组化检测严格按试剂盒说明书进行操作。组织脱蜡,0.3%H2O2阻断过氧化酶活性;抗原热修复处理后;以稀释的兔抗Smo和Gli1多克隆抗体孵育过夜,阴性对照用PBS代替一抗,二抗采用山羊SABC过氧化物酶试剂盒,再用DBA试剂盒显色。按照肺组织细胞胞膜及胞质或胞核出现的黄色、棕黄或褐色颗粒作为染色强度判断标准,并结合着染细胞和组织分布范围大小,综合整个切片,双盲法由2位病理科医生对每张切片染色结果独立进行评估:无表达(-)、弱表达(±)、低表达(+)、中表达(++)、高表达(+++)。
1.5 统计学方法 采用SPSS16.0统计软件。计量资料以±s表示,组间比较采用单因素方差分析,两变量间的相关性检验采用Spearman等级相关分析法。P≤0.05为差异有统计学意义。
2 结果
NS组大鼠肺脏外观肺组织色泽红润,表面光滑,弹性好。光镜观察未出现明显病理改变。PQ组大鼠肺脏外观肺组织呈苍白色,表面凹凸不平、呈结节样改变及条索状凹沟,体积缩小,硬度增加。光镜观察发现肺组织部分实变,肺泡结构破坏,部分肺泡腔消失,为大量胶原纤维、成纤维细胞增生。见图1。
2.1 Smo和Gli1检测结果 Smo和Gli1蛋白主要分布于支气管上皮、肺泡上皮、血管内皮细胞及部分纤维组织。Smo阳性表达主要定位于细胞膜及胞质,Glil阳性表达主要定位于胞质及胞核。Smo及Gli1在NS组无表达或弱表达,在PQ组表达明显增强,两组比较 P<0.01。见图2、表1。
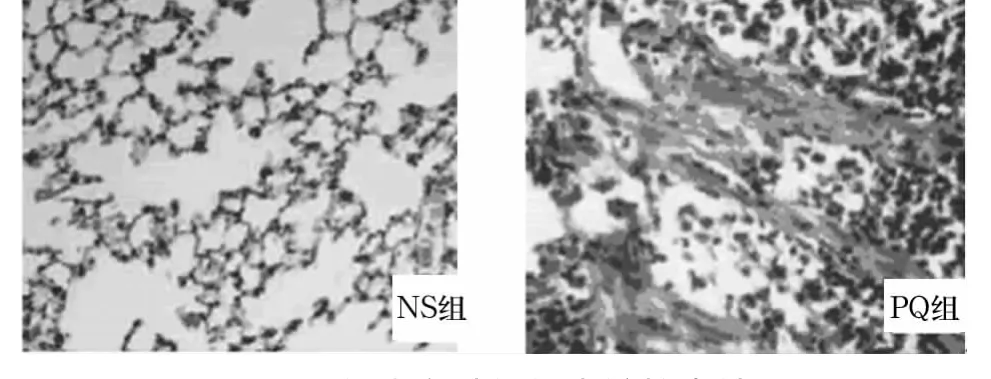
图1 两组大鼠肺组织光镜检查结果

图2 Smo和Gli1在两组大鼠肺组织中的表达

表1 两组大鼠肺组织中Smo和Gli1蛋白的免疫组化表达水平(例)
2.2 Smo和Gli1的相关性分析 PQ组Smo及Gli1蛋白的表达呈正相关(r=0.956,P <0.001)。
3 讨论
PQ是有机杂环类除草剂,对人畜具有很强的毒性,病死率极高。机体中毒后出现不可逆性肺间质纤维化[6,7]。但其发病机制尚未完全明确,可能与过度氧化反应及基因表达异常有关。目前对PQ所致肺纤维化尚无特异性治疗方法。因此,研究PQ所致肺纤维化机制不仅可以阐明肺纤维化发病的机制,而且对PQ中毒的治疗有重要价值。
SHH途径是动物体内存在的重要信号途径。主要由Hedgehog配体(Shh)、2个膜受体Ptch、Smo及下游的转录因子Gli组成[8]。Smo和Gli1是SHH途径的2个重要分子;Smo蛋白是信息转换器,它能够将细胞外的SHH信号转换成细胞内的Gli1信号,对SHH信号途径具有激活作用。有研究[10]显示,活化的SHH信号与组织纤维化具有密切关系。
本研究发现,腹腔注入PQ的大鼠肺脏呈明显肺纤维化的病理改变,且较注入生理盐水组大鼠肺组织Smo和Gli1蛋白表达明显增强。PQ组Smo及Gli1蛋白的表达呈正相关。由此推断,PQ所致肺纤维化与SHH信号被激活有密切关系,但不清楚激活的SHH信号通过何种机制影响肺纤维化进程。推测可能与 PQ激活 SHH信号途径,SHH蛋白和Patch蛋白结合后,Patch对Smo抑制解除,通过胞质微管上附着的hedgehog信号复合物介导,使转录因子Gli1进入胞核,激活其下游基因表达[11],导致肺组织纤维化。
可见,SHH信号途径的异常激活可能直接参与了PQ所致肺纤维化的发生、发展过程,而Smo和Gli1蛋白明显表达则可能是SHH信号途径异常激活的机制之一。进一步研究SHH信号途径在PQ致肺纤维化中的作用可能为PQ所致肺纤维化开辟新的治疗途径。
[1]Bola~nos AL,Milla CM,Lira JC,et al.Role of Sonic Hedgehog in idiopathic pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2012,303(11):L978-990.
[2]Parkin CA,Ingham PW.The adventures of Sonic Hedgehog in development and repair.Ⅰ.Hedgehog signaling in gastrointestinal development and disease[J].Am J Physiol Gastrointest Liver Physiol,2008,294(2):G363-367.
[3]Zhuang Z,Wang K,Cheng X,et al.LKB1 inhibits breast cancer partially through repressing the Hedgehog signaling pathway [J].PLoS One,2013,8(7):e67431.
[4]Tao Y,Mao J,Zhang Q,et al.Overexpression of Hedgehog signaling molecules and its involvement in triple-negative breast cancer[J].Oncol Lett,2011,2(5):995-1001.
[5]Chaklader M,Das P,Pereira JA,et al.Altered canonical hedgehog-gli signalling axis in pesticide-induced bone marrow aplasia mouse model[J].Arh Hig Rada Toksikol,2012,63(3):271-282.
[6]Orito K,Suzuki Y,Matsuda H,et al.Chymase is activated in the pulmonary inflammation and fibrosis induced by paraquat in hamsters[J].Tohoku J Exp Med,2004,203(4):287-294.
[7]Hwang KY,Lee EY,Hong SY.Paraquat intoxication in Korea[J].Arch Environ Health,2002,57(2):162-166.
[8]Katoh Y,Katoh M.Hedgehog signaling pathway and gastrointestinal stem cell signaling network(review)[J].Int J Mol Med,2006,18(6):1019-1023.
[9]Murone M,Luoh SM,Stone D,et al.Gli regulation by the opposing activities of fused and suppressor of fused[J].Nat Cell Biol,2000,2(5):310-312.
[10]Omenetti A,Porrello A,Jung Y,et al.Hedgehog signaling regulates epithelial-mesenchymal transition during biliary fibrosis in rodents and humans[J].J Clin Invest,2008,118(10):3331-3342.
[11] Varjosalo M,Li SP,Taipale J.Divergence of hedgehog signal transduction mechanism between Drosophila and mammals[J].Dev Cell,2006,10(2):177-186.

