栀子苷对拟缺血损伤脑微血管内皮细胞EDNRB表达的影响*
李芳赫,李兴广△,李卫红△,李 峰,郭晓谨,万亮琴,张 赛,臧妍妍,张林朋,马家宝,姜昭妍
(1.北京中医药大学,北京 100029;2.通州中西医结合医院,北京 101100;3.潍坊医学院,山东 潍坊 261000)
近年来研究发现,栀子苷能够通过多种途径有效抑制脑缺血的发生发展,具有明显的抗炎与抗血栓作用[1,2]。前期实验基因芯片检测发现,栀子苷对拟缺血损伤脑微血管内皮细胞内皮素受体B(endothelin receptor B,EDNRB)基因表达具有显著下调作用。因此,本实验在前期研究的基础上,观察了栀子苷对拟缺血脑微血管内皮细胞EDNRB mRNA及蛋白表达水平的调节作用,一方面对基因芯片的结果进行验证,同时进一步深入揭示了栀子苷发挥脑保护作用的分子机制。
1 实验方法
1.1 大鼠脑微血管内皮细胞的培养
采用实验室已建立的脑微血管内皮细胞培养方法[3],进行内皮细胞原代取材、分离纯化和培养。本实验使用第3代内皮细胞。
1.2 拟缺血损伤模型的制备
采用本实验室已建立的糖氧剥夺模型[4],用无糖的Kreb’s液置换原培养基,放入低氧培养箱(气体含量为 94%N2,5%CO2,1%O2),37℃继续培养 6 h。
1.3 栀子苷用药浓度的确定
将第3代脑微血管内皮细胞接种于96孔板,置培养箱中继续培养,48 h后细胞呈70%汇合状态,分为9组:正常组、模型组、7个给药组(栀子苷分别按8.3、16.6、33.2、66.4、132.8、265.6、531.2 μg/ml浓度给药),除正常组外其余8组按上述方法复制模型,即糖氧剥夺损伤6 h,各给药组在造模前3 h和造模中给药,造模结束后用CCK-8试剂盒检测细胞活性,筛选出栀子苷的最佳给药浓度进行后期实验。
1.4 实验分组与处理
培养的脑微血管内皮细胞分成3组,分别为正常组、模型组、栀子苷组。除正常组外其余2组进行造模,栀子苷组按上述实验筛选出的用药浓度进行给药,处理结束后进行下列指标检测。
1.5 CCK-8法检测细胞活性
每孔加入10 μl CCK-8溶液,在培养箱中继续孵育2 h后,用酶标仪测定各组的吸光光度值,检测波长为450 nm,每组设6个复孔。
1.6 实时荧光定量 PCR法检测 EDNRB mRNA表达水平
各组细胞加入1 ml的Trizol,抽提总RNA,测定RNA浓度。然后用逆转录试剂盒反转录RNA生成单链cDNA,采用SYBR GreenⅠ定量PCR试剂盒,在7500型实时定量PCR仪上检测EDNRB基因的mRNA表达水平。基因表达变化倍数采用 2-ΔΔCt计算。计算公式如下:ΔCt=Ct目的基因–Ct内参;ΔΔCt=ΔCt实验组–ΔCt对照组。定量PCR所用引物如下:EDNRB上游5'-CTGTCCCTGAAGCCATA GGT-3',下游 5'-GAATCCTGCTGAGGTGAAGG-3';β-actin,上游 5'-CGCG AGAAGATGACCCAGAT-3',下游5'-GCACTGTGTTG GCGTACAGG-3'。
1.7 Western blotting法检测各组细胞EDNRB蛋白的表达水平
各组细胞内加入细胞裂解液,冰上裂解约20 min后离心取上清,BCA法检测蛋白定量。样品按体积比加入5×上样缓冲液,热水浴煮沸5 min将其变性后进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),用湿转法将凝胶中蛋白转至聚二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%的脱脂奶粉37℃封闭1 h,加EDNRB抗体,4℃孵育过夜,次日洗膜后加入相应二抗(1∶5000稀释),37℃孵育2 h,ECL法显影,利用凝胶图像处理系统拍照并分析条带灰度值。
1.8 统计学方法
应用SPSS 20.0软件进行统计分析,实验数据以均数±标准差(±s)表示,数据分析采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度栀子苷对拟缺血损伤内皮细胞活性的影响
图1显示,与对照组比较,模型组OD值显著降低(P<0.01),表明氧糖剥夺造成内皮细胞受到损伤,活性下降。与模型组比较,栀子苷低浓度阶段,随着浓度的增加,微血管内皮细胞活性逐渐增强,33.2 μg/ml浓度组达到最高峰,OD 值明显高于模型组(P <0.01),66.4 μg/ml浓度组 OD 值与模型组比较差异有统计学意义(P<0.05)。之后随浓度继续增加,内皮细胞活性反而下降,因此选用33.2 μg/ml作为下一步实验的用药浓度。
2.2 栀子苷对拟缺血脑微血管内皮细胞EDNRB mRNA水平的影响
图2显示,与正常组比较,模型组 EDNRB mRNA水平显著增高(P<0.05),提示拟缺血损伤可诱导脑微血管内皮细胞内皮素受体B mRNA水平的高表达;与模型组比较,栀子苷组EDNRB基因表达显著降低(P<0.05),且栀子苷组与正常组比较差异无统计学意义(P>0.05),提示栀子苷对EDNRB mRNA有显著下调作用。
2.3 栀子苷对拟缺血脑微血管内皮细胞EDNRB蛋白表达的影响
图3显示,Western blotting检测EDNRB蛋白表达情况,正常组内皮细胞EDNRB的表达量较少,造模后,EDNRB表达显著增多(P<0.05),栀子苷能显著下调EDNRB蛋白表达。定量分析显示,与模型组比较,栀子苷组灰度值显著降低,组间比较差异有统计学意义(P<0.05),与实时-定量PCR结果基本一致。
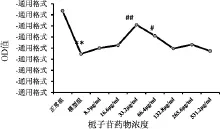
图1 不同浓度栀子苷对拟缺血损伤内皮细胞活性的影响
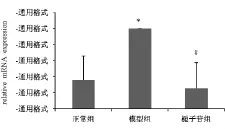
图2 栀子苷对拟缺血脑微血管内皮细胞中EDNRB mRNA水平的影响
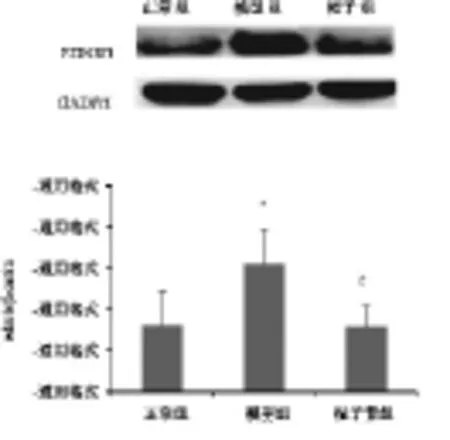
图3 栀子苷对拟缺血脑微血管内皮细胞EDNRB蛋白表达的影响
3 讨论
内皮素(endothelin,ET)是由血管内皮细胞培养液中分离纯化的一种活性肽,开始仅作为一种血管收缩物质进行研究。随着研究深入人们逐渐发现,内皮素的生物活性远远超过最初的认识,在生物体内具有广泛的生物作用。内皮素需要通过与内皮素受体结合,才能表达其生物学作用。研究显示,ET及其受体广泛分布于脑微血管内皮细胞、神经元及星形胶质细胞等中枢神经系统[5],与缺血性脑血管的发生发展关系密切。目前,用分子克隆方法在人体已鉴定出2种ET受体,即ET-A受体和ET-B受体[6]。ET-B受体主要分布于血管内皮细胞和平滑肌细胞。一般认为,表达于血管内皮细胞的ET-B受体在病变过程中具有介导内皮素的清除、血管舒张以及调节细胞增殖或凋亡等作用[7],似乎作为“保护性受体”发挥作用。然而近期的研究显示,ET-B受体可能具有更为广泛的生物作用。ET-B受体与ET-A受体都属于G蛋白偶联受体家族,有着共同的胞内信号传导通路。如刺激磷脂酶C激活,产生三磷酸肌醇和二酰甘油,以及导致细胞内钙离子增多及离子通道开放等,提示2种类型的受体可能共同介导ET的某些生物功能。另一方面,ET-B受体与ET-A受体不同,ET-B受体激活后同时促进磷脂酶A2激活,进而释放前列腺素(prostaglandin,PG)和血栓素 A2(thromboxane A2,TXA2)[8],PGs和TXA2除调节血管舒缩外,均为炎症反应物质,提示ET-B受体可能与介导炎症反应有关。不断有文献报道,大鼠脑缺血血管中的 ET-B受体上调。Zhang等人研究发现,内皮素B受体激活后可诱导肺血管内皮细胞的单核细胞趋化因子CXCL3表达,引起单核细胞聚集[9],提示ETB受体激活后可能诱导炎症反应的产生,进一步起到加重脑缺血损伤的病理作用。
栀子苷是栀子果实中的主要成分之一,又称京尼平苷。前期研究显示,栀子苷在缺血性脑损伤中具有保护血管内皮细胞、抗炎、抗氧化应激、抑制血小板活化与聚集等作用[10]。本实验中,我们首先利用氧糖剥夺模型观察了栀子苷作用于拟缺血损伤内皮细胞的量效关系,发现该药的药效与用药浓度之间并非线性关系,开始随着药物浓度的增加,使内皮细胞活性逐渐增强,即保护作用增强,33.2 μg/ml浓度时达高峰,之后随着用药浓度的增加,保护作用反而下降,故选用此浓度进行了后续实验。从RTPCR及western blotting结果来看,内皮细胞造模后,ETB受体的表达明显增加,栀子苷从mRNA及蛋白水平均可显著下调ETB受体的高表达。综上可知,内皮细胞ETB受体激活可介导单核细胞趋化因子以及其他炎症相关因子的表达,启动或加重炎性损伤。因此,栀子苷抑制拟缺血损伤中ETB受体的表达,提示可能是栀子苷在脑缺血性损伤中发挥抗炎作用的内在机制之一。
[1]Liu HT,He JL,Li WM,et al.Geniposide inhibits interleukin-6 and interleukin-8 production in lipopolysaccharide-induced human umbilical vein endothelial cells by blocking p38 and ERK1/2 signaling pathways[J].Inflamm Res,2010,59(6):451-461.
[2]张海燕,邬伟魁,杨军宣,等.栀子对心脑血管系统的作用研究[J].中国实验方剂学杂志,2011,17(14):294-298.
[3]李卫红,李澎涛,华茜,等.不同内皮细胞条件培养液对皮层神经元线粒体功能的影响及通络救脑注射液的保护作用[J].中国中西医结合杂志,2007,27(2):131-134.
[4]朱元,李澎涛,李卫红,等.不同状态的大鼠星形胶质细胞条件培养液对脑微血管内皮细胞血脑屏障特征性酶的影响[J].世界科学技术(中医药现代化),2012,14(2):1393-1398.
[5]Leonard MG,Gulati A.Endothelin B receptor agonist,IRL-1620,enhances angiogenesis and neurogenesis following cerebral ischemia in rats[J].Brain Res,1528:28-41.
[6]任年军.内皮素与脑缺血[J].国外医学·神经病学神经外科学分册,2001,28(4):291-293.
[7]王荫槐.内皮素和一氧化氮对前列腺平滑肌张力的调节作用[J].国外医学·泌尿系统分册,1997,17(01):17-20.
[8]Aramori I,Nakanishi S.Coupling of two endothelin receptor subtypes to differing signal transduction in transfected Chinese hamster ovary cells[J].J Biol Chem,1992,267:12468-12474.
[9]Zhang J,Yang W.Endothelin-1 activation of the endothelin B receptor modulates pulmonary endothelial CX3CL1 and contributes to pulmonary angiogenesis in experimental hepatopulmonary syndrome[J].Am J Pathol,184(6):1706-1714.
[10]那莎,郭国田,王宗殿,等.栀子及其有效成分药理研究进展[J].中国中医药信息杂志,2005,12(1):90-92.

