右美托咪啶联合氯胺酮对食管癌根治术患者的肺保护作用
张 伟,史志勇
(河北省新乐市中医医院,河北新乐050700)
食管癌是我国北方地区常见的消化道恶性肿瘤,开胸将肿瘤切除是有手术适应证患者首选的治疗方法。手术多采用一侧胸腔入路,使同侧肺组织萎陷,才能有开阔的手术野,但萎陷的肺组织的再膨胀,势必造成缺血再灌注损伤,加之术中呼吸机机械通气刺激作用,往往使肺组织产生炎症性损伤,如何运用麻醉药物保护患者的肺组织、减轻损伤,是麻醉医学研究的热点。本研究旨在探讨食管癌根治术麻醉期间联合应用右美托咪啶和氯胺酮对肺组织的保护作用及其机制。
1 临床资料
1.1 一般资料 选择2008年2月—2012年8月在我院行食管癌切除手术患者84例,男65例,女19例;年龄39~71(57.2±3.2)岁;ASAⅠ级或Ⅱ级。所有患者术前无感染性疾病,肝脏及肾脏功能均无严重异常,出凝血时间检测在正常范围,未采用任何治疗。将84例患者按手术的先后顺序分为研究组和对照组,每组42例,2组患者一般资料具有可比性,见表1。
表1 2组患者一般情况比较(±s)

表1 2组患者一般情况比较(±s)
组别 n年龄/岁 体质量/kg单肺通气时间/min丙泊酚用量/mg出血量/mL 补液量/mL研究组 42 57.5±2.3 56.2±8.1 145.8±27.2 1195±228 736±128 2500±370对照组 42 56.9±2.4 57.3±7.6 143.6±29.6 1201±231 745±119 2400±380
1.2 麻醉方法 2组患者均在术前30 min给予苯巴比妥钠0.1 g和阿托品0.5 g肌肉注射。入室后足背动脉穿刺置管,以备抽取动脉血标本。然后给予咪唑安定0.05 mg/kg、依托咪酯0.3 mg/kg、芬太尼4 μg/kg 、维库溴铵0.1 mg/kg静脉注射,诱导麻醉成功后,行气管插管,然后用麻醉机机械通气;潮气量为8~10 mL/kg,呼吸频率为10~12次/min,氧流量为2~3 L/min,吸气和呼气之比为1∶2,将PETCO2控制在30~40 mm-Hg(1 mmHg=0.133 kPa),单肺通气时潮气量调整为6~8 mL/kg,呼吸频率为12~15次/min。术中以维库溴铵0.05~0.1 mg/kg、异丙酚5~7 mg/kg及芬太尼2~4μg/(kg·h)维持麻醉。研究组在诱导麻醉后,以1μg/(kg·h)的速率静脉泵注右美托咪啶1 h,同时将氯胺酮按1 mg/kg的量溶于100 mL 0.9%氯化钠溶液中持续静脉泵注,1 h泵完。对照组给予等量的0.9%氯化钠溶液。
1.3 观察指标 2组患者均在麻醉诱导前(t1)、单肺通气1 h(t2)、单肺通气2 h(t3)和手术后4 h(t4)4个时间点分别采集血液标本,离心后收集上清液,放入冰箱于-20℃保存,采用酶联免疫法检测血清中TNF-α、IL-6、IL-8、IL-10浓度;测定吸入氧气的浓度(FiO2)和室内大气压(Pb),计算呼吸指数(RI)。
1.4 统计学处理 采用SPSS 19.0版本软件进行统计处理。计量数据采用均数±标准差表示,组内比较采用单因素方差分析,组间同时相比较采用配对样本的t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者t1、t2、t3时相RI比较 2组t3时相 RI值较t1时相升高,t3时相研究组RI值较对照组降低。见表2。
表2 2组患者RI比较(±s)

表2 2组患者RI比较(±s)
注:①与对照组比较,P<0.05;②与 t1比较,P<0.05。
对照组 42 0.45±0.11 0.70±0.11 0.63±0.13②
2.2 2组患者各时相炎性因子测定值比较 2组患者TNF-α、IL-6 、IL-8、IL-10测定值 t3、t4时相较 t1时升高,t3、t4时相时研究组与对照组比较:TNF-α、IL-6、IL-8浓度降低,IL-10浓度升高。见表3。
表3 2组患者各时间点炎性因子测定值比较(±s,μg/L)
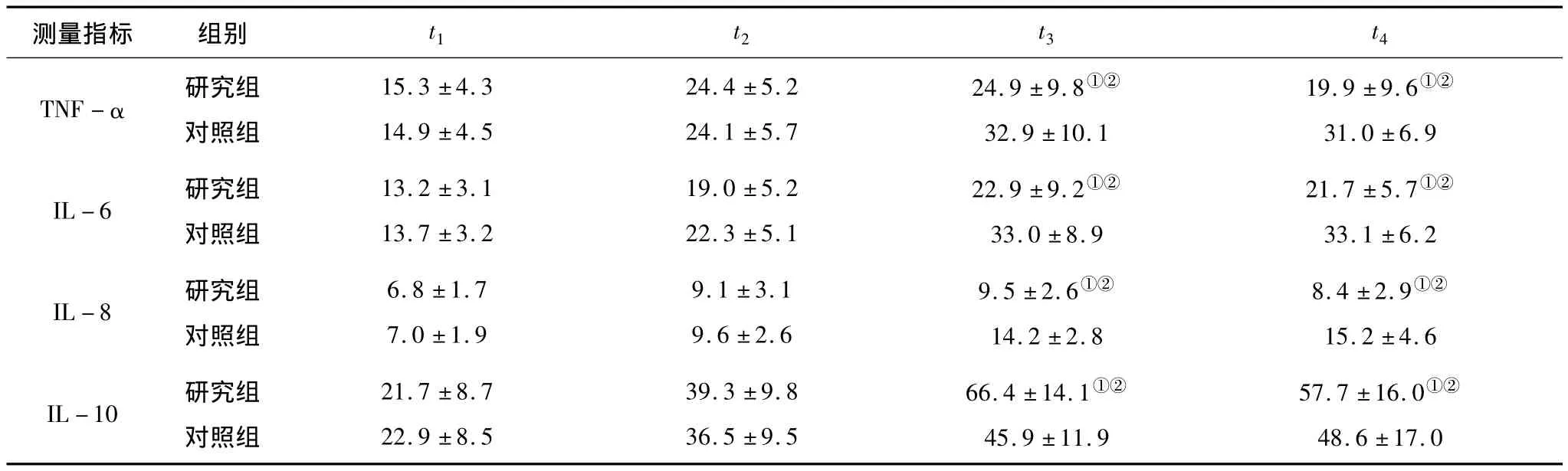
表3 2组患者各时间点炎性因子测定值比较(±s,μg/L)
注:①与对照组比较,P<0.05;②与 t1时比较,P<0.05。
IL-6 研究组对照组13.2±3.1 13.7±3.2 19.0±5.2 22.3±5.1 22.9±9.2①②33.0±8.9 21.7±5.7①②33.1±6.2 IL-8 研究组对照组6.8±1.7 7.0±1.9 9.1±3.1 9.6±2.6 9.5±2.6①②14.2±2.8 8.4±2.9①②15.2±4.6 IL-10 研究组对照组21.7±8.7 22.9±8.5 39.3±9.8 36.5±9.5 66.4±14.1①②45.9±11.9 57.7±16.0①②48.6±17.0
3 讨 论
呼吸机机械通气在食管癌开胸手术中起着至关重要的作用,是患者在全麻状态下维持全身各个脏器氧供应的保证,然而机械通气尤其是高压力通气也增加了肺组织的损伤,这些损伤主要包括肺泡破坏、肺水肿和气压伤等,导致肺泡上皮细胞促炎因子和抗炎因子的释放,细胞因子反应是炎性反应的重要环节,促炎、抗炎因子的相对平衡才能维持机体正常的免疫力[1],并且免疫细胞因子的平衡状态也反映了机体的免疫功能。在呼吸机机械通气时导致肺损伤引发炎性因子的改变,可能导致机体免疫状态发生变化,使患者术后并发症增加,因此对炎性反应的有效抑制有十分重要的意义。
TNF-α由单核巨噬细胞和T细胞产生,是炎症反应中最早出现的炎症递质,具有多种生物活性,低浓度的TNF-α就能够刺激单核细胞分泌IL-6、IL-8等炎症因子,并且能够激活巨噬细胞,进一步增加TNF-α的分泌,使血浆中TNF-α含量增加[2]。IL-6是单核巨噬细胞在TNF-α诱导下产生的,是体内启动全身性炎性反应最强的炎性递质,其血清中的含量反映了炎性反应的程度,血清中IL-6水平增高的幅度与手术创伤的程度呈正相关,是机械通气后肺组织损伤的重要标志。IL-8是炎性反应导致肺损伤的特异性细胞因子[3],能够将中性粒细胞激活,使其产生呼吸爆发,生成大量氧自由基和白三烯,从而加重炎性反应区域的损伤。IL-10在体内的合成晚于 TNF-α、IL-6、IL-8等炎性因子[4],但是能够通过抑制单核细胞产生以上炎性因子而起到抗炎作用,并且能够减少炎症对于机体的损伤。本研究显示,2组患者在 t1、t2、t3时相 TNF-α、IL-6、IL-8含量增加,说明食管癌根治术中由于呼吸机机械通气引起了肺组织及全身的炎性反应。
氯胺酮属苯环己哌啶类静脉麻醉药,具有麻醉和镇痛双重作用,在危重患者的麻醉诱导中广泛应用。右美托咪啶是一种高选择性α2肾上腺素受体激动剂,具有较强的镇痛、抗焦虑和镇静作用,并且具有较小的血流动力学影响[5]。对呼吸抑制作用弱,容易被唤醒,多用于危重成年患者的短期使用。本研究中,2组患者炎性因子TNF-α、IL-6、IL-8在单肺通气时开始升高,说明机械通气诱发了炎性反应,并且促炎性因子与RI呈正相关,提示此炎性反应与呼吸关系密切,研究组在t3、t4时相炎性因子TNF-α、IL-6、IL-8的血清含量低于对照组,而血清中IL-10含量高于对照组,并且研究组在t2、t3时相RI值低于对照组,肺功能好于对照组,说明氯胺酮和右美托咪啶联合应用对呼吸机所致肺损伤起到保护作用,其机制就是在术中和术后能降低血清中TNF-α、IL-6、IL-8的产生和释放,增加IL-10的产生和释放,从而减轻肺损伤所致的炎性反应,与国内外学者的研究是一致的[6-7]。
综上所述,氯胺酮与右美托咪啶联合应用,在食管癌根治术麻醉过程中,通过抑制促炎性因子TNF-α、IL-6、IL-8的产生和释放,促进抑炎性因子IL-10的产生和释放,抑制肺组织炎性反应,对肺组织起到保护作用。
[1]章玲宾,刘子贵,樊理华,等.右美托咪定对颅脑手术患者围手术期炎性细胞因子的影响[J].中华医院感染学杂志,2012,22(13):2752-2754
[2]徐磊,鲍红光,徐建国.丙泊酚对大鼠缺血-再灌注脑TNF-a、IL-10、NF-xB 的影响[J].临床麻醉学杂志,2009,25(5):425-427
[3]Hofstetter C,Flondor M,Hoegl S,etal.Interleukin-10 aerosol reduces proinflammatory mediators in bronchoalveolar fluid of endotoxemic rat[J].Crit Care Med,2005,33(10):2317-2322
[4]Lee HS,Wang Y,Maciejewski BS,etal.Interleukin-10 protects cultured fetal rat type II epithelial cells from injury induced by mechanical stretch[J].Am J Physiol Lung Cell Mol Physiol,2008,294(2):L225-232
[5]Schaffrath E,Kuhlen R,Tonner PH.Analgesia and sedation in intensive care medicine[J].Anaesthesist,2004,53(11):1111-1116
[6]Yang CH,Tsai PS,Wang TY.Dexmedetomidine-ketamine combination mitigates acute lung injury in haemorrhagic shock rats[J].Resuscitation,2009,80(10):1204-1210
[7]Can M,Gul S,Bektas S.Effects of dexmedetomidine or methylprednisolone on inflammatory responses in spinal cord injur[J].Acta Anaesthesiologica Scandinavica,2009,53(8):1068-1072

