共表达siat7e和st3galⅠ基因MDCK细胞株的建立
张启龙,陈小云,王 栋
(中国兽医药品监察所,北京100081)
采用哺乳动物细胞系生产流感疫苗工艺因具有无外源因子污染、纯度高、安全性好[1]等特性,逐渐替代了传统的鸡胚生产工艺。其中MDCK细胞具有易培养、增殖快、流感病毒易感等特点,被作为流感病毒疫苗生产的重要细胞系之一[2]。
研究[3]发现,siat7e(ST6GALNacⅤ)是控制细胞贴壁程度的重要基因之一,其编码的蛋白属于α-2,6唾液酸转移酶家族成员,该基因表达水平的增加将降低细胞贴壁程度。St3galⅠ(beta-galactoside alpha-2,3-sialyltransferase I)基因编码β-半乳糖苷α-2,3唾液酸转移酶I,可催化唾液酸与半乳糖以α-2,3连接形式[4]构成流感受体组分,提高宿主细胞对流感病毒的敏感性。本文拟构建共表达siat7e和st3galⅠ基因的MDCK细胞株,以图同步解决MDCK细胞的悬浮培养及提高流感病毒敏感性。
1 材料与方法
1.1 细胞与载体 MDCK细胞来自国家兽医微生物菌种保藏中心;Top 10感受态细胞购自天根生化科技(北京)有限公司;pMD18-T载体购自宝生物工程(大连)有限公司;携带eGFP和siat7e、st3galⅠ基因的真核表达载体 pReceiver-siat7e-st3galⅠ[5]及pCMV-GFP载体,本室构建保存。
1.2 主要试剂 细胞/细菌总RNA提取试剂盒(DP430)、质粒小提试剂盒为天根(北京)生化科技有限公司产品;Taq DNA聚合酶、DL-2000 DNA分子量标准、Premix Ex TaqTM等为宝生物(大连)有限公司产品;氨苄青霉素、琼脂糖凝胶为Sigma公司产 品;LipofectamineⓇ2000 Transfection Reagent、DMEM、G418为 Invitrogen公司产品;DIG Glyan Differentiation Kit、Anti- digoxigenin - rhodamine 为Roche公司产品。
1.3 siat7e和st3galⅠ基因扩增方法扩增引物如下:siat7e-F:5’-TTACTCGCCACAAGATGCTG -3’,siat7e-R:5’-GCACCATGCCATAAACATTG -3’;st3galⅠ-F:5’- GGTGACCCTGCGGAAGAG -3’,st3galⅠ-R:5’-GATTTTATTGATGGAGGC -3’;反应体系为 premix 12.5 μL,上下游引物各1 μL,模板1 μL,ddH2O 9.5 μL;反应条件为94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 70 s,33 个循环;72 ℃ 10 min。
1.4 转染与克隆 待细胞长满,用胰蛋白酶消化收集细胞,用含1%FBS的培养基终止消化离心并弃去上清加入PBS重悬细胞,重复洗涤2~3次,最后将细胞重悬于电转缓冲液 106cells/90 μL,将载体质粒的浓度调整到1 μg/μL,吸取90 μL 细胞和10 μL质粒充分混匀,将混合液移入0.2 mm电击杯,150 V 5 ms电击后将混合液移入6孔板24 h后换液,用含0.8 mg/mL G418的培养基筛选,每3日换液,持续G418筛选2周,可见有抗性细胞生长。对阳性细胞采用有限稀释法,铺于96孔板,每3~4日换1次液筛选2周,挑选生长状态良好的单克隆细胞,继续用有限稀释法筛选单个能稳定表达双基因的细胞株,鉴定为阳性的细胞用胰酶消化后扩大培养并采用常规方法冻存细胞。另取消化后的细胞,按上述方法同步转染pCMV-GFP载体作为阳性对照。
1.5 阳性克隆的筛选鉴定 挑取14个生长状态良好的阳性细胞克隆按细胞总RNA提取试剂盒说明书提取各个单细胞克隆总RNA,按反转录试剂盒反转录成cDNA,再以 cDNA 为模板,siat7e-F、siat7e-R、st3galⅠ-F、st3galⅠ-R为引物,进行RT-PCR鉴定。
1.6 高表达细胞株的筛选
1.6.1 荧光定量 PCR 筛选 对1.5中siat7e、st3galⅠ基因RT-PCR扩增结果均为阳性的细胞克隆用荧光定量PCR进行筛选。同时用GAPDH作为内参进行定量分析。引物与PCR方法如下:
对 1.5 中 siat7e、st3galⅠ基因 RT -PCR 扩增结果均为阳性的细胞克隆用相对荧光定量PCR的方法进行检测。每个样品作3个平行对照,同时以超纯水代替cDNA模板作空白对照,以母本MDCK细胞制备的cDNA作阴性对照。反应体系:模板1 μL,引物 0.6 μL,Probe 0.4 μL,Mixture 12.5 μL,ddH2O 10.5 μL;反应循环条件:95℃ 5 min;95℃ 30 s,65℃ 30 s,共40个循环。反应结束后,直接由软件7500 FAST software(ABI公司)计算出Ct值。取3个重复样品的平均值,以GAPDH作为内参基因,计算得到目的基因的相对变化倍数(2-ΔΔCt)。1.6.2 流式细胞术筛选 MDCK与阳性细胞克隆株分别铺于6孔板,各铺3个孔。待细胞长至90%满时(每孔细胞约为1.5×106),胰酶消化,分别收集每孔细胞,加1%FBS的DMEM培养液0.5 mL中和胰酶活性,1000 r/min离心10 min,弃上清,收集细胞沉淀,用含10 mmol/L Glycine的PBS洗2次,再用 Buffer 1(50 mmol/L Tris-HCl、0.15 mol/L NaCl、1 mmol/L MgCl2、1 mmol/L MnCl2、1 mmol/L CaCl2,pH 7.5)洗1次。将配置好的10×Blocking Solution 用 TBS(0.05 mol/L Tris - HCl、0.15 mol/L NaCl,pH 7.5)稀释10倍,然后用稀释好的封闭液均匀重悬细胞沉淀,在冰上封闭1 h。之后按上述方法重复洗涤步骤,再分别用高丽槐黄柏甙凝集素(maackia amurensis agglutinin,MAA)、黑接骨木果凝集素(sambucusnigra agglutinin,SNA)及空白对照(即不加一抗)同样处理MDCK与阳性细胞克隆株,即1 μL 一抗(或不加)于30 μL Buffer 1 中均匀重悬细胞沉淀,冰上孵育1 h。重复洗涤步骤,再用1 μL Anti-digoxigenin -rhodamine于 30 μL Buffer 1中均匀重悬细胞沉淀,冰上孵育1 h,最后PBS洗涤3次后用于流式检测。
2 结果与分析
2.1 荧光观察结果 采用Olympus IX71倒置荧光显微镜,通过观察载体自带的eGFP荧光蛋白的表达情况,验证外源基因的表达情况。结果显示,阳性对照出现明显的绿色荧光,携带 pReceiversiat7e-st3galⅠ真核表达载体的MDCK阳性克隆也观察到绿色荧光信号,表明转染成功(图1)。
2.2 阳性克隆筛选结果 用RT-PCR对14个克隆进行扩增鉴定,结果只有 B3-1、C5、D5、S5-1、CV9 5个克隆两基因扩增均为阳性(图2)。
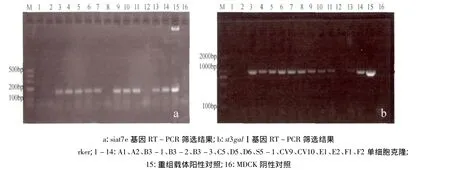
图2 阳性细胞siat7e和st3galⅠ基因鉴定结果
2.3 荧光定量筛选高表达细胞株 为选择双基因均高表达的单细胞克隆株,对RT-PCR条带较亮的5株细胞进行相对荧光定量检测。以CV9细胞克隆为参照,以MDCK为阴性对照,以GAPDH基因作为内参基因,经ABI FAST 7500检测B3-1、C5、D5、S5 -1、CV9 细胞克隆 siat7e和 st3galⅠ基因的表达,结果表明,siat7e、st3galⅠ在5株细胞中均有表达,其中C5细胞株双基因的表达水平显著高于其他4株(P<0.05)(图3)。
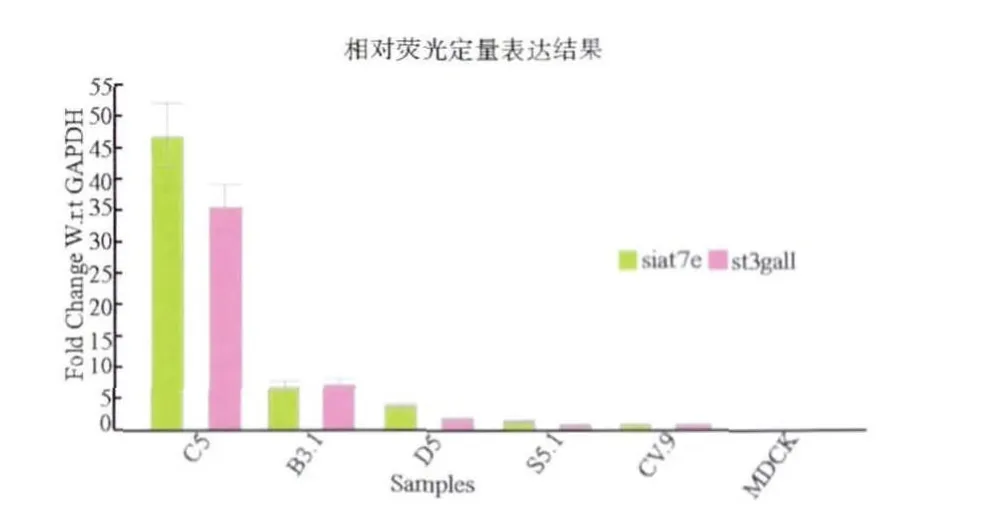
图3 相对荧光定量筛选结果
2.4 流式检测结果 为了检测siat7e和st3galⅠ基因在改造MDCK细胞上的蛋白表达含量,使用地高辛标记的两种凝集素作为一抗检测α-2,3及α-2,6连接型受体的表达量:SNA特异性识别2,6连接型唾液酸,MAA特异性识别2,3连接型唾液酸。罗丹明标记抗地高辛抗体为二抗。
挑选2.3中荧光定量PCR检测基因相对表达量较高的两个克隆C5和B3-1进一步用流式细胞术进行检测,同步用未转染载体的MDCK细胞作为对照。结果显示B3-1细胞克隆SNA、MAA处理后平均荧光值较MDCK对照无显著差异,C5细胞克隆SNA处理后平均荧光值由13019变为24554,siat7e基因蛋白水平表达差异显著(P<0.05);MAA处理后平均荧光值由7307变为13439,st3galⅠ基因蛋白水平表达差异显著(P<0.05)。从RT-PCR鉴定到流式细胞检测细胞已传12代,结果表明成功筛选到双基因稳定高表达的细胞克隆株(图4)。将C5和B3-1克隆分别命名为MDCK-C5和MDCK-B3-1细胞株。
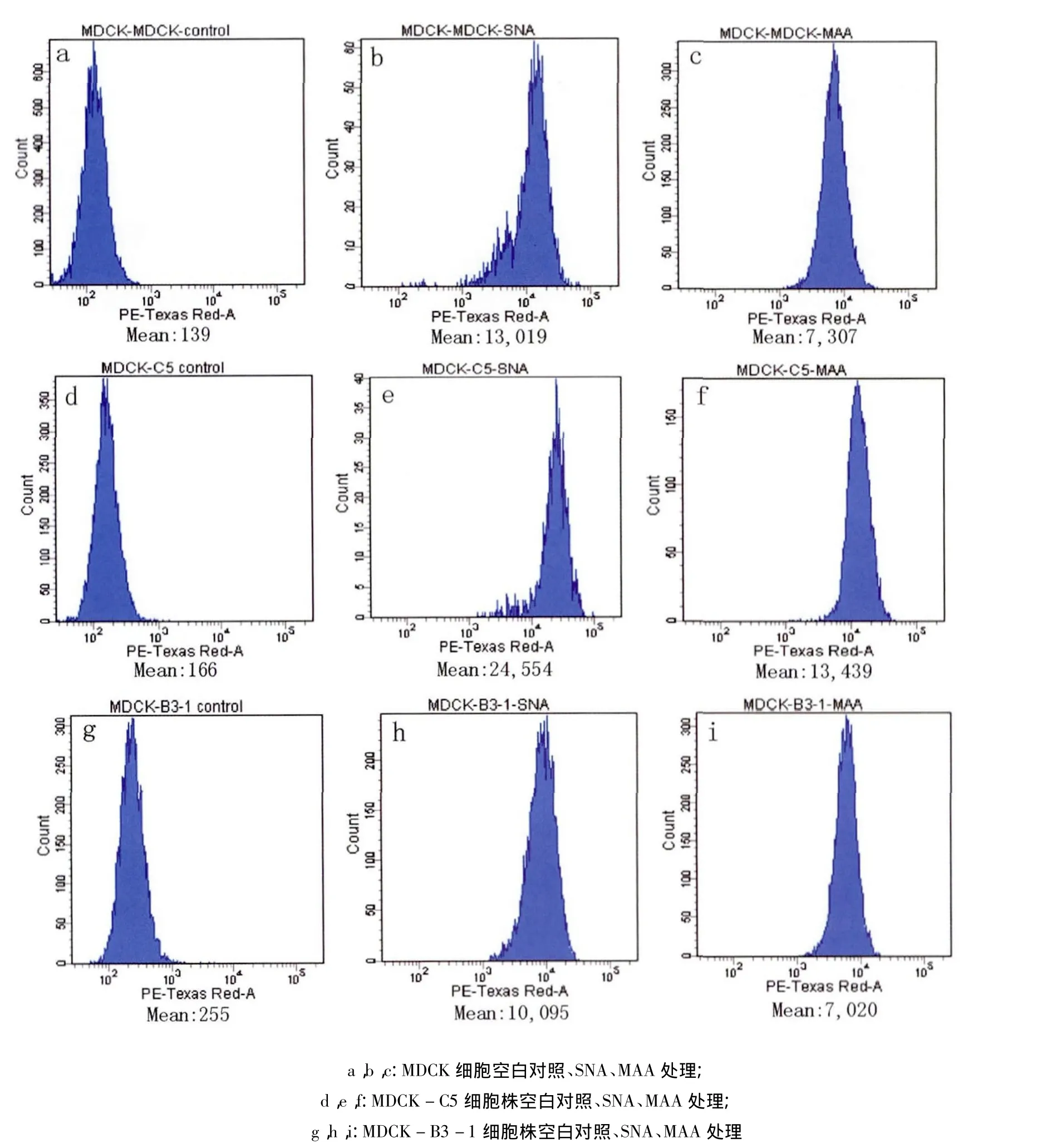
图4 流式细胞仪检测C5、B3-1阳性细胞克隆和MDCK细胞对不同连接型特异性凝集素的反应性
3 讨论
本试验采取相对定量的方法来分析基因的表达量,以消除由于样品不同导致的mRNA表达水平的差异,本研究采用看家基因GAPDH作为内参基因对所有样品进行归一化处理,采用△△Ct方法分别对不同细胞克隆株的双基因表达情况进行相对定量。然后采用流式细胞检测技术筛选出双基因表达量均最高的MDCK-C5细胞克隆株。
基因在mRNA水平的表达不能完全反映蛋白水平的表达,如本试验中MDCK-B3-1细胞株用荧光定量PCR方法证明mRNA转录水平高,但在蛋白表达水平检测时与阴性MDCK细胞差异不显著。
Chia Chu等将人的siat7e基因转染MDCK细胞,经悬浮驯化成功获得了适应悬浮培养的转siat7e基因的 MDCK 细胞系[6]。曹文雁等[4]成功构建了稳定表达st3galⅠ基因的MDCK细胞系,其α-2,3连接型受体的丰度显著高于MDCK细胞,部分禽流感病毒分离株在MDCK-st3galⅠ上形成的蚀斑数量更多、面积更大、形态更为清晰,生长滴度更高。但这些研究构建的细胞系均是单一表达siat7e基因或st3galⅠ基因。本文通过将真核表达载体pReceiver-siat7e-st3galⅠ电击转染MDCK细胞后,成功观察到绿色荧光蛋白的表达,证实该载体已成功转染至细胞中并成功表达,通过相对荧光定量PCR和流式细胞检测技术成功筛选到1株双基因稳定共表达的细胞株。
当前MDCK细胞是培养和分离流感病毒的最佳哺乳动物细胞系之一,但工业生产上大多采用贴壁或微载体悬浮培养,工艺繁琐易污染,由于MDCK细胞贴壁性能很强很难实现纯悬浮培养。该试验在国内外首次筛选到siat7e和st3galⅠ基因共表达细胞株,为下一步获得适应悬浮培养和对流感更易感的MDCK细胞株奠定了基础,为MDCK细胞大规模纯悬浮低成本生产流感疫苗作了有益的探索。
[1] Genzel Y,Reichl U.Continuous cell lines as a production system for influenza vaccines[J].Expert Rev Vaccines,2009,8:1681-1692.
[2] Manufacturing of vaccines-cell culture technology gradually replacing egg - based manufacturing[R].GBI Research Report,2011.
[3] Jaluria P,Chu C,Betenbaugh M,et al.Cells by design:a minireview of targeting cell engineering using DNA microarrays[J].Molecular Biotechnology,2008,39(2):105 -111.
[4] 曹文雁.稳定表达鸡st3galⅠ的MDCK细胞系的建立[D].北京:中国农业科学院,2008.
[5] 陈小云,张 敏,张启龙,等.siat7 e基因和st3galⅠ基因双表达载体的构建及其初步应用[J].中国兽药杂志,2013,47(4):6-9.
[6] Chu C,Lugovtsev V,Golding H,et al.Conversion of MDCK cell line to suspension culture by transfecting with human siat7e gene and its application for influenza virus production[J].PNAS,2009,106:14802-14807.

