高磷对维持性血液透析透患者微炎性反应和氧化应激的影响及机制
陈艳红,陈 星,成梅初,袁 芳,陈俊香,刘伏友
(1.中南大学 湘雅二医院 肾内科, 湖南 长沙 410011; 2.湖南省人民医院 SICU, 湖南 长沙 410005)
高磷对维持性血液透析透患者微炎性反应和氧化应激的影响及机制
陈艳红2,陈 星1*,成梅初1,袁 芳1,陈俊香1,刘伏友1
(1.中南大学 湘雅二医院 肾内科, 湖南 长沙 410011; 2.湖南省人民医院 SICU, 湖南 长沙 410005)
目的探讨高磷对维持性血透患者微炎性反应及氧化应激的影响及机制。方法实验分A组(正常人对照组),B组(维持性血透患者组即Maintenance hemodialysis,MHD),C组(不同磷酸二氢钠浓度剂量组 1.5 mmol/L、 C2 2.5 mmol/L及C3 5.5 mmol/L),D组(5.5 mmol/L磷酸二氢钠作用不同时间组D1 6 h、D2 12 h及D3 24 h)和E组(无磷酸二氢钠作用空白组E1 6 h、E2 12 h及E3 24 h组)。用real-time PCR及Western blot分别检测外周血单个核细胞NF-κB P65及NOX2/gp91的表达。ELISA检测血浆及细胞培养液上清IL-6含量,硫氮巴比妥酸法检测MDA含量。结果MHD组PBMC中NF-κBP65、NOX2 mRNA及phospho-NF-κBP65、NOX2 蛋白表达及血浆IL-6、MDA水平明显高于正常组;磷酸二氢钠作用下,培养液上清IL-6、MDA产生呈剂量、时间依赖性增加(Plt;0.05)。NF-κB P65 mRNA、phospho-NF-κBP65蛋白和NOX2/gp91 mRNAN及蛋白水平表达呈剂量、时间依赖性上调(Plt;0.05);NF-κB P65mRNA及phospho-NF-κB P65蛋白表达与培养液上清IL-6产生呈正相关, NOX2/gp91mRNA及蛋白表达与培养液上清MDA产生呈正相关。结论高磷可能通过活化NF-κBP65、NOX2/gp91信号通路介导炎性介质、氧化应激产物产生增加,高磷血症可能为MHD患者微炎性反应状态和氧化应激状态的危险因素。
维持性血液透析;高磷血症;微炎性反应;氧化应激
心血管并发症是维持性血透(maintenance hemodialysis,MHD)患者首要死亡原因。MHD患者死于心血管疾病 (cardiovascular disease,CVD)约达50%[1]。大量研究认为高磷血症是导致MHD患者血管钙化的主要原因[2-4],是MHD患者并发心血管病变的关键因素。微炎性反应和氧化应激状态是MHD患者并发心血管病变的重要因素。MHD患者普遍存在高磷血症、微炎性反应和氧化应激状态。高血磷在CKD患者炎性反应状态的发展中起了重要作用[5]。目前MHD患者高磷血症与氧化应激及微炎性反应状态的关系及机制尚不清楚。本研究通过高磷干预MHD患者单个核细胞,观察NF-ΚB P65、NADPH亚型(NOX2)的mRNA及蛋白表达水平及IL-6、MDA的产生变化,初步探讨高磷对炎性介质及氧化应激产物的影响及其机制。进一步深入认识高磷的危害,为预防和治疗MHD患者高磷所致心血管病变提供新思路。
1 材料与方法
1.1 研究对象
1.1.1 入选标准:中南大学湘雅二医院血液净化中心MHDA患者(透析6个月以上)38例(签署知情同意书),年龄30~65岁,肝功能、血常规、血脂正常。透析方案:维持性碳酸氢盐血液透析治疗,每周透析3次,每次4 h,使用贝郎Dialog+血液透析机,透析液流量500 mL/min,血流量200~300 mL/min,一次性血仿膜透析器(贝郎公司),血管通路为动静脉内瘘。排除标准:1)稳定血液透析lt;6个月;2)急、慢性肝脏疾病,急、慢性感染,恶性原肿瘤,自身免疫性疾病;3)近3个月内有输血史或手术史;4)近1个月内有静脉补充钙剂史,使用糖皮质激素、铁剂和降脂药。体检正常人20例。
1.1.2 实验分组:正常组(A组):20例;MHD患者组(B组)即:随机选取符合入选标准的MHD患者38例MHD患者中20例。余下18例随机分成C、D及E组,每组6例。C组:3个浓度不同磷酸二氢钠作用组1.5、 2.5和 5.5 mmol/L;D组:5.5 mmol/L磷酸二氢钠作用6、12和24 h;E组:无磷酸二氢钠作用组,常规培养6、12和24 h。
1.2 主要试剂
RPMI-1640培养基(Gibco公司);胎牛血清(杭州四季青公司);兔抗人phospho-NF-κB P65 (Ser536)多克隆抗体(CST公司);兔抗人NOX2/gp91phox多克隆抗体(北京博奥森生物技术有限公司);鼠抗人β-actin多克隆抗体,辣根过氧化物酶(horseradish peroxidase,HRP)标记抗小鼠二抗、抗兔二抗、抗山羊二抗(中杉金桥公司);Trizol试剂盒、SYBR green试剂盒(Invitrogen公司);组织细胞蛋白裂解液RIPA(北京鼎国生物公司);反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)(Fermentas公司);PCR引物由上海生物工程公司合成;ECL显影剂、PVDF膜(Millipore公司)。IL-6 ELISA试剂盒(Ramp;D公司);MDA试剂盒(南京建成)。
1.3 细胞培养与干预
用Ficoll密度梯度法分离MHD患者及正常人外周血单个核细胞及血浆。使用1640+10%胎牛血清培养基,37 ℃,5% CO2条件下培养。首先用1.5、2.5和5.5 mmol/L 3个不同浓度的磷酸二氢钠作用MHD患者PBMC 24 h后分离培养液上清及细胞。接下予高浓度5.5 mmol/L磷酸二氢钠干预,作用时间不同(6、12和24 h),检测 PBMC细胞NF-κB P65及NOX2蛋白及mRNA表达变化,及培养液上清IL-6、MDA产生变化。
1.4 检测方法
1.4.1 IL-6的检测:收集正常组和MHD血透组患者的血浆及培养液上清,-80 ℃保存,ELISA方法检测。
略论财务会计理论与实际相结合创新——高校财会教材适应发展更新 ………………………………… 覃正纳 刘迎春(1/72)
1.4.2 MDA的检测:血清和细胞上清中的MDA,采用硫代巴比妥酸比色法,严格遵说明说操作。
1.4.3 Western印迹检测PBMC NF-κB P65、NOX2蛋白表达:将PBMC加入50 μL预冷的组织细胞裂解液[使用前加入浓度1/100的苯甲基磺酰氟化物(phenylmethyl sulfonylfluoride,PMSF)]冰上裂解30 min。裂解液4 ℃,12 000r/min离心10 min,上清液移入新的1.5 mL离心管中,用二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒测定蛋白浓度。按照常规Western blot方法对上述各组phospho-NF-κB P65、NOX2及β-actin进行检测。以所测得的各条带的吸光度与内参照β-actin吸光度的比值代表定量值。
1.4.4 Real-time PCR检测PBMC NF-κB P65、NOX2 mRNA 表达:按Trizol试剂说明书抽提PBMC总RNA。按标准步骤进行反转录,所得cDNA进行real-time PCR实验。
1.5 统计学分析
2 结果
2.1 各组血浆及培养液上清中IL-6和MDA变化
MHD患者血浆IL-6、MDA水平明显高于正常人(A组)(表1);C组:磷酸二氢钠作用于MHD患者PBMC,培养上清IL-6、MDA产生呈剂量依赖性增加;D组:5.5 mmol/L磷酸二氢钠作用后培养上清IL-6、MDA产生呈时间依赖性增加(表2)。
2.2各组PBMCNF-κBP65、NOX2/gp91mRNA表达变化
2.2.2 C组中3个亚组PBMC中NF-κB P65和NOX2/gp91 mRNA表达水平:不同浓度磷酸二氢钠作用24 h:NF-κB P65、NOX2/gp91 mRNA表达呈上调呈剂量依赖性上调(图2)。
2.2.3 D和E组其各亚组NF-κB P65和NOX2/gp91 mRNA表达水平:高浓度(5.5 mmol/L)磷酸二氢钠作用6、12和24 h:NF-κB P65和NOX2/gp91 mRNA表达水平呈时间依赖性增高(图3)。
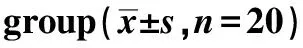
表1 正常组与MHD组血浆L-6和MDA变化Table 1 The lever of plasma IL-6 and MDA of different
*Plt;0.05 compared with normal control group.

表2 各组培养液上清中IL-6和MDA变化Table 2 The results of IL-6 and MDA of different
*Plt;0.01 compared with 1.5 mmol/L phosphate concentration group;#Plt;0.01 compared with high phosphate concentration stimulated 6 hours group.
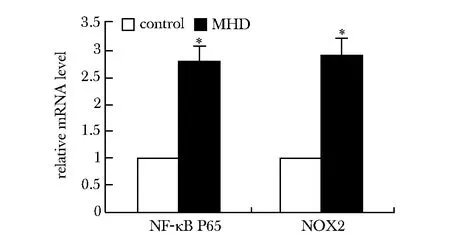
*Plt;0.01 compared with normal control group图1 MHD患者PBMC中NF-κB P65、NOX2/gp91mRNA表达情况Fig 1 The NF-κB P65 mRNA and NOX2/gp91 mRNA expression of in PBMCs of MHD patients
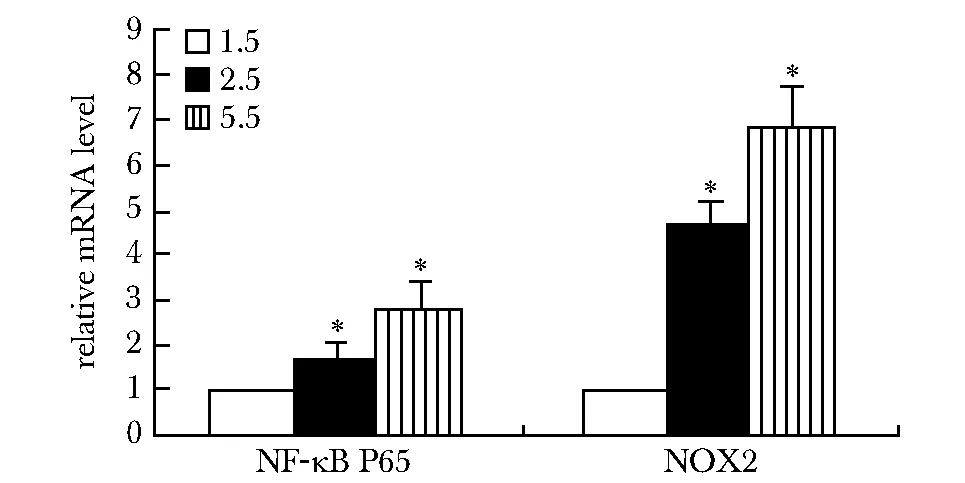
*Plt;0.01 compared with 1.5 mmol/L phosphate concentration guoup图2 不同浓度磷酸二氢钠干预NF-κB P65、NOX2/gp91表达变化Fig 2 The influence of the expression of the NF-κB P65 and NOX2/gp91 mRNA by different of phosphate concentration
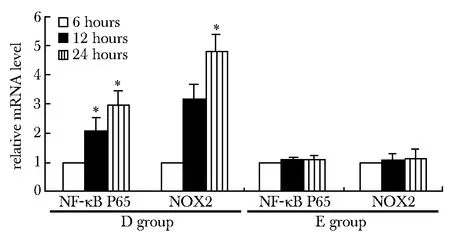
*Plt;0.01 compared with high phosphate concentration stimulated 6h group图3 高浓度磷酸二氢钠作用不同时间P65、NOX2/gp91表达变化Fig 3 The influence of the expression of the NF-κB P65 and NOX2/gp91 mRNA by High phosphate concentration
2.3Phospho-NF-κBP65、NOX2/gp91蛋白含量变化
2.3.1 A和B组PBMC中phospho-NF-κB P65和NOX2/gp91蛋白表达水平:MHD患者PBMC中phospho-NF-κBP65、NOX2/gp91蛋白表达显著上调(Plt;0.01)(图4)。
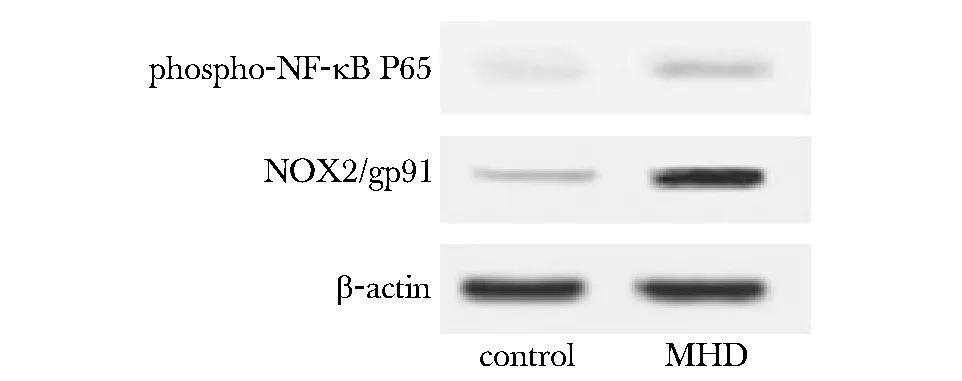
图4 MHD患者PBMC中phospho-NF-κBP65、NOX2/gp91 蛋白表达变化Fig 4 Phospho-NF-κB P65 protein and NOX2/gp91 protein expression of in PBMCs of MHD patients
2.3.2 C组中3亚组PBMC中phospho-NF-κB P65和NOX2/gp91 蛋白表达水平:不同浓度磷酸氢二钠钠作用PBMC 24 h:phospho-NF-κB P65、NOX2/gp91 蛋白表达呈剂量依赖性上调C2、C3与C1组比较,差异有统计学意义(Plt;0.01);C3与C2比较差异有统计学意义(Plt;0.01)(图5)。

图5 不同浓度磷酸二氢钠作用phospho-NF-κB P65、NOX2/gp91蛋白表达变化Fig 5 The influence of the expression of phospho- NF-κB P65 and NOX2/gp91 protein by different of phosphate concentration
2.3.3 D和E组中各亚组PBMC的phospho-NF-κB P65和NOX2/gp91蛋白表达水平:高浓度(5.5 mmol/L)磷酸二氢钠作用不同时间(6、12和24 h),phospho-NF-κB P65、NOX2/gp91蛋白表达呈时间依耐性上调D2、D3与D1比较有统计学差异(Plt;0.01),D3与D2比较有统计学差异(Plt;0.01),E组间无统计学差异(Pgt;0.05)(图6)

图6 高浓度5.5 mmol/L磷酸二氢钠作用不同时间phospho-NF-κB P65、NOX2/gp91蛋白表达变化Fig 6 The influence of the expression of phospho- NF-κB P65 and NOX2/gp91 protein by High phosphate concentration
2.4 相关指标间的相关性
MHD患者PBMC NF-κB P65 mRNA及phospho-NF-κB P65蛋白表达与培养液上清IL-6浓度呈正相关,相关系数分别为r=0.741、r=0.934(Plt;0.01); NOX2/gp91 mRNA及蛋白表达与培养液上清MDA浓度呈正相关,相关系数分别为:r=0.723,r=0.689(Plt;0.01)。
3 讨论
核因子κB(NF-κB)是广泛表达的炎性转录因子。P65通过蛋白磷酸酶2A去磷酸化后,NF-κB活性降低[6]。因此检测磷酸化的P65可以反应NF-κB的活化程度。
本研究显示MHD患者PBMC NF-κB的活性明显高于健康人,提示MHD患者 NF-κB信号途径过度活化,与其他作者报道一致[7]。这可能与长期血液透析、透析膜、透析水纯度及体内微炎性反应、氧化应激状态相关。本研究显示高磷可诱导MHD患者PBMC NF-κB活化,并呈浓度时间依赖性,NF-κB P65 mRNA、phospho-NF-κB P65蛋白表达与培养液上清IL-6浓度呈正相关。提示高磷可能通过活化NF-κB信号通路使IL-6的产生增多。提示MHD患者高磷与微炎性反应相关,高磷可能通过活化NF-κB促进炎性介质的产生。
NADPH氧化酶/NOX家族蛋白是生成ROS的重要来源,并可引起多种心血管疾病[8]。NADPH氧化酶(NOX)在单核细胞上主要表达NOX2(gp91phox),NOX2被认为是NADPH氧化酶的催化核心[9]。激活的NOX2,可致氧化应激[10]。
本研究显示MHD患者PBMC的NOX2表达及血浆MDA水平明显高于健康人,提示MHD患者处于氧化应激状态,与其他作者报道一致[11]。MHD患者氧化应激增强与体内某些毒性物质蓄积有关,如晚期氧化蛋白产物,不仅能诱导氧化应激,本身又是氧化应激的产物。本研究首次显示高磷可诱导MHD患者PBMC NOX2 mRNA及蛋白表达上调,且培养上清液MDA含量增多,呈时间和剂量依赖性, NOX2/gp91 mRNA及蛋白表达与培养上清液MDA浓度呈正相关。提示高磷可能通过上调 NOX2的表达,增加MDA产生,加重MHD患者氧化应激状态。因此高磷可能为MHD患者氧化应激增强的一个重要因素。高磷诱导平滑肌细胞线粒体势能改变增加ROS产生[12],高磷诱导氧化应激可能通过了不同的分子机制,这点有待进一步研究。
总之,本研究一方面提示高磷可诱导NF-κB信号通路活化,促进IL-6产生增加,加重MHD患者微炎性反应状态。另一方面提示高磷可诱导NOX2 mRNA及蛋白的表达,增加MDA的产生,加重MHD患者氧化应激状态。高磷可能为MHD患者微炎性反应和氧化应激状态的危险因素。因此提示可从高磷诱导微炎性反应及氧化应激角度考虑开拓新途径、新方法以减轻及预防高磷导致的心血管病变。
[1] Bloembergen WE. Cardiac disease in chronic uremia: epidemiology[J]. Adv Ren Replace Ther,1997,4:185-193.
[2] Blacher J, Guerin AP, Pannier B,etal. Arterial calcifications, arterial stiffness, and cardiovascular risk in end-stage renal disease.[J]. Hypertension,2001,38:938-942.
[3] Raggi P, Boulay A, Chasan-Taber S,etal. Cardiac calcification in adult hemodialysis patients. A link between end-stage renal disease and cardiovascular disease?[J]. J Am Coll Cardiol,2002,39:695-701.
[4] Goldsmith D, Ritz E, Covic A. Vascular calcification: a stiff challenge for the nephrologist: does preventing bone disease cause arterial disease?[J]. Kidney Int,2004,66:1315-1333.
[5] Navarro-Gonzalez JF, Mora-Fernandez C, Muros M,etal. Mineral metabolism and inflammation in chronic kidney disease patients: a cross-sectional study.[J]. Clin J Am Soc Nephrol,2009,4:1646-1654.
[6] Yang J, Fan GH, Wadzinski BE,etal. Protein phosphatase 2A interacts with and directly dephosphorylates RelA.[J]. J Biol Chem,2001,276:47828-47833.
[7] 许元文,李晓艳,张涤华,等. 维持性血液透析患者外周血单个核细胞NF-κB活性水平观察及其对白介素-6表达的影响[J]. 中国血液净化,2004,3:660-663.
[8] Ago T, Kuroda J, Kamouchi M,etal. Pathophysiological roles of NADPH oxidase/nox family proteins in the vascular system.-Review and perspective-.[J]. Circ J,2011,75:1791-1800.
[9] Loffredo L, Martino F, Carnevale R,etal. Obesity and Hypercholesterolemia are Associated with NOX2 Generated Oxidative Stress and Arterial Dysfunction[J]. J Pediatr,2012. 161:1004-1009.
[10] Takeya R, Sumimoto H. Molecular mechanism for activation of superoxide-producing NADPH oxidases.[J]. Mol Cells,2003,16:271-277.
[11]Himmelfarb J. Uremic toxicity, oxidative stress, and hemodialysis as renal replacement therapy.[J]. Semin Dial,2009,22:636-643.
[12] Zhao MM, Xu MJ, Cai Y,etal. Mitochondrial reactive oxygen species promote P65 nuclear translocation mediating high-phosphate-induced vascular calcificationinvitroandinvivo.[J]. Kidney Int,2011,79:1071-1079.
The effect and mechanism of high phosphorus concentration on microinflammatory and oxidative stress response in maintenance hemodialysis patients
CHEN Yan-hong2, CHENG Xing1*, CHENG Mei-chu1, YUAN Fang1, CHEN Jun-xiang1, LIU Fu-you1
(1.Dept. of Nephrology, the Second Xiangya Hospital of Central South University, Changsha 410011;2.Dept. of SICU,Hunan Provincial People’s Hospital, Changsha 410005, China)
ObjectiveTo investigate the effect of high phosphate on mRNA and protein expression of intracellular NF-κB and NOX2/gp91 in PBMC of MHD patients and serum inflammation mediators and MDA production,so as to understand the possible relationship among hyperphosphatemia, micro-inflammatory states and oxidative stress.MethodsThey were divided into five groups: control, MHD, dose, time and blank groups.Western blot and Real-time PCR were respectively used to determine the mRNA and protein expression of NF-κB P65,NOX2.The concentration of IL-6 in the culture supernatant was quantified by the ELISA kit and the TBA assay kit.ResultsNF-κB and NOX2 signal pathway in PBMCs show abnormal activation status in MHD patients. Both expression of NOX2/gp91 mRNA and protein levels increased dose-and time-dependent manners totally. IL-6 and MDA production in supernatant up-regulate dose-and time-dependent manners totally. NF-κB P65 mRNA and phospho-NF-κB 65 protein were positively correlated with IL-6 production. NOX2/gp91 mRNA and protein expression were positively correlated with MDA production.ConclusionsHigh phosphate may increase the production of supernatant IL-6 and MDA by activating NF-κB and NOX2 signaling pathway in PBMCs, thus could be a risk factor for microinflammatory and oxidative stress status of MHD patients.
maintenance hemodialysis; hyperphosphatemia; microinflammatory; oxidative stress
2013-06-04
2013-10-09
*通信作者(correspondingauthor): c.x1030@163.com
1001-6325(2014)03-0386-05
研究论文
R 692.5
A

