RNA干扰Glut1表达对MCF-7细胞增殖的影响
张秀梅,张 霞,肖建英
(辽宁医学院 生物化学教研室, 辽宁 锦州 121000)
RNA干扰Glut1表达对MCF-7细胞增殖的影响
张秀梅,张 霞,肖建英*
(辽宁医学院 生物化学教研室, 辽宁 锦州 121000)
葡萄糖转运蛋白(glucose transporter proteinl,Glut1)是哺乳动物转运葡萄糖跨过细胞膜进入细胞最重要的载体[1]。许多研究证实不同来源的恶性肿瘤Glut1表达水平升高。目前研究表明:Glut1可能与恶性肿瘤的发生发展有关。本研究探讨RNA干扰Glut1表达对MCF-7细胞生长增殖的抑制作用,探索肿瘤基因治疗的新途径。
1 材料与方法
1.1 材料:Glut1-siRNA序列:5′-UGAUGUCCAGAAGAAUA GU-3′; control-siRNA序列:5′-CUUACGCUGAGUACUUCGA-3′,人乳腺癌MCF-7细胞,Glut1兔抗人多克隆抗体。
1.2 实验分组:实验分为normal组,negative组,Glut1 siRNA 组。采用脂质体转染法转染RNA。
1.3 RT-PCR检测Glut1 mRNA表达水平:PCR引物序列如下:Glut1上游引物:5′-CAGTTCGGCTATAACACCGGTGTC-3′,下游引物:5′-GCCAAAGGGATTAACAAAGAGGCC-3′ β-actin上游引物:5′-CCTAGCACCATGAAGATCAA-3′,下游引物:5′-TTTCTGCGCAAGTTAGGTTT-3′。转染48 h后,采用Trizol法提取细胞总RNA,使用AMV反转录酶合成cDNA,进行RT-PCR。
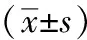
1.5 MTT法检测细胞增殖:将细胞接种于96孔培养板中,分别于细胞贴壁后第24、48、72和96 h加入MTT 50 μL(1 g/L),孵育4 h,加入DMSO,振荡15 min,使沉淀物充分溶解。用自动酶标分析仪于490 nm波长下检测吸光度值。根据吸光度值的大小来判断活细胞数,计算存活率。公式如下:
存活率=加药组A值/对照组A值×100%
1.6 流式细胞仪检测细胞周期:将MCF-7细胞转染后48 h消化成单细胞悬液,75%的乙醇4 ℃固定过夜,加入DNAStain染色液,室温避光15 min,上机测试。

2 结果
2.1 RNA干扰后Glut1 mRNA及蛋白表达水平:与对照组比较, Glut1干扰组Glut1的mRNA及蛋白水平显著下降(Plt;0.01)(表1,图1)。
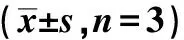
表1 Glut1 mRNA及蛋白表达水平Table 1 Glut1 mRNA and protein expression
*Plt;0.01 compared with normal.

1.normal; 2.negative; 3.Glut1 siRNA图1 Glut1蛋白表达水平Fig 1 Glut1 protein expression
2.2 细胞增殖水平分析:结果显示,细胞贴壁后72和96 h,Glut1干扰组的细胞存活率明显少于对照组和阴性对照组(Plt;0.01,表2)。

表2 Glut1干扰后对MCF-7细胞存活率的影响Table 2 Effect of Glut1 on survival rate in MCF-7(±s,n=3)
*Plt;0.01 compared with normal.
2.3 细胞周期检测结果:结果显示Glut1干扰组处于G0/G1期的细胞的比例明显高于对照组和阴性对照组,Glut1干扰组处于S期的细胞比例明显低于对照组和阴性对照组(Plt;0.01)(图2)。
3 讨论
大量研究表明[2],肿瘤细胞表面往往异常高表达GlutI,以增加葡萄糖的摄取满足其能量需求,因此认为Glut1是细胞恶变的早期标志。进一步研究发现,Glut1与肿瘤细胞增殖相关,Glut1的表达水平升高可以增加肿瘤细胞对葡萄糖的摄取,满足肿瘤细胞对能量的要求[3]。本研究利用RNA干扰技术,Glut1干扰组Glut1的mRNA及蛋白水平显著下降,干扰效率大于50%。
MTT实验结果显示Glut1干扰组的细胞存活率明显少于对照组和阴性对照组。这可能与RNA干扰后Glut1的mRNA及蛋白水平显著降低,减少细胞对葡萄糖摄取,降低细胞能量供给,抑制细胞增殖有关。
细胞周期实验结果显示,Glut1干扰组处于S期的细胞比例明显低于对照组和阴性对照组, 可能由于Glut1表达被抑制减少了细胞对葡萄糖的摄取,继而使得细胞能量供给减少,细胞停留在能量需要较少的细胞周期阶段,或离开细胞周期,即停止增殖。
综上所述,Glut1干扰对MCF-7细胞的生长增殖有显著影响,这为深入理解Glut1在肿瘤发生发展中所起作用及具体机制提供新的思路,也为Glut1干扰治疗肿瘤提供理论依据。
[1] Ayala FR, Rocha RM, Carvalho KC,etal.Glut1 and Glut3 as potential prognostic markers for oral squamous cell carcinoma [J].Molecules, 2010,15: 2374-2387.
[2] Frolova A, Flessner L, Chi M,etal. Facilitative glucose transporter type 1 is differentially regulated by progesterone and estrogen in murine and human endometrial stromal cells[J].Endocrinology, 2009,150: 1512-1520.
[3] Kalir T, Wang BY, Goldfischer M,etal. Immunohistochemical staining of GLUT1 in benign, borderline and malignant ovarian epithelia.[J].Cancer,2002,94:1078-1082.
2013-05-30
2013-09-26
辽宁省教育厅重点实验室项目(LS2010101)
*通信作者(correspondingauthor): xiaojianying6886@yahoo.com.cn
1001-6325(2014)04-0546-02
R 736.1
A

