烟草类胡萝卜素降解关键基因CCD1的克隆与表达分析
杨永霞,牛志强,张松涛,崔红,刘国顺
国家烟草栽培生理生化研究基地 河南农业大学烟草学院,郑州市文化路95号 450002
烟草类胡萝卜素降解关键基因CCD1的克隆与表达分析
杨永霞,牛志强,张松涛,崔红,刘国顺
国家烟草栽培生理生化研究基地 河南农业大学烟草学院,郑州市文化路95号 450002
为深入探索CCD1 的功能,利用RACE方法获得了烟草品种K326类胡萝卜素降解关键基因CCD1的2个cDNA全长序列。序列分析表明,CCD1-1与CCD1-2各包含一个1635和1647bp的开放读码框(ORF),编码544和548个氨基酸。分别与林烟草和绒毛状烟草CCD1存在一个碱基的差异。CCD1-1与CCD1-2基因序列GC含量为43.24%和42.87%。预测的蛋白质分子量均为61 kDa,理论等电点 (pI) 6.51和6.55。与番茄和辣椒等植物的类胡萝卜素CCD1的同源性达到80%以上。跨膜区预测表明分别在138~158和142~162位氨基酸间有1个跨膜螺旋区。蛋白质二级结构分析表明,均以β折叠和无规则卷曲为主。蛋白三维结构预测分析表明CCD1-1与CCD1-2空间结构极为相似。组织表达分析表明,CCD1-1与CCD1-2在花中的表达最强,根中的表达最弱,茎和叶次之。这些结果为进一步研究类胡萝卜素降解基因的功能提供了依据。
烟草;克隆;类胡萝卜素裂解双氧合酶;序列分析
类胡萝卜素在光合作用中担负着光吸收辅助色素的重要功能,同时也是烟叶重要致香物质的前体物,降解产物的种类及含量与烟叶香气品质有关[1]。尤其是茄酮和β-大马酮等香味物质是影响烟叶香气质和香气量的重要组分[2]。虽然对类胡萝卜素的降解仍有许多问题有待深入研究,但对模式植物拟南芥类胡萝卜素降解关键基因的研究为研究烟草类胡萝卜素降解提供了有益借鉴。已发现,类胡萝卜素裂解双氧合酶(carotenoid cleavage dioxygenases,CCDs)可催化裂解很多类胡萝卜素底物生成许多天然活性化合物(apocarotenoids),是类胡萝卜素降解过程的关键酶[3-4]。拟南芥CCD基因家族包含9个成员。有 5 种与ABA的合成有关,命名为NCED(包括NCED2,3,5,6,9)[5],其余 4 个被命名为CCD(包括CCD1,4,7,8),与植物激素(如独脚金内酯)、侧枝的生长和发育以及风味芳香物的形成过程密切相关[6-9]。几种CCD基因中,CCD1基因的作用机制最为复杂。在不同的植物中,CCD1编码的酶具有底物降解偏好性和功能特异性,可降解不同类胡萝卜素底物的不同双键,产生不同碳原子数的化合物,形成许多重要的香气物质。关于不同植物CCD1的功能我们在以往的文章中已有详细综述[10]。目前,NCBI数据库中除烟草Nicotiana langsdorf fii x Nicotiana sanderae杂交种CCD1的部分序列外,还没有相关基因克隆的报道。鉴于此,本研究克隆了烟草K326CCD1基因的全长cDNA序列,并采用生物信息学软件对其进行了详细分析,为进一步研究CCD1的功能打下基础。
1 材料和方法
1.1 材料
1.1.1 植物材料
试验所用材料为烟草品种K326、林烟草以及绒毛状烟草。采用漂浮育苗法育苗,温室培养至5-6片真叶幼苗,再移至含有基质的花盆中培养。
1.1.2 主要试剂和试剂盒
大肠杆菌感受态细胞 DH5α 为本试验室保存。pMD19-T 载体、普通Taq酶、高保真 LATaq酶、dNTP、Clontech的RACE试剂盒等试剂购自宝生物工程有限公司(TaKaRa);Trizol 试剂购自 Invitrogen公司,DNA 凝胶纯化回收试剂盒购于 omega 公司。M-MLV Revere Transcriptase (RNase H)反转录试剂盒、Marker DL2000购自上海莱枫生物科技有限公司。引物由Invitrogen 公司合成。
1.2 RNA提取及RACE模板制备
采用Trizol法提取RNA。将组织在液氮中磨成粉末,取适量的组织于离心管中,然后加入1mL Trizol提取液;室温放置5分钟,加入0.2mL氯仿,剧烈摇荡离心管15秒。4℃,12000 g离心15 min;吸取上层水相,至另一离心管中。加入0.5mL异丙醇-20℃冰箱放置20 min;4℃,12000 g离心10 min,弃上清,RNA沉于管底;75%乙醇清洗沉淀2次。4℃ 8000 g离心5 min,弃尽上清;室温晾干加入50 µL ddH2O溶解RNA样品。运用Clontech的RACE试剂盒制备5’Race 和3’Race模板。
1.3 CCD1全长基因的克隆
参考GenBank收录的烟草Nicotiana langsdorf fii x Nicotiana sanderae杂交种CCD1 基因序列,采用Primer5.0软件设计烟草K326 5’和3’扩增引物CCD-51 (5’-CATCTCCCTCCTCCCAAGCATT-3’)与CCD-31(5’-TGGGAGGAGGGAGATGATGTG-3’),利 用 clonetech RACE kit 进 行 5/3’RACE, 按 照说明书操作获取基因的全长cDNA序列。在此基础上,设计跨起始密码子和终止子的引物CCD-1F(5’-GAGACAGAGGTAAAATGGGGAG-3’) 和CCD-1R (5’-TCACAAGTATTTCTCACAGTTTG-3’)验证CCD1全长序列,此引物同时对林烟草与绒毛状烟草进行扩增。
PCR 扩增产物采用 1% 琼脂糖凝胶分离。回收纯化后连接到 pMD19-T 载体,转化大肠杆菌 DH5α感受态细胞,然后涂布于加有 X-gal 和 IPTG 的 LB 培养基平板,培养过夜。挑取白斑,用 M13 引物扩增检测。筛选出预期大小的阳性克隆送 Invitrogen 公司测序,每个片段至少测 3 个克隆。不同引物对扩增出的重叠区段用 DNAman 软件进行序列拼接。
1.4 序列分析
利用 NCBI 的 Blast和ORF finder进行核酸序列比较与阅读框架确定。运用 DNAstar 软件推测蛋白质序列,Expasy Protparam软件[11]分析蛋白质的分子量、等电点和氨基酸组成。PROSITE[12]和SMART[13]软件预测蛋白质结构功能域。蛋白质疏水性分析、跨膜区预测和螺旋卷曲分析分别采用 ProtScale (http://www.expasy.ch/tools)、TMpred[14]和 Coils[15]软件进行。使用在线工具 SOPMA[16](http://www.expasy.org) 预测二级结构并计算各种二级结构所占的百分比。同时将推测的氨基酸序列提交瑞士生物信息研究所 (European Bioinformatics Institute:http://www.isb-sib.ch/) Swissmodel,基于同源建模的原理进行蛋白质的三维结构预测。蛋白三维结构用 PyMol 软件显示。
1.5 CCD1的表达分析
盛花期分别取烟草品种K326中部叶、根、茎以及花1.0 g,放入1.5mL的离心管中,立即放入液氮中速冻,置-80℃冰箱保存。按照Trizol法提取RNA,依照M-MLV Revere Transcriptase (RNase H)反转录试剂盒说明合成cDNA第一链。以烟草的CCD1-1和CCD1-2基因全长序列设计特异性正反向引物:CCD1-1F:5'-TGAAACTCCTCCTCTTACCAACCTC-3’CCD1-1R:5'-GTATTAGCTGCGCCATTTCCG-3’,CCD1-2F:5'-TGAAACTCCTCCTTTTAAGAAC-3’,CCD1-2R:5'-CGCATCTAGATCTGGATTCTGC-3’,以烟草根、茎、叶和花 cDNA 为模板扩增目的基因片段。PCR 程序为:94℃ 5 min;94℃ 30 s,53℃ 30 s,72℃ 50 s,35个循环,72℃ 10 min。以烟草L25基因 (L18908) 作为 RT-PCR反应的内参基因,内参引物 L25-F:GCTTTCTTCGTCCCATCA;L25-R:CCCCAAGTACCCTCGTAT,半定量 RT-PCR的反应程序为:94℃ 5 min;94℃ 30 s,46℃ 30 s,72℃ 50 s,30个循环,72℃10 min。
2 结果与分析
2.1 CCD1 cDNA和DNA全长序列的克隆和测序
采用TRIzol RNA提取方法,提取了K326、林烟草以及绒毛状烟草的总RNA,获得了28S和18S比例较好的RNA,运用Clontech的RACE试剂盒通过Race PCR方法扩增得到K326CCD1基因的5’端和3’端基因片段,其中5’端大小约800 bp左右,3’端大小约500 bp(图1),试剂盒回收相应片段,运用菌落PCR和质粒PCR方法鉴定出阳性克隆,送生物公司测序。通过与5’和3’以及中间序列拼接,得到CCD1 cDNA全长序列。
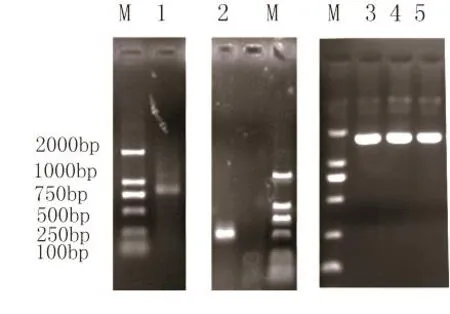
图1 CCD1 ORF扩增电泳检测图
利用引物CCD-1F和CCD-1R扩增K326、林烟草以及绒毛状烟草的ORF,得到1700 bp左右的片段(图1),回收相应片段测序,结果表明K326包含两个CCD1 (CCD1-1与CCD1-2)基因序列(Genbank登录号KC747729,KC747730)。序列分析表明林烟草只含有CCD1-1(Genbank 登录号KC747731),而绒毛状烟草只含有CCD1-2(Genbank 登录号KC747732)。
2.2 CCD1基因和蛋白序列的分析
2.2.1 序列分析
对K326CCD1 cDNA全长序列进行ORF finder分析发现,CCD1-1型基因包含一个1635 bp的完整开放读码框(ORF),与林烟草CCD1基因长度相同,两个物种序列同源性极高,仅存在一个碱基的差异。CCD1-2型基因包含一个1647 bp的ORF,与绒毛状烟草CCD1基因长度也相同,也是存在一个碱基的差异。对K326CCD1 ORF进行分析发现,CCD1-1与CCD1-2 同源性达97%。CCD1-1序列GC含量为43.24%,CCD1-2为42.87%。BLAST比对表明,CCD1-1与CCD1-2核苷酸序列与Genbank公布的蓝格斯多夫烟草与美花烟草杂交种中的烟草类胡萝卜素裂解双氧合酶(CCD1)的同源性分别达98%和99%,与番茄CCD1-2的同源性均为92%,与辣椒、桂花以及葡萄CCD的同源性分别达84%、83%、80%和79%、80%、79%。因此,我们推测该CCD1-1与CCD1-2为烟草CCD1基因。
运用DNAstar软件推测该基因的氨基酸序列,Expasy Protparam软件分析蛋白质的分子量、等电点和氨基酸组成。结果表明,CCD1-1与CCD1-2分别编码544和548个氨基酸,各种氨基酸的组成如表1所示。其中碱性氨基酸(Arg、Lys) 分别为62个和65个,强酸性氨基酸 (Asp,Glu) 68个和71个,疏水氨基酸 (Ala、Ile、Leu、Phe、Trp、Val) 均为 181个,不带电荷的极性氨基酸 (Asn、Cys、Gln、Ser、Thr、Tyr) 118和116个。CCD1-1 20种氨基酸中含量最高的为Gly和Leu (8.6%),其次是Val (8.1%)、Lys (7.7%)、Glu (6.6%) 和 Pro (6.2%)。CCD1-2 20种氨基酸中含量最高的为Gly和Leu (8.6%),其次是Lys (8.0%)、Val (7.5%)、Glu (6.9%)和 Pro (6.2%)。预测的蛋白质分子量为均为61 kDa,理论等电点 (pI)为6.51和 6.55。

表1 K326 CCD1-1和K326 CCD1-2 氨基酸组成、数目及所占比例
2.2.2 蛋白质结构域分析
使用PROSITE和SMART软件对该基因的蛋白质结构域进行了分析和预测。如图2-1和2-2所示,该基因编码的蛋白包含CCD家族保守的结构域,进一步证实所克隆序列为编码CCD蛋白的基因。

图2-1 K326 CCD1-1蛋白质结构域

图2-2 K326 CCD1-2蛋白质结构域
2.2.3 蛋白质疏水性分析、跨膜区预测、信号肽和螺旋卷曲分析
蛋白质疏水性分析、跨膜区预测和螺旋卷曲分析分别采用ProtScale、TMpred和 Coils软件进行。图3-1给出的是烟草CCD1-1蛋白质疏水性分析结果。其疏水性最大值为2.15,最大亲水峰有1处。亲水性最大值为-3。在138~158位氨基酸间找到分值很高的1个跨膜螺旋区,其最可能的方向为从膜外到膜内,N端在胞外。图3-2 给出的是烟草CCD1-2蛋白质疏水性分析结果。其疏水性最大值为2.15,最大亲水峰有3处,亲水性最大值为-3。在142~162位氨基酸间找到分值很高的1个跨膜螺旋区,其最可能的方向为从膜外到膜内,N 端在胞外。推测烟草CCD蛋白为跨膜蛋白。螺旋卷曲分析显示,CCD1-1与CCD1-2蛋白质中没有明显的卷曲螺旋。

图3-1 K326 CCD1-1蛋白质疏水性分析

图3-2 K326 CCD1-2蛋白质疏水性分析
2.2.4 蛋白质二级结构分析
使用在线工具 SOPMA对该蛋白质二级结构的预测结果表明,CCD1-1蛋白质二级结构中含有16.91%的α螺旋、23.90%的β折叠、5.33%的转角和53.86%的无规则卷曲。CCD1-2蛋白质二级结构中含有18.07%的α螺旋、22.81%的β折叠、5.47%的转角和 53.65%的无规则卷曲,β折叠和无规则卷曲构成了CCD1蛋白二级结构的主要成分。

图4 K326 CCD1-1与CCD1-2蛋白质三级结构模型
2.2.5 蛋白质三级结构模拟
将推测的氨基酸序列提交瑞士生物信息研究所Swiss-model,该蛋白质的三维结构模拟结果如图4所示。由此可以看出CCD1-1蛋白与CCD1-2蛋白均是以β折叠和无规则卷曲为主。且CCD1-1与CCD1-2蛋白三维结构很相似,仅在无规则卷曲部分存在差异。
2.3 CCD1基因表达分析
采用RT-PCR分析烟草K326中CCD1-1与CCD1-2基因在烟株根、茎、叶和花中的表达情况可知,CCD1-1和CCD1-2均为在花中的表达最强,在叶和茎中的表达其次,根中的表达最弱(图4)。

图5 CCD1-1与CCD1-2在不同组织中的表达情况
3 结论与讨论
本研究中,我们克隆并测得K326CCD1基因的2个拷贝的全长cDNA序列。它们与其它植物CCD1的相似性达到80%以上,证明我们克隆到的2个基因为烟草CCD1基因。2个拷贝之间相似性达97%,长度存在12个碱基的差异。其编码蛋白的二级结构和三级结构也表现出很高的相似性,暗示这两个拷贝功能可能类似。本研究同时对普通栽培烟草的两个祖先种林烟草和绒毛状烟草进行了克隆,发现林烟草中的CCD1基因与普通烟草中的CCD1-1,绒毛状烟草中的CCD1基因与普通烟草中的CCD1-2表现出极高的相似性,相互之间仅存在一个碱基的非同义突变。进一步支持了林烟草和绒毛状烟草是普通烟草父母本的推断。同时也说明类胡萝卜素降解关键基因在普通栽培烟草中是相当保守的。我们后来对香料烟和白肋烟的研究结果(未发表)也证实了这一点。另外,跨膜分析表明,K326CCD1-1和CCD1-2均含有一个跨膜螺旋区,它们具有明显的亲水和疏水区,这些特点提示K326CCD1可能为膜定位蛋白。
本研究对类胡萝卜素降解关键基因的克隆和分析为进一步利用过表达和敲除表达等方法研究该基因的功能提供了一定的研究基础。相对于其它很多植物,目前对烟草类胡萝卜素代谢尤其是降解的调控机制以及代谢关键基因的表达调控了解有限。通过对类胡萝卜素降解关键基因的研究可有助于阐明香气物质前体物产生的分子机理,从而为从分子水平上进行代谢调控提供一定的理论依据。
[1]Maldonado-Robledo G,Rodriguez-Bustamante E,Sanchez-Contreras A,et al.Production of Tobacco Aroma from Lutein.Speci fic Role of the Microorganisms Involved in the Process[J].Appl Microbiol Biot,2003,62(5-6):484-488.
[2]史宏志,刘国顺.烟草香味学[M].北京:中国农业出版社,1998:212-214.
[3]Cunningham F X,Gantt E.Genes and Enzymes of Carotenoid Biosynthesis in Plants[J].Annu Rev Plant Physiol Plant Mol Biol,1998,49(1):557-583.
[4]Auldridge M E,Block A,Vogel J T,et al.Characterization of Three Members of the Arabidopsis Carotenoid Cleava ge Dioxygenase Family Demonstrates the Divergent Roles of This Multifunctional Enzyme Family[J].Plant J,2006,45(6):982-993.
[5]Tan B C,Joseph L M,Deng W T,et al.Molecular Characterization of the Arabidopsis 9-Cis Epoxycarotenoid Dioxygenase Gene Family[J].Plant J,2003,35(1):44-56.
[6]Umehara M,Hanada A,Yoshida S,et al.Inhibition of Shoot Branching by New Terpenoid Plant Hormones[J].Nature,2008,455(7210):195-200.
[7]Matuso va R,Rani K,Verstappen F W,et al.The Strigolactone Germination Stimulants of the Plant-Parasitic Striga andOrobancheSpp.Are Derived from the Carotenoid Pathway[J].Plant Physiol,2005,139(2):920-934.
[8]Schwartz S H,Qin X,Zeevaart J A.Elucidation of the Indirect Pathway of Abscisic Acid Biosynthesis by Mutants,Genes,and Enzymes[J].Plant Physiol,2003,131(4):1591-1601.
[9]Fleischmann P,Wat anabe N,Winterhalter P.Enzymatic Carotenoid Cleavage in Star Fruit (Averrhoa Carambola)[J].Phytochemistry,2003,63(2):131-137.
[10]杨永霞,王景,崔红,等.烟草类胡萝卜素代谢的遗传及基因工程研究进展[J].中国烟草学报,2013,19(1):90-94.
[11]Gasteiger,E,Hoogland C,et al.,The Proteomics Protocols Handbook.Protein Identi fication and Analysis Tools on the ExPASy Server [M].Totowa:Human a Press.2005:571-607.
[12]Hofmann K,Bucher P,et al.The PROSITE database,its status in 1999 [J].Nucleic Acids Res,1999,27(1):215-219.
[13]Letunic I,Copley R R,et al.SMART 5:domains in the context of genomes and networks [J].Nucleic Acids Res,2006,34:257-60.
[14]Hofmann K,Stoffel W.TMbase - A database of membrane spanning proteins segments [J].Biol.Chem.Hoppe-Seyler 1993,374:166.
[15]Lupas A,Van Dyke M,Stock J.Predicting coiled coils from protein sequences [J].Science,1991,252(5010):1162-1164.
[16]Geourjon C,Deleage G.SOPMA:signi ficant improvements in protein secondary structure prediction by consensus prediction from multiple alignments [J].Comput Appl Biosci,1995,11(6):681-4.
Cloning and expression of geneCCD1 critical to cleavage of tobacco carotenoid
YANG Yongxia,NIU Zhiqiang,ZHANG Songtao,CUI Hong,LIU Guoshun
National Tobacco Cultivation & Physiology & Biochemistry Research Centre; College of Tobacco Science,Henan Agricultural University,Zhengzhou,450002,China
Tobacco carotenoids and their apocarotenoid derivatives play essential physiological and developmental roles and provide plants tolerance to a variety of stresses.Using RACE method,two copies (namedCCD1-1 andCCD1-2) of the full-length cDNA sequence of tobacco carotenoid cleavage oxygenases1 were cloned from K326.Sequences analysis showed thatCCD1-1 andCCD1-2 contained of open reading frame (ORF ) 1635-bp and 1647-bp and coded 544 and 548 amino acid residues with the theoretical isoelectric point (pI) of 6.51 and 6.55,respectively.The calculated molecular masses were both 157 kDa.The GC contents of two copied gene were 43.24% and 42.78%.The similarity ofCCD1 with tomato,pepper and other plants reached to more than 80%.Protein hydropho bicity and transmembrane region’s prediction analysis indicated that there was one transmembrane helical region from 138 to 158 amino acids inCCD1-1 and from 142 to 162 inCCD1-2.The secondary structure prediction results showed that they were mainly made up by beta turns and random coil.The tertiary structure prediction results displayed thatCCD1-1 showed high similarity withCCD1-2 except in random coil.Expression analysis showed that the expression level was highest in flower,and lowest in root.These results provide some basis for the function analysis toCCD1.
tobacco; clone; carotenoid cleavage oxygenases; sequence analysis
10.3969/j.issn.1004-5708.2014.01.016
TS413
A
1004-5708(2014)01-0084-06
杨永霞(1980—),女,博士,讲师,研究方向为烟草生物技术,Tel:0371-63558121,Email:yyx624@126.com
刘国顺(1954—),男,教授,研究方向为烟草栽培与生理生化,Email:liugsh1851@163.com
河南省教育厅自然科学研究项目(No.2011B180025); 中国烟草总公司特色优质烟叶开发重大专项浓香型项目(No.110201101001).
2013-03-08

