铝板电絮凝去除水体中镍离子的研究
杨 波,李影影,张峰振,张 鸿,卓琼芳
1)深圳大学化学与化工学院,深圳518060;2)深圳大学物理科学与技术学院,深圳518060;3)环境保护部华南环境科学研究所,广州510655
电镀和线路板等行业在生产中排放含Ni2+等重金属的废水对环境水体存在严重危害[1].目前,去除废水中Ni2+的方法主要有化学絮凝法[2]、离子交换技术[3]、反渗透法[4]以及电絮凝法[5]等.其中,电絮凝法基本原理是通过电解过程中,铝或铁阳极溶出的Al3+、Fe2+与阴极电解水产生的OH-原位水解聚合,生成高活性的聚铝或聚铁絮凝剂,并在絮体表面 OH-的化学吸附作用下沉降或气浮[6],去除重金属离子等水体污染物.另外,重金属离子共沉淀[7]及其阴极还原[8]等反应也可辅助去除废水中重金属离子.该技术具有去除效率高、操作简单、成本低和无需外加试剂等优点[6,9].而近年来针对水体中除Ni2+的研究多采用加入水处理药剂的化学絮凝法[2,10],采用电絮凝法的报道较少,且缺少对相关影响因素作用机制的解析.为此,本研究以铝板作为电极,考察电流密度、溶液初始pH值、水体中常见的阳离子 (Ca2+或Mg2+)以及极板间距等主要因素,对电絮凝除Ni2+效率的影响及作用机制,为电絮凝技术净化重金属废水的实用化提供理论支持.
1 材料与方法
1.1 试剂和实验仪器
试剂.铝板为市售高纯板材(w(Al)≥99%);NiCl2·6H2O购自天津光复科技发展有限公司;Na2SO4购自广东光华化学厂有限公司;NaOH购自天津石英钟厂;丁二酮肟购自上海三爱思试剂有限公司;高铁试剂购自上海晶纯实业有限公司;无水醋酸钠购自天津石英钟厂霸州市化工分厂;镍离子标液购自国家有色金属及电子材料分析测试中心.上述试剂均为分析纯.
实验仪器.可见光分光光度计 (722S,上海分析仪器厂);pH计 (PHS-3C,上海雷磁公司生产);直流恒压恒流电源 (APS3003Si,深圳Atten公司生产);离心沉淀机 (80-1,新康医疗器械有限公司生产).
1.2 实验步骤
电絮凝实验在500 mL烧杯中进行,铝电极尺寸为45 mm×55 mm×3 mm,Ni2+初始质量浓度为183.0~232.9 mg/L(由3.04 g NiCl2·6H2O 溶于500 mL去离子水配制而成).电解过程采用恒电流模式,反应液由磁力搅拌器进行搅拌 (100 r/min),并定时每次取2 mL水样进行分析.水体初始pH值通过硫酸调节.实验装置如图1.

图1 电絮凝实验装置Fig.1 Diagram of experimental apparatus for electrocoagulation
1.3 分析方法
首先将水样离心10 min,取0.1 mL上清液于10 mL具塞比色管中,再依次加入2 mL 100 g/L NaOH水溶液和2 mL 10 g/L丁二酮肟水溶液,加去离子水定容至10 mL.静置1 h后通过分光光度法测定其光密度,并通过外标法进行定量.电絮凝效率用Ni2+去除率表示,相关数据为3次平行实验平均值.另外,溶解态铝絮体聚合度的检测使用Ferron 逐时络合光度法[11].
2 结果与讨论
2.1 电流密度的影响
电絮凝过程中阳极金属溶出速率及其后续金属离子水解聚合生成絮体的进度取决于电流密度,因此电解过程中电流密度的设置对电絮凝效率有重要影响.本实验用水为中性水体,pH值为7.0±0.2,支持电解质为0.186 mol/L的Na2SO4,极板间距1 cm,考察电流密度的影响.如图2所示,反应30 min后,电流密度从3.3 mA/cm2增至13.0 mA/cm2时,Ni2+去除率从59.8%迅速升至92.3%.这与铝絮体量随电流密度增加而加速生成有关.电解时Al3+溶出分别来自铝阳极电化学溶解和铝板在碱性下的化学溶解.增加电流密度,按法拉第定律(Q=zFξ)[1]可知,阳极溶出的 Al3+量在理论上也呈线性增加;而阴极析氢速率加快,见式(1),产生的OH-也可促进铝电极化学溶解,见式 (2)[12],从而提高了Al3+溶出速率,同时促进Al3+水解聚合生成铝絮体.因此,提高电流密度增加了铝絮体生成量,进而也提高了Ni2+的去除率.

图2 电流密度对电絮凝除Ni2+的影响(初始pH值为7.00,电解质为0.186 mol/L的Na2SO4)Fig.2 Effect of current density on electrocoagulation removal rate of Ni2+(initial pH=7.0,electrolyte using 0.186 mol/L Na2SO4)

然而,电流密度从13.0 mA/cm2增至26.0 mA/cm2时,反应30 min,Ni2+去除率仅从92.3%升至94.4%.究其原因可能是尽管铝絮体量较多,但由于阴极析氢过于剧烈,大量上浮的微气泡迅速将铝絮体带出水面,缩短了铝絮体与Ni2+有效接触时间,不利于Ni2+去除率进一步提高.Bayar等[13]指出,一定程度增加电流密度可显著提高电絮凝效率,但电流密度过高导致溶液气浮现象剧烈,反而不利于电絮凝效率的提升.因此,本研究电流密度设置为13 mA/cm2.
为解析上述电流密度对电絮凝效率的影响,考虑到絮体聚合度与絮凝效果的正相关性[11],而且铝絮体中高聚物的含量Alc(Ala表示聚铝的单聚物和初聚物;Alb表示聚铝的低聚物和中聚物;Alc表示聚铝的高聚物和溶胶[11])可直接反映其絮凝能力.本研究考察了电流密度对溶解态高聚物Alc含量的影响.如表1,电解60 min,电流密度从3.3 mA/cm2增至26.0 mA/cm2时,Alc质量分数仅从75.0%升至79.8%.这表明增加电流密度虽然提高Al3+溶出速率和OH-生成速率,促进铝絮体水解和聚合,但溶液中实际的Alc质量分数因阴极析氢产生大量微气泡将絮体从体相中带出水面而难以持续增加,而且电流密度越大,这种气浮效应越强,致使水中溶解态铝絮体量变化不大,聚合度较高的铝絮体生成比率也未显著上升,因此增加电流密度过多时,除Ni2+率并未显著增大.
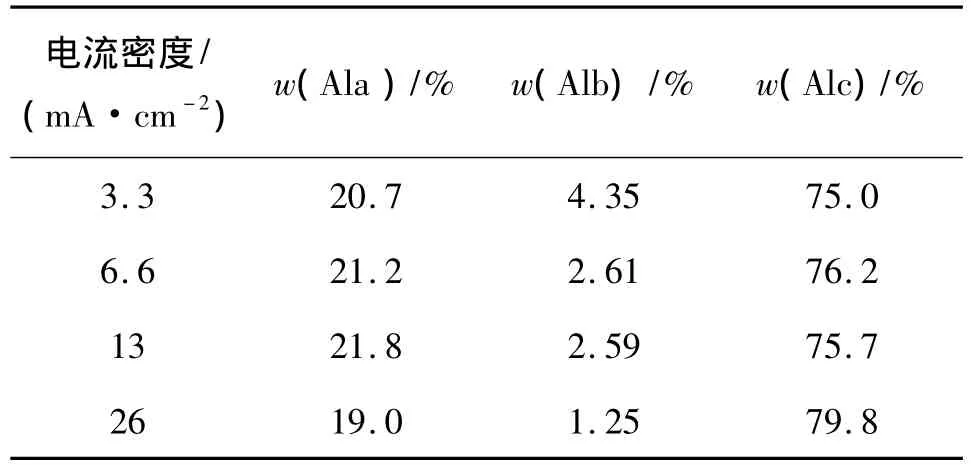
表1 不同电流密度下溶解态铝絮体的聚合度Table 1 Degree of polymerization of dissolved aluminum floc(DAF)with different current densities
2.2 pH值的影响
电絮凝效率除受电流密度影响外,还与溶液pH值有关.本实验电流密度为13.0 mA/cm2,其他条件同2.1节,考察初始pH值的影响,因初始pH值大于8.00时,会有Ni(OH)2沉淀生成,为探究电絮凝的净作用,本研究考察的pH值范围为1.00~8.00.如图3,Ni2+去除率随初始pH值增加而增大.反应30 min后,溶液初始pH值从1.35增至2.06时,Ni2+去除率从35.1%升至54.5%.当pH值大于3.00时,Ni2+去除率显著提高,反应30 min后,溶液初始pH值从4.13增至7.83时,Ni2+去除率从90.4%升至98.5%.这可能与废水pH值影响铝絮体形态有关.在电解过程中,铝阳极和阴极反应分别如式(3)和式(4),生成的Al3+与OH-结合,原位生成一系列单核络合物 (如Al(OH)2+等)和多核络合物 (如Al6(OH)153+和Al13O4(OH)247+等),并通过复杂的固化反应最终转变为Al(OH)3(固体)[12],如式(5).因此,pH值较高有利于铝絮体的生成,并通过絮体对Ni2+的吸附[6]以及共沉淀[7]作用实现对 Ni2+的高效去除.但pH值过高,到较强碱性时,会使铝絮体溶解[14],见式(6),降低其絮凝活性,不利于提高电絮凝效率.另一方面,当pH值过低时铝絮体容易转化为溶解态的 Al3+[12,15],也会明显降低铝絮体絮凝活性.因此,在中性或弱碱性条件下,Al3+水解并聚合成高絮凝活性多核羟基铝絮凝体的效率高,对应的Ni2+去除率也较高.

图3 初始pH值对电絮凝除Ni2+的影响(电流密度为13.0 mA/cm2,电解质为0.186 mol/L Na2SO4)Fig.3 Effect of initial pH on electrocoagulation removal rate of Ni2+(current density is 13.0 mA/cm2,electrolyte is 0.186 mol/L Na2SO4)

2.3 常见阳离子的影响
针对废水中常见的Ca2+和Mg2+,本研究考察其对电絮凝除Ni2+的影响,电流密度为13.0 mA/cm2,Ca2+和Mg2+浓度分别为1.5 mmol/L(该浓度参照西江水系硬度指标确定[16])和9.3 mmol/L,其他条件同2.1节.如图4,反应60 min,Ca2+初始浓度从1.5 mmol/L增至9.3 mmol/L时,Ni2+去除率从78.0%迅速降至31.2%,而空白试验 (含3 mmol/L NaCl水体)的Ni2+去除率为80.0%.Ca2+的负效应可能是其易吸附于铝絮体表面[17]并占据絮体活性位点,阻碍絮体吸附Ni2+.另外,实验还发现电解后阴极附着一层明显的白色粉末,并导致阴极钝化.由于1.5 mmol/L和9.3 mmol/L Ca2+对应生成Ca(OH)2(Ksp=5.5×10-6,25℃)的pH值分别为12.78和12.38,而本实验电解60 min后水体pH<6.40,因此,该白色粉末不是Ca(OH)2.Kruthika等[18]研究表明,采用铝板电絮凝处理含Ca2+废水时,铝阴极表面会附着白色粉末从而降低电絮凝效率,并认为粉末为CaCl2.文献[9]研究表明,在HCO-3存在条件下,Ca2+更易形成CaCO3(Ksp=2.8×10-9,25℃),其机制如式(7)至式(9).无论生成何种物质,Ca2+都会导致阴极钝化从而逐渐降低电絮凝除 Ni2+效率,而本研究在Ca2+存在下阴极附着物的成分有待深入分析.

图4 Ca2+、Mg2+对电絮凝除Ni2+的影响(电流密度为13.0 mA/cm2)Fig.4 Effect of Ca2+or Mg2+on electrocoagulation removal rate of Ni2+(current density is 13.0 mA/cm2)

从图4还可看出,与空白相比,Mg2+浓度较低时对Ni2+的去除有促进作用,而其浓度偏高时不利于除Ni2+.反应60 min后,Mg2+初始浓度从1.5 mmol/L增至9.3 mmol/L时,Ni2+去除率从87.7%降至71.7%.通常,MgCl2可与Al(OH)3形成具有絮凝功效的层状双金属氢氧化物[17](,其中,M2+代表 Mg2+;M3+代表 Al3+;A-代表 Cl-),从而显著提高了Ni2+去除率.但Mg2+浓度过高时,本实验的阴极表面也会附着一层透明浅绿色粉末,从而降低其电解效率.理论上该粉末可能是Mg(OH)2吸附Ni2+后沉淀于阴极表面所产生的,但1.5 mmol/L和9.3 mmol/L Mg2+对应生成 Mg(OH)2(Ksp=5.61×10-12,25℃)的pH值分别为9.78和9.39,由于本实验电解60 min后水体pH<6.40,则在水体中Mg(OH)2不会形成沉淀.然而电解时阴极与水的固液界面pH值远高于体相中的pH值[19],因此,在近阴极区Mg2+也可能会以Mg(OH)2的形式在阴极表面沉淀[20-21],钝化阴极,从而降低电絮凝效率.
为进一步明确Ca2+和Mg2+对电絮凝的影响,本实验监测了电絮凝过程中水体pH值的变化,而pH值的改变主要取决于阴极电解水产生的OH-和阳极溶出Al3+的水解[12].检测结果表明,电解60 min后,在1.5 mmol/L和9.3 mmol/L Mg2+、1.5 mmol/L和9.3 mmol/L Ca2+条件下,pH值由初始6.40左右分别降至4.05、3.99、3.97和3.22.这些pH值的下降可能是Ca2+和Mg2+以不同化合物形式沉淀于阴极表面[18,20-21],钝化了阴极,从而降低其电解效率,导致OH-生成减缓所致.而且由于Al3+的水解聚合消耗了OH-,使水体pH值显著降低,从2.2节可知,pH值过低会降低絮体絮凝活性,不利于电絮凝效率的提高.由此,通过对上述pH值变化的解析,也进一步阐明了Ca2+和Mg2+对电絮凝的抑制机制.
2.4 极板间距的影响
本研究还考察了电解工艺条件中极板间距对铝板电絮凝除Ni2+的影响.电絮凝条件同2.1节.实验结果如图5,其中,ρ0为Ni2+的初始质量浓度;ρ为反应中Ni2+的质量浓度.由图5可见,极板间距d并不能有效影响铝板电絮凝除Ni2+效率.反应30 min后,Ni2+去除率从极板间距0.5 cm时的76.7%升至极板间距1.0 cm时的84.5%,继续增加极板间距至3.0 cm时,Ni2+去除率略微上升,至88.7%.反应时间延长至60 min后,Ni2+去除率均超过99.0%.通常极板间距过小时,能耗会相对较低,但Al3+聚合、水解成的絮团易在两极板间堵塞,阻碍铝絮体向水中扩散.适当增加极板间距,可降低铝絮体在极板间堵塞的可能性,有助于铝絮体向水中扩散.但极板间距过大,两极板间所施加电压相应增加,除能耗相应增加外,阳极由于极化电势升高更易于钝化.Merzouk等[22]对极板间距对铝板电絮凝影响的研究结果也表明,极板间距在很大程度上影响电絮凝能耗,但不能显著改变其去除效果.本实验电解过程中,极板间距对铝板电絮凝除Ni2+效率的影响很小,这可能是系统中絮体的有效形成尺寸和絮体吸附Ni2+的传质沉降过程受极板间距大小的影响不明显所致.

图5 极板间距对铝板电絮凝除Ni2+的影响Fig.5 Effect of plate spacing of Al electrode on electrocoagulation removal rate of Ni2+
结 语
本实验采用铝板阳极电絮凝工艺处理电镀和线路板行业常见的含Ni2+废水,研究电流密度、溶液初始pH值以及Ca2+、Mg2+和极板间距等主要因素对Ni2+去除率的影响.在电流密度为13 mA/cm2、pH值为中性或弱碱性条件下,实现Ni2+的有效去除,电解60 min后Ni2+去除率超过99%.但水体中存在Ca2+及高浓度Mg2+时,由于其钝化铝阴极,因而会显著抑制电絮凝对Ni2+的去除率.另外,研究发现电极极板间距对电絮凝效率的影响较小.
/References:
[1] Heidmann I,Calmano W.Removal of Zn(II),Cu(II),Ni(II),Ag(I)and Cr(VI)present in aqueous solutions by aluminum electrocoagulation [J].Journal of Hazardous Materials,2008,152(3):934-941.
[2] Guo Lin,Zha Hongping,Liao Xiaogang,et al.Removing nickel from electroplating wastewater by chemical precipitation [J].Environmental Engineering,2011,29(4):50-53.(in Chinese)郭 琳,查红平,廖小刚,等.化学沉淀法处理线路板厂含镍废水 [J].环境工程,2011,29(4):50-53.
[3] Franco P E,Veit M T,Borba C E,et al.Nickel(II)and zinc(II)removal using Amberlite IR-120 resin:ion exchange equilibrium and kinetics[J].Chemical Engineering Journal,2013,221:426-435.
[4] Mohsen-Nia M,Montazeri P,Modarress H.Removal of Cu2+and Ni2+from wastewater with a chelating agent and reverse osmosis processes[J].Desalination,2007,217(1/2/3):276-281.
[5] Heidmann I,Calmano W.Removal of Ni,Cu and Cr from a galvanic wastewater in an electrocoagulation system with Fe-and Al-electrodes[J].Separation and Purification Technology,2010,71(3):308-314.
[6] Qu Jiuhui,Liu Huijuan.Electrochemical principles and techniques of water treatment[M].Beijing:Science Press,2007:205-225.(in Chinese)曲久辉,刘慧娟.水处理电化学原理与技术 [M].北京:科学出版社,2007:205-225.
[7] Hanay O,Hasar H.Effect of anions on removing Cu2+,Mn2+and Zn2+in electrocoagulation process using aluminum electrodes [J].Journal of Hazardous Materials,2011,189(1/2):572-576.
[8] Malpass G R P,Kalaji M,Venancio E C,et al.Electrodeposition of nickel on carbon felt[J].Electrochimica Acta,2004,49(27):4933-4938.
[9] Ferreira A de M,Marchesiello M,Thivel P X.Removal of copper,zinc and nickel present in natural water containing Ca2+and HCO3-ions by electrocoagulation [J].Separation and Purification Technology, 2013, 107:109-117.
[10] Liu Cunhai,Han Liping,Lai Xiaojuan.Flocculation treatment for chromium-nickel mixed electroplating wastewater[J].Plating and Finishing,2012,34(9):39-43.(in Chinese)刘存海,韩利萍,赖小娟.电镀铬镍混合废水的絮凝处理 [J].电镀与精饰,2012,34(9):39-43.
[11] Tang Hongxiao.Theory of inorganic polymer flocculant and flocculants[M].Beijing:China Building Industry Press,2006:73-89.(in Chinese)汤鸿霄.无机高分子絮凝理论与絮凝剂[M].北京:中国建筑工业出版社,2006:73-89.
[12] Zhang Fengzhen, Yang Bo, Zhang Hong, etal.Wastewater treatment using electrocoagulation technology:a review [J].Industrial Water Treatment,2012,32(12):11-16.(in Chinese)张峰振,杨 波,张 鸿,等.电絮凝法进行废水处理的研究进展 [J].工业水处理,2012,32(12):11-16.
[13] Bayar S,Yildiz Y S,Yilmaz A E,et al.The effect of stirring speed and current density on removal efficiency of poultry slaughterhouse wastewater by electrocoagulation method [J].Desalination,2011,280(1/2/3):103-107.
[14] Jimenez C,Saez C,Martinez F,et al.Electrochemical dosing of iron and aluminum in continuous processes:a key step to explain electro-coagulation processes[J].Separation and Purification Technology,2012,98:102-108.
[15] Can O T,Bayramoglu M.The effect of process conditions on the treatment of benzoquinone solution by electrocoagulation [J].Journal of Hazardous Materials,2010,173(1/2/3):731-736.
[16] Huang Tieming,Ling Min.Watershed distribution and characteristics of water quality for urban water-supply source in Guangxi Xijiang river system [J].City and Town Water Supply,2010(4):77-80.(in Chinese)黄铁明,凌 敏.广西西江水系城市供水水源的流域分布与水质特征[J].城镇供水,2010(4):77-80.
[17] Zhao H Z,Zhao B,Yang W,et al.Effects of Ca2+and Mg2+on defluoridation in the electrocoagulation process[J].Environmental Science & Technology,2010,44(23):9112-9116.
[18] Kruthika N L,Karthika S,Raju G B,et al.Efficacy of electrocoagulation and electrooxidation for the purification of wastewater generated from gelatin production plant[J].Journal of Environmental Chemical Engineering,2013,1(3):183-188.
[19] Moreno C H A,Cocke D L,Gomes J A G,et al.Electrochemical reactions for electrocoagulation using iron electrodes[J].Industrial Engineering Chemistry Research,2009,48(4):2275-2282.
[20] Hug A,Udert K M.Struvite precipitation from urine with electrochemical magnesium dosage[J].Water Research,2013,47(1):289-299.
[21] Lei T,Ouyang C,Tang W,et al.Enhanced corrosion protection of MgO coatings on magnesium alloy deposited by an anodic electrodeposition process[J].Corrosion Science,2010,52(10):3504-3508.
[22] Merzouk B,Madani K,Sekki A.Using electrocoagulation-electroflotation technology to treat synthetic solution and textile wastewater,two case studies [J].Desalination,2010,250(2):573-577.

