电针对膝骨关节炎MIA模型大鼠滑膜组织中MMP-3/TIMP-1表达的影响*
刘苗苗,韦 芳,潘超安,杨 洋,徐斯伟,周俊梅,张必萌△
(1.上海交通大学附属第一人民医院,上海201620;2.上海市松江乐都医院,上海201620)
膝骨关节炎(Knee Osteoarthritis)是目前世界上最常见的关节退行性病变,每年都会影响百万人的生活质量。这种疾病不仅影响了近10%的老年人的生活,同时也使得很多年轻人饱受其害[1]。目前的研究表明膝骨关节炎是多种因素引起的关节软骨退行性病变[2],主要病理变化为关节腔变窄、透明软骨缺失、软骨下硬化、关节边缘骨赘增生等。也有研究发现膝骨关节炎的主要病理变化为滑膜纤维化以及关节腔液成分的改变[3]。尽管膝骨关节炎发生的具体机制还不明确,但是可以肯定的是引起此病变的机制不止一种,越来越多的证据表明滑膜病变在膝骨关节炎的病理进程中有重要地位[4]。膝骨关节炎在临床上的主要表现为关节的疼痛、肿胀、僵硬以及活动受限,严重影响患者的生活质量[5-6]。膝骨关节炎的治疗主要集中在相关症状的改善上,目前临床上常用的非甾体抗炎药,长期服用可产生不同程度的胃肠道不适等副作用[7],因此寻求一种安全有效的疗法一直是国内外医学界所关注的重点,近年来的资料显示:针灸疗法是治疗膝骨关节炎有效方式之一[6-8]。研究表明:针灸在缓解患者膝关节炎引起的疼痛、肿胀等方面有显著疗效,但对其起效的具体机制尚未明确[9]。
本实验旨在通过建立动物实验模型,观察电针治疗膝骨关节炎MIA模型大鼠过程中滑膜组织中的基质金属蛋白酶-3(MMP-3)和基质金属蛋白酶抑制剂-1(TIMP-1)表达的变化,研究电针对MMP-3和TIMP-1的调控机制,为电针治疗膝骨关节炎的可能作用机制提供实验依据。
1 材料
1.1 实验动物
由上海交通大学附属第一人民医院动物实验中心提供的清洁级健康3月龄SD雄性大鼠40只,体重在(280±20)g。实验动物由本医院实验动物中心负责饲养。实验过程中对动物的处置符合科学技术部发布的《关于善待实验动物的指导性意见》[10]以及上海交通大学伦理委员会对于善待动物的相关规定。
1.2 主要试剂及仪器
一次性 1.5寸华佗牌无菌针灸毫针 0.35×40 mm,苏食药监械(准)字2008第227 0626号,中国苏州医疗用品厂有限公司;华佗牌电子针疗仪SDZII型,苏食药监械(准)字2009第2270366号,中国苏州医疗用品厂有限公司;塞来昔布胶囊(商品名:西乐葆,国药准字J20080059+H20110474):美国辉瑞制药有限公司;碘乙酸钠(MIA):Sigma,美国;Trizol试剂:Sigma,美国;兔抗 MMP-3、TIMP-1多克隆抗体:上海浩朗生物科技有限公司;数码相机:尼康,日本。其它涉及的试剂及仪器均由上海交通大学附属第一人民医院实验中心提供。
2 实验方法
2.1 设计
随机对照动物实验。
2.2 实验分组
将40只雄性大鼠称重后按随机数字表法随机分成4组,即正常组、模型组、药物组和电针组,每组各10只。
2.3 建立动物模型
将SD大鼠置于清洁级环境中,每2只一笼,采用Guingamp C的经典MIA造模方法制备大鼠膝骨关节炎 MIA 模型[11],将0.3 mg单体碘乙酸钠(MIA)溶液注入大鼠左侧膝骨关节腔内,并配合持续的抽屉样关节运动。具体操作步骤为:将3 mg MIA溶入到50 μl 9%的生理盐水中,清理关节附近的鼠毛,将关节屈曲到最大限度后于左膝关节腔注入配置好的溶液,于右膝处注入同等剂量的生理盐水,正常组用同样的方法于两膝注入50 μl 9%生理盐水。40只老鼠每天同时做相同的驱赶运动约30 min。
2.4 干预
实验两周后,分别对各组进行干预。正常组:给予正常饮食,其它不作特殊处理。造模组:造模后给予正常饮食,不作任何治疗。电针组:穴位常规消毒后用直径0.35 mm、长40 mm的华佗牌针灸针进行针刺“后三里”穴、“阳陵泉”穴[12-20]。得气后接通电针治疗仪,采用疏密波形,频率1~4 Hz,输出强度为1~3 mA,持续20 min,以局部肌肉轻微抖动为度。每日1次,连续治疗14天。药物组:将塞来昔布溶入到10%的二甲基亚砜(DMSO)中,按照人与动物体重换算公式 Meeh -Rubner折合成大鼠量[11,19-20],给予每只大鼠3 mg·(kg-1·2ml-1)灌胃量,每天灌药 1 次,连续给药14天。
Meeh-Rubner换算公式:A=K·W2/3/10 000。
注:A代表体表面积,K代表系数,W代表体重(g)。
2.5 标本的采集与保存
于实验第4周采用颈椎脱臼法处死全部大鼠,将大鼠固定于固定板上,伸直关节,切开皮肤,将整个关节取下摄像保存并作大体观察。切开皮下组织、深筋膜、切断内外侧副韧带,显露出整个膝关节面,肉眼观察膝关节面、关节软骨以及滑膜变化并摄像保存。将膝关节置于冰上,用锐利刀片取膝关节正中部分的滑膜组织约50 mg,去除周围的脂肪组织,剪碎分装置于1.5 ml的离心管中,加入 Trizol试剂0.5 ml手动匀浆器搅碎组织,于4℃下1000 g离心20 min,提取上清液置于4℃下保存备用。
2.6 标本检测
双抗体夹心elisa法检测各组MMP-3和TIMP-1的含量。参考试剂盒说明书配置所需溶液,并配置标准品梯度:MMP -3:2000,1000,500,250,125,62.5,31.2 pg/ml;TIMP -1:800,400,200,100,50,25,12.5 pg/ml。在空白孔、标准孔和样品孔分别加入50 μl ASSAY稀释液,然后在空白孔、标准孔和样品孔分别加入50 μl样本稀释液、标准品和样本;室温孵育2 h;用洗液冲洗4次;每孔加入100 μl酶结合物工作液;室温孵育2 h;用洗液冲洗4次;每孔加入100 μl显色底物;避光室温孵育30 min;每孔加入100 μl终止液;混匀,用酶标仪在450 nm处测吸光值;绘制标准曲线:以标准品浓度对数为横坐标,以测得的OD值为纵坐标,绘制标准曲线;根据OD值计算各个指标含量。
注:各滑膜组织中的MMP-3和TIMP-1浓度用μg/g蛋白来表示。
2.7 统计学分析
3 实验结果
在本实验整个操作过程中未对大鼠造成明显创伤,故实验中无大鼠的脱落,40只大鼠全部纳入结果分析。
3.1 动物观察
模型组大鼠在关节腔注入MIA后3天左右发病,以左侧关节肿胀、活动受限为主,随着时间的增加关节肿胀持续加重,部分肿胀关节局部皮肤充血、发亮、增厚,左侧肢体出现跛行,触摸其左侧关节老鼠会有明显的躲避行为,大鼠整个状态表现为倦怠,进食减少,体重约在14天左右开始明显下降。药物治疗组跟针灸组大鼠的症状在14天干预治疗后明显改善,而造模组则持续加重。正常组体重增长正常,毛发光滑,活动自如。
3.2 关节及关节软骨肉眼观察
关节及关节软骨肉眼观察见表1及图1。

表1 SD大鼠离体关节大体观
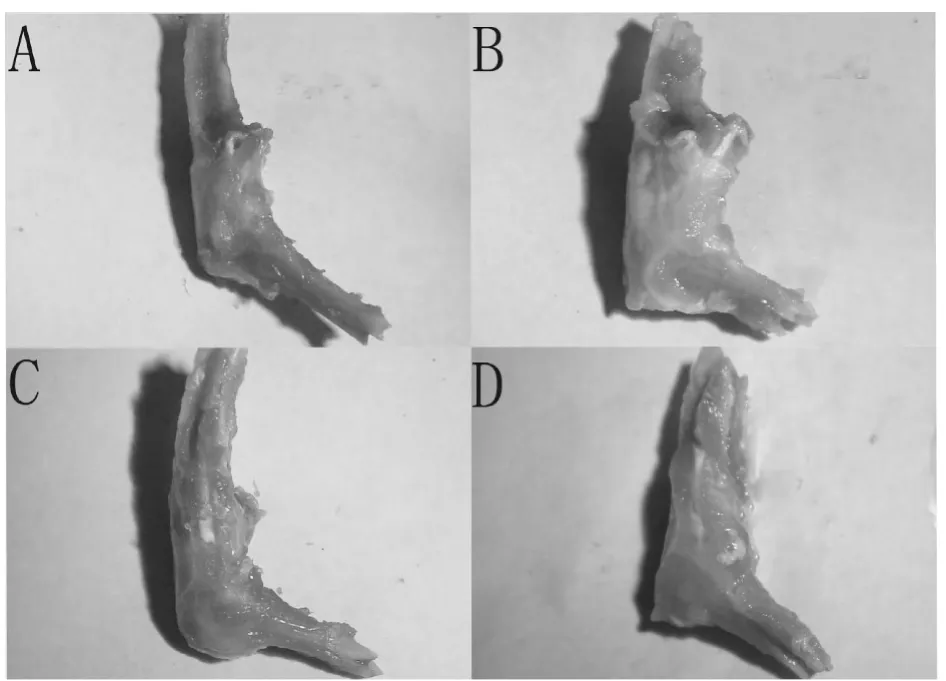
图1 SD大鼠离体关节大体观
3.3 4组大鼠滑膜组织中MMP-3和TIMP-1蛋白表达水平比较
模型组、药物组、电针组各组 MMP-3、TIMP-1蛋白水平相对表达量均较正常组显著提高,差异有统计学意义(P<0.05),但在模型组中两个指标变化并不同步,MMP-3比TIMP-1表达量增加得多;模型组、药物组、电针组各组之间两两比较,药物组和电针组中MMP-3和TIMP-1的相对表达量明显降低,具有统计学意义(P<0.05),可见药物组和电针组对膝骨关节炎 MIA模型大鼠滑膜组织中 MMP-3和TIMP-1均有明显下调作用,但是药物组和电针组之间MMP-3和TIMP-1两个指标的表达均无显著性差异(P >0.05)。见表2。
表2 各组MMP-3/TIMP在滑膜组织中的表达量(±s,μg/g)

表2 各组MMP-3/TIMP在滑膜组织中的表达量(±s,μg/g)
组别 n MMP-3 TIMP-1正常组10 11.91 ±0.31 10.52 ±0.40模型组 10 32.45 ±0.45 13.34 ±0.52药物组 10 12.37 ±0.67 10.83 ±0.61电针组10 11.90 ±1.24 10.81 ±1.08
4 讨论
以往的实验研究表明大鼠在发育期雌性较雄性骨量变化有明显差异[21],而且雌性大鼠有明显的生理周期[22],为了避免自身生理因素给实验带来的影响,本研究选用雄性大鼠作为实验动物。
膝骨关节炎实验动物模型的制备方法很多[23-24],本研究采用的是向单侧膝关节腔内注射单体碘乙酸钠(MIA)的方法进行造模。研究表明[10,25]:单体碘乙酸钠是一种糖酵解抑制剂,将其注入大鼠单侧膝关节内能够在较短时间内诱发大鼠形成类似于人体的膝骨关节炎病理状态。造模后两周即可出现软骨表面的凹陷以及裂隙、整个关节增粗等病理表现,造模4周后即可出现滑膜纤维化以及关节软骨的进一步裂变,并伴随骨赘形成。本研究在造模两周后介入干预措施,可以有效观察干预措施对此病理状态的改变和影响。
大量国内外临床研究表明,电针在治疗膝骨关节炎方面有其独特优势,能够有效缓解膝骨关节炎引起的疼痛、关节僵硬以及功能性障碍[26]。临床上,针灸治疗膝骨关节炎多以局部疏通经脉、调理气血为主,电针局部“足三里”穴、“阳陵泉”穴可以有效改善膝关节局部的血液循环,减轻滑膜炎症,起到防卫免疫、抗病镇痛的作用,有利于关节炎的恢复[27]。因此,本研究参照《实验针灸学》等,选取大鼠膝关节处,与人类膝关节“足三里”穴、“阳陵泉”穴相对应的“后三里”穴、“阳陵泉”穴进行电针治疗。此外,相对于传统针灸治疗的方式,针刺后连通电针仪进行电针治疗,可以准确掌握刺激参数,量化刺激强度。
基质金属蛋白酶(MMPs)是一类存在于软骨细胞外的蛋白水解酶家族,可以降解细胞外基质的大多数蛋白质。MMP-3是MMPs家族的主要成员之一,它不仅可以降解细胞外基质膜成分,而且能分泌大量的细胞外分子[28],在成纤维细胞的增生中起着重要的媒介作用[29]。TIMPs是一种内源性的、分布广泛的低分子生理性抑制剂,由滑膜及软骨细胞合成,能够与MMPs以共价键形式结合成1:1的复合物,从而抑制绝大多数的MMPs[30]。研究表明,MMP-3和 TIMP-1能够相互结合和制约,是参与膝骨关节炎病程发展的重要物质[31]。在膝骨关节炎患者的滑膜和软骨组织中,MMP-3和 TIMP-1的表达均显著增加,但TIMP-1增加的程度相对较小,打破了MMP-3和TIMP-1之间原本的平衡[32],这种失衡状态造成膝关节软骨外基质降解,使得膝关节出现一系列退变表现。在本研究中,正常组、电针组和药物组大鼠滑膜组织中亦存在少量MMP-3和TIMP-1且基本保持平衡,意味着可能正是这种动态平衡保证了软骨细胞正常的代谢水平,而在模型组MMP-3有明显的高表达,随之TIMP-1的表达也升高,但是两者的表达并不同步,使得MMP-3和TIMP-1的平衡遭到破坏,与文献报道一致,虽然这与之前的另外一篇文献报道[18]中MMP-3和TIMP-1的变化趋势稍有差异,恰好说明了这种平衡可能并非静止状态,而是处在一个动态变化中,电针所起的作用可能正好纠正了两者之间的不平衡,使两者归于平衡状态。
本实验采用分子生物学方法对电针治疗大鼠膝骨关节炎MIA模型进行了研究,并对电针疗法的可能作用机制进行探讨,证明了针灸能够有效纠正MMP-3和TIMP-1在滑膜组织中的异常表达,从而发挥治疗作用,为针灸治疗膝骨关节炎提供了可靠的实验证据。
注:感谢美国雅培公司的Steve McGaraughty博士对本研究造模部分提供的指导与支持。
[1]Dieppe PA,Lohmander LS.Pathogenesis and management of pain in osteoarthritis[J].The Lancet,2005,365(9463):965 -973
[2]Blom AB,van Lent PL,Libregts S,et al.Crucial role of macrophages in matrix metalloproteinase-mediated cartilage destruction during experimental osteoarthritis:involvement of matrix metalloproteinase 3[J].Arthritis & Rheumatism,2007,56(1):147 -157
[3]Leydet- Quilici H,Le Corroller T,Bouvier C,et al.Advanced hip osteoarthritis:magneticresonance imaging aspects and histopathology correlations[J].Osteoarthritis and Cartilage,2010,18(11):1429 -1435
[4]Benito MJ,Veale DJ,FitzGerald O,et al.Synovial tissue inflammation in early and late osteoarthritis[J].Annals of the rheumatic diseases,2005,64(9):1263 -1267
[5]Hayashi M,Muneta T,Takahashi T,et al.Intra - articular injections of bone morphogenetic protein-7 retard progression of existing cartilage degeneration[J].Journal of Orthopaedic Research,2010,28(11):1502-1506
[6]Selfe TK,Taylor AG.Acupuncture and osteoarthritis of the knee:a review of randomized,controlled trials[J].Family & community health,2008,31(3):247
[7]许传勇,宋朋飞,阚卫兵,等.塞来昔布胶囊对大鼠膝骨性关节炎滑膜细胞β-catenin和基质金属蛋白酶-7的影响[J].广东医学,2013,34(5):678
[8]Ahsin S,Saleem S,Bhatti AM,et al.Clinical and endocrinological changes after electro-acupuncture treatment in patients with osteoarthritis of the knee[J].Pain,2009,147(1):60 -66
[9]Scoto GM,Aricò G,Iemolo A,et al.Involvement of the Nociceptin/Orphanin FQ-NOP receptorsystem in the ventrolateral periaqueductal gray following mechanical allodynia in chronic pain[J].Life sciences,2009,85(5):206 -210
[10]中华人民共和国科学技术部.关于善待实验动物的指导性意见[EB/OL].[2011 -07 -09].
[11]Guingamp C,Gegout-Pottie P,Philippe L,et al.Mono-iodoacetate-induced experimental osteoarthritis.A dose-response study of loss of mobility,morphology,and biochemistry[J].Arthritis &Rheumatism,1997,40(9):1670 -1679
[12]Spiers DE,Candas V.Relationship of skin surface area to body mass in the immature rat:a reexamination[J].Journal of Applied Physiology,1984,56(1):240 -243
[13]黄剑,卓廉士,王永渝,等.电针对膝骨性关节炎家兔模型白介素-1β和肿瘤坏死因子 -α 的影响[J].针刺研究,2007,32(2):115-118
[14]Huang J,Zhuo LS,Wang YY,et al.Effects of electroacupuncture on synovia free radicals in rabbits with knee osteoarthritis[J].Acupuncture research,2008,33(2):116
[15]李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:327
[16]于船.中国兽医针灸学[M].北京:农业出版社,1984:212
[17]华兴邦,周浩良.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5
[18]包飞,孙华,吴志宏,等.针刺对膝骨关节炎大鼠软骨基质金属蛋白酶及其抑制剂表达的影响[J].中国针灸,2011,31(3):241-246
[19]Moon SJ,Park JS,Jeong JH,et al.Augmented chondroprotective effect of coadministration of celecoxib and rebamipide in the monosodium iodoacetate rat model of osteoarthritis[J].Archives of pharmacal research,2013,36(1):116 -124
[20]Mi WL,Mao-Ying QL,Liu Q,et al.Synergistic anti-hyperalgesia of electroacupuncture and low dose of celecoxib in monoarthritic rats:involvement of the cyclooxygenase activity in the spinal cord[J].Brain research bulletin,2008,77(2):98 -104
[21]高建军,周轶,顾淑珠,等.大鼠骨生物学指标的月龄特征[J].中国骨质疏松杂志,2004,10(2):143-146
[22]洪波.生理周期及致痫后雌性大鼠海马细胞色素P450芳香化酶的动态表达[D].上海:复旦大学,2009
[23]陈百成,张静.骨关节炎[M].北京:人民卫生出版社,2004
[24]黄振,查和萍,范志勇,等.膝骨关节炎的模型构建及针灸干预实验研究进展[J].中医外治杂志,2012,21(4):54 -55
[25]Guzman RE,Evans MG,Bove S,et al.Mono-iodoacetate-induced histologic changes in subchondral bone and articular cartilage of rat femorotibial joints:an animal model of osteoarthritis[J].Toxicologic pathology,2003,31(6):619 -624
[26]Ahsin S,Saleem S,Bhatti AM,et al.Clinical and endocrinological changes after electro-acupuncture treatment in patients with osteoarthritis of the knee[J].Pain,2009,147(1):60 - 66
[27]熊勇,彭锐,夏数数.兔膝骨性关节炎关节液中白细胞介素1β和肿瘤坏死因子α表达与艾灸的影响[J].中国组织工程研究与临床康复,2010,14(41):7700 -7703
[28]Lijnen HR.Matrix metalloproteinases and cellular fibrinolytic activity[J].Biochemistry(Moscow),2002,67(1):92 -98
[29]Tolboom TCA,Pieterman E,Vander Laan WH,et al.Invasive properties of fibroblast-like synoviocytes:correlation with growth characteristics and expression of MMP-1,MMP-3,and MMP-10[J].Annals of the rheumatic diseases,2002,61(11):975 -980
[30]李卫平,蹇睿,胥方元.基质金属蛋白酶及其抑制物与骨性关节炎[J].西南军医,2010,12(6):1165 -1167
[31]Fukui N,Zhu Y,Maloney WJ.Stimulation of BMP -2 expression by pro-inflammatory cytokines IL-1 and TNF-alpha in normal and osteoarthritic chondrocytes[J].The Journal of Bone & Joint Surgery,2003,85(suppl_3):59 -66
[32]Hegemann N,Wondimu A,Ullrich K,et al.Synovial MMP-3 and TIMP-1 levels and their correlation with cytokine expression in canine rheumatoid arthritis[J].Veterinary immunology and immunopathology,2003,91(3):199 -204

