基于28S rRNA 基因的PCR-RFLP 分析对赤拟谷盗与杂拟谷盗进行分子鉴定
张汉松,冯照军,程 超
(江苏师范大学生命科学学院,江苏徐州 221116)
赤拟谷盗Tribolium castaneum (Herbst)和杂拟谷盗Tribolium confusum (Jac du Val)均隶属于鞘翅目Coleoptera、拟步行虫科Tenebrionidae、拟谷盗属Tribolium,是两种重要的世界性储粮害虫,其成虫和幼虫除直接为害面粉、麸皮、米糠、禾谷类籽实等外,成虫体表的臭腺还可分泌含苯醌等致癌物质的臭液,使被害物结块、变色、发臭而不能食用(Campbell et al.,2004)。目前,化学杀虫剂是防治赤拟谷盗和杂拟谷盗的重要手段,研究表明赤拟谷盗和杂拟谷盗在未成熟期(卵、幼虫和蛹)比其在成熟期(成虫)对杀虫剂敏感,且赤拟谷盗比杂拟谷盗对杀虫剂敏感(Authur and Hoernemann,2004;Authur et al.,2009)。为提高化学防治效果并减少杀虫剂的使用,对储粮工作者来说应在赤拟谷盗和杂拟谷盗的未成熟期进行形态学鉴定,但是赤拟谷盗和杂拟谷盗为近缘种甲虫,其卵、幼虫和蛹外部形态和大小相同、不能区分,其成虫外部形态和大小相似、很难区分(沈兆鹏,1998)。另外,在我国检疫口岸,赤拟谷盗与杂拟谷盗也是一类常有截获的甲虫,它们大多处于幼虫和蛹阶段,需要等其羽化为成虫后才能进行形态学鉴定,但是检疫的工作性质要求快检快放,这为检疫工作带来了不便(张生芳和周玉香,2002)。因此,对储粮工作者和口岸检疫人员来说,有必要建立一种经济、快速、准确的分子方法来鉴别赤拟谷盗与杂拟谷盗。
随着分子生物学技术的发展和应用,用于物种分子鉴定的方法较多,如随机扩增多态性(RAPD)、扩增片段长度多态性(AFLP)、限制性片段长度多态性 (RFLP)、微卫星 DNA(Microsatellite DNA)、聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)等,其中PCR-RFLP 是PCR 扩增与传统RFLP 技术的结合,是一种较为容易和可靠的方法(Arimoto et al.,2013)。真核生物细胞核基因组中28S 核糖体RNA (28S ribosomal RNA,28S rRNA)基因高度保守、易于进行PCR 扩增,同时28S rRNA 基因来源于核DNA,避免了线粒体DNA 由于母性遗传对分支分析造成的影响,常用于进行属内不同种之间的遗传分化、系统发育分析和分子鉴定(Cepeda et al.,2012)。本研究拟对赤拟谷盗和杂拟谷盗的28S rRNA 基因片段进行PCR 扩增、序列测定和分析,试图找到其种特异性限制性内切酶并建立对它们进行种间分子鉴定的PCR-RFLP 分析方法,以期为仓储害虫管理和口岸检疫工作提供技术帮助和支持。
1 材料与方法
1.1 供试甲虫
赤拟谷盗与杂拟谷盗成虫采自江苏省徐州市铜山区三堡面粉厂,带回实验室在体视显微镜下按其形态学特征 (Bousquet,1990;沈兆鹏,1998)进行虫种鉴定,并根据其生殖器和第一对足上有无性斑 (Hinton,1942;Faustini et al.,1981)进行雌雄鉴别。
1.2 DNA 提取
将单个试虫在研钵中充分研磨,用异硫氰酸胍法(Ming and Wang,2006)提取其基因组DNA,室温晾干后悬浮于20μL 灭菌的双蒸水中,-20℃保存。
1.3 PCR 扩增和测序
28S rRNA 基因的扩增引物为:D2-3665F (5'-AGAGAGAGTTCAAGAGTACGTG-3')和D5-4749R (5'-GTTACACACTCCTTAGCGGA-3')(Angelini and Jockusch,2008)。PCR 反应在TaKaRa 扩增仪上进行:94℃预变性5 min;94℃50 s,55℃45 s,72℃60 s,33个循环;72℃延伸10 min 。PCR 反应总体积是34μL,其中包括2× PCR Reaction Mix (TIANGEN)17μL,Taq DNA 聚合酶0.3μL,DNA 模板1.3μL,上游/下游引物(10 mol/L)各1.4μL,用灭菌双蒸水补足体积。取PCR 扩增产物2μL 在0.75%的琼脂糖凝胶中电泳检测,然后送至上海英俊生物技术有限公司测序。扩增引物和测序引物均由上海捷瑞生物工程技术服务有限公司合成。分别对赤拟谷盗与杂拟谷盗各15 头的基因组DNA 进行了PCR扩增和测序分析。
1.4 序列变异和限制性酶切位点分析
使用Clustal X (version 2.0)软件(Larkin et al.,2007)进行序列比对,相同的序列归为一个单倍型。基于单倍型序列,用MEGA 5.05 软件(Tamura et al.,2011)统计分析其种内和种间遗传变异和核苷酸替换;用BioXM 2.6 软件(http://www.bio-soft.net/format/bioxm.htm)分析其限制性酶切位点,找出种特异性的限制性内切酶。
1.5 PCR 产物的酶切
使用种特异性限制性内切酶PvuI (Fermentas,USA)对28S rRNA 基因PCR 扩增产物进行酶切,酶切反应过程参照PvuI 使用说明书。酶切反应总体积为30μL,包括PCR 产物10μL、10× Buffer R 2μL、限制性内切酶PvuI 2μL、灭菌双蒸水16μL,37℃温育2 h,0.75%琼脂糖凝胶电泳检测酶切片段。
2 结果与分析
2.1 PCR 扩增结果
赤拟谷盗与杂拟谷盗的样品DNA 经PCR 扩增后,均扩增出一个约1070 bp的DNA 片段,扩增结果不受虫种和性别的影响(图1)。
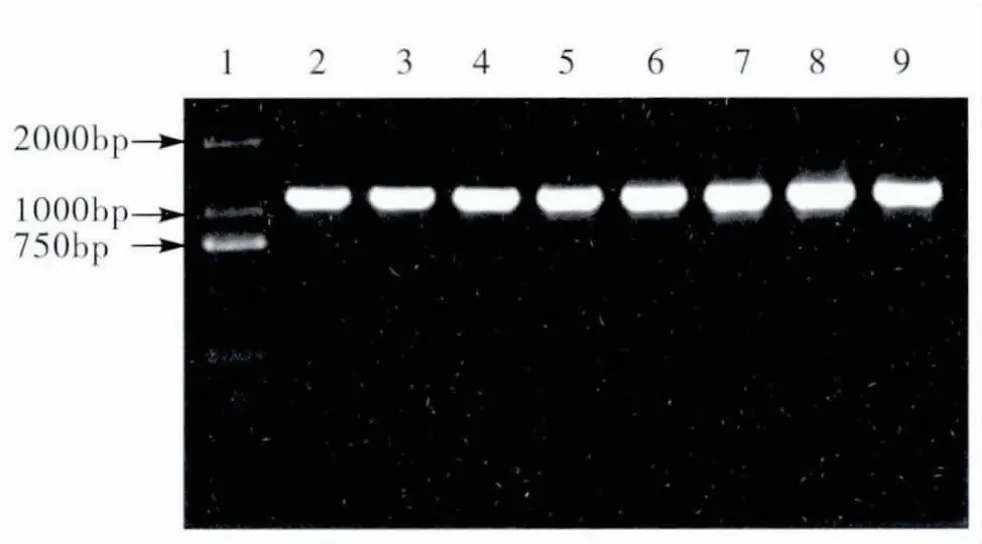
图1 赤拟谷盗与杂拟谷盗28S rRNA 基因片段的PCR 扩增产物Fig.1 PCR amplification products of Tribolium castaneum and Tribolium confusum 28S rRNA gene segments
2.2 序列分析
在测序的赤拟谷盗与杂拟谷盗30个个体的28S rRNA 基因序列中存在2个单倍型,种内各有1个单倍型,种间没有相同的单倍型。2个单倍型序列已提交 GenBank 数据库,登录号为:JX412253,JX412254。
赤拟谷盗与杂拟谷盗28S rRNA 基因序列比对后用于分析的长度为1072 bp,有4个插入或缺失发生。如图2 所示,在28S rRNA 基因区的1072个核苷酸位点中,赤拟谷盗与杂拟谷盗种内均没有变异位点,而种间的变异位点数为76个,其中转换A↔G 和C↔T的发生次数分别为30 和26,颠换A↔C、A↔T、C↔G 和G↔T的发生次数分别为5、11、1 和3,转换发生次数(ti=56)约是颠换发生次数(tv=20)的3 倍,28S rRNA 基因区表现出较高的转换/颠换比(ti/tv=2.80)。

图2 赤拟谷盗(CS)与杂拟谷盗(CF)28S rRNA 基因片段的序列变异位点Fig.2 Variable sites of the 28S rRNA gene segments in Tribolium castaneum (CS)and Tribolium confusum (CF)
2.3 酶切位点分析
9 种限制性内切酶对赤拟谷盗和杂拟谷盗28S rRNA 基因序列的酶切位点和产生的酶切片段不同(表1)。在这9 种限制性内切酶里,PvuI 在两个种的序列上都有酶切位点,可产生明显的酶切片段差异(赤拟谷盗2个酶切片段,杂拟谷盗3个,且片段大小不同);BstBI 在两个种的序列上也都有酶切位点,但产生的酶切片段差异不大(赤拟谷盗2个酶切片段,杂拟谷盗也是2个,且片段大小接近);其它7 种限制性内切酶仅在一个种的序列上存在酶切位点。
2.4 酶切结果
PvuI 对赤拟谷盗和杂拟谷盗28S rRNA 基因扩增产物均能进行酶切,产生的种特异性酶切图谱(酶切条带数和条带大小) (图3)与酶切位点分析(表1)完全一致。
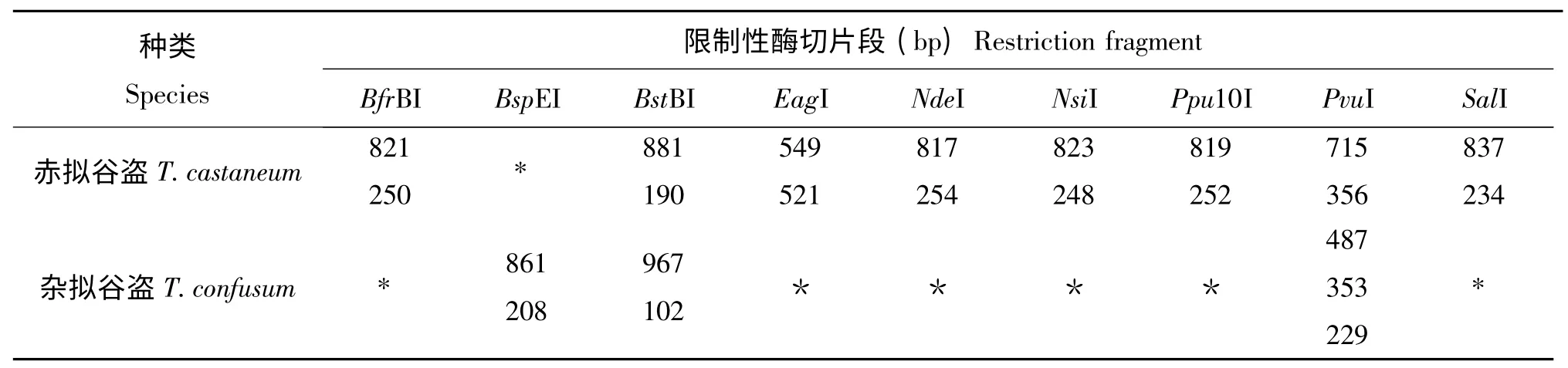
表1 赤拟谷盗与杂拟谷盗28S rRNA 基因的限制性酶切片段长度分析Table1 Fragment length for restriction digests of Tribolium castaneum and Tribolium confusum 28S rRNA gene segments

图3 赤拟谷盗与杂拟谷盗28S rRNA 基因片段的限制性内切酶PvuI 酶切Fig.3 Restriction enzyme PvuI digests of Tribolium castaneum and Tribolium confusum 28S rRNA gene segments
3 结论与讨论
本研究使用通用引物很容易从单个试虫提取的微量基因组DNA 中对28S rRNA 基因进行PCR扩增,电泳检测表明该目的基因条带明亮且没有非特异性扩增(图1),这可能是因为28S rRNA 基因在核基因组里是高拷贝基因。Nowaczyk 等(2009)利用两个种特异性引物分别PCR 扩增赤拟谷盗与杂拟谷盗核糖体DNA (rDNA)的ITS 区,但是rDNA的ITS 区高度可变,不易进行PCR 扩增,不能扩增可能是由于技术原因或样本DNA 质量,而不是因为缺乏种特异性序列,从而导致假阴性出现。本研究中28S rRNA 基因区的PCR-RFLP 分析可避免这种假阴性的出现,原因是使用的是通用引物,容易进行PCR 扩增,基本不会出现无扩增条带,排除了因技术原因、样本DNA 质量和引物问题而导致的无扩增条带出现。
在28S rRNA 基因区的1072个核苷酸位点中,赤拟谷盗与杂拟谷盗种内均没有核苷酸变异位点,而种间的变异位点数为76个,说明该基因区核苷酸序列种间有很多变异,而种内没有变异、非常保守。经Blast 比对分析发现,本研究中所用赤拟谷盗与杂拟谷盗种群的28S rRNA 基因序列与Angelini 和Jockusch (2008)所用种群的该序列相似性分别为99%和100%,这进一步说明所扩增的赤拟谷盗与杂拟谷盗28S rRNA 基因区在种内均是非常保守的。由于赤拟谷盗与杂拟谷盗28S rRNA基因区序列的种内保守性和种间多态性,该基因区适于进行其种内和种间的酶切图谱分析。
在赤拟谷盗与杂拟谷盗28S rRNA 基因区,9种限制性内切酶显示能产生种特异性的酶切位点和酶切片段(表1)。在这9 种限制性内切酶里,BfrBI,BspEI,EagI,NdeI,NsiI,Ppu10I 和SalI 在一个种的28S rRNA 基因区存在酶切位点而在另一个种不存在酶切位点,它们不能被用来区分赤拟谷盗和杂拟谷盗,原因是不能酶切可能是技术原因或没有酶切位点的缘故,这样就有可能出现假阴性。本研究中假阴性可以避免,原因是选用的PvuI 在赤拟谷盗和杂拟谷盗都有酶切位点,但其酶切位点的位置和数目不同,可产生种特异性的酶切图谱(图3)。
由于赤拟谷盗与杂拟谷盗在未成熟期不能进行鉴别,本研究以在面粉厂采集的赤拟谷盗与杂拟谷盗成虫作为试虫,鉴于其在成熟期(成虫)和未成熟期(幼虫和蛹)的基因组DNA 不变,因此建立的PCR-RFLP 方法也同样适用于赤拟谷盗和杂拟谷盗幼虫或蛹的分子鉴定。分别提取赤拟谷盗和杂拟谷盗幼虫或蛹的基因组DNA,对28S rRNA 基因进行了PCR 扩增和测序分析,结果表明幼虫或蛹的28S rRNA 基因序列与其成虫完全一致。
综上所述,赤拟谷盗和杂拟谷盗28S rRNA 基因容易进行PCR 扩增,存在着种特异性的酶切图谱,建立的PCR-RFLP 分析方法可用于赤拟谷盗与杂拟谷盗的分子鉴定。
References)
Angelini DR,Jockusch EL.Relationships among pest flour beetles of the genus Tribolium (Tenebrionidae)inferred from multiple molecular markers [J].Molecular Phylogenetics and Evolution,2008,46(1):127-141.
Arimoto M,Satoh Masaru,Uesugi R,et al.PCR-RFLP analysis for identification of Tetranychus spider mite species (Acari:Tetranychidae)[J].Journal of Economic Entomology,2013,106(2):661-668.
Arthur FH,Hoernemann CK.Impact of physical and biological factors on susceptibility of Tribolium castaneum and Tribolium confusum(Coleoptera:Tenebrionidae)to new formulations of hydroprene[J].Journal of Stored Products Research,2004,40 (3):251-268.
Arthur FH,Liu S,Zhao B,et al.Residual efficacy of pyriproxyfen and hydroprene applied to wood,metal and concrete for control of stored-product insects [J].Pest Management Science,2009,65 (7):791-797.
Bousquet Y.Beetles Associated with Stored Products in Canada:An Identification Guide [M].Ottawa:Agriculture and Agri-Food Canada,1990.
Campbell JF,Arthur FH,Mullen MA.Insect management in food processing facilities [J].Advances in Food & Nutrition Research,2004,48:240-295.
Cepeda GD,Blanco-Bercial L,Bucklin A,et al.Molecular systematic of three species of Oithona (Copepoda,Cyclopoida)from the Atlantic Ocean:comparative analysis using 28S rDNA [J].PLoS ONE,2012,7 (4):e35861.
Faustini DL,Burkholder WE,Laub RJ.Sexually dimorphic setiferous sex patch in the male red flour beetles Tribolium castaneum(Herbst) (Coleoptera:Tenebrionidae):site of aggregation pheromone production [J].Journal of Chemical Ecology,1981,7(2):465-480.
Hinton HE.Seconday sexual characters of Tribolium [J].Nature,1942,49:500.
Larkin MA,Blackshields G,Brown NP,et al.Clustal W and Clustal X version 2.0 [J].Bioinformatics,2007,23 (21):2947-2948.
Nowaczyk K,Obrepalska-Steplowska A,Gawlak M,et al.Molecular techniques for detection of Tribolium confusum in stored products[J].Journal of Economic Entomology,2009,102 (4):1691-1695.
Shen ZP.Identification and control of the important stored-products beetles [J].Bulletin of Grain and Oil Storage Science and Technology,1998,(6):41-44.[沈兆鹏.重要储粮甲虫的识别与防治[J].粮油仓储科技通讯,1998,(6):41-44]
Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods [J].Molecular Biology and Evolution,2011,28 (10):2731-2739.
Zhang SF,Zhou YX.Distribution,host and identification of the important Tribolium species [J].Plant Quarantine,2002,(6):349-351.[张生芳,周玉香.拟谷盗属重要种的分布,寄主及鉴别[J].植物检疫,2002,(6):349-351]

