镍掺杂对黄铁矿型二硫化铁电化学性能的影响
丁 玮,何 珺,王 新,彭会芬,彭智君,董 斌
(1.河北工业大学材料科学与工程学院,天津 300131;2.天津轻工职业技术学院电子信息与自动化系,天津 300350;3.秦皇岛市特种设备监督检验所,河北 秦皇岛 066000)
黄铁矿型FeS2在自然界储量丰富、对环境友好,而且理论比容量(893mAh/g)远高于目前的LiCoO2、LiFePO4等插层化合物(LiCoO2:274 mAh/g[1],LiFePO4:170mAh/g[2]),因此成为大容量锂电池最有发展前景的正极材料[3--4]。但目前的Li/FeS2电池正极材料通常由天然的黄铁矿型FeS2提纯而成,其中的硅、砷等杂质或其氧化物易使电池开路电压较高,电压平台稳定性和大电流放电性能较差[5--6]。向Li/FeS2电池正极材料中加入少量金属氧化物,能够显著改善电池的放电容量和放电平台。Choi等[7]在FeS2颗粒表面化学镀镍降低电池内阻,以提高Li/FeS2电池的循环寿命及Coulomb效率。但由于FeS2中硅、砷等杂质无法完全去除,致使电池在大电流放电时的性能仍较差。Ahn等[8]在利用机械化学法合成FeS2的过程中加入少量Ni,发现能够提高所组装电池的首次放电容量,但循环5次后电池的放电容量不足450mAh/g。为此,采用化学合成法制备纯度高并且细小均匀的FeS2颗粒,试图改善Li/FeS2电池的放电性能。靳世东等[9]利用水热合成法制备了高纯N 型FeS2晶体,并辅以优选的导电剂,虽然Li/FeS2电池的放电容量高达600 mAh/g,但电池的循环性能仍难以显著改善。
溶剂热是一种在较低温度下利用溶液中物质化学反应进行新材料合成的一种方法,它操作简便,被广泛应用于过渡金属硫化物电极(如FeS2[10],NiS[11]和CuS[12])的制备。到目前为止,利用这种方法进行Ni掺杂FeS2的研究尚未见到报道。为此,利用溶剂热方法合成了纯的Ni掺杂FeS2粉体,研究了其室温下的电化学性能。
1 实验
1.1 样品制备
将1g的FeSO4·7H2O(天津市双船化学试剂厂,天津,99%),0.105g NiSO4·2H2O(天津市双船化学试剂厂,天津,99%)和1g聚乙烯吡咯烷酮(PVP,天津化工厂天泰化工公司,天津,99%)溶于115mL乙醇水溶液中(乙醇:30mL,去离子水:85mL)并充分搅拌。将2.13g的硫脲(天津标准科技有限公司,天津,99%)添加到溶液中直到溶液变成深褐色。将混合好的溶液置于具有对位聚苯内衬的反应釜内(总容积为130mL)。调节pH 值为5,添加1g硫粉(天津天大化学试剂厂,天津,99.5%)并持续搅拌。反应釜密封后在200℃保温36h,待自然冷却后用CS2(天津市天试化工贸易有限公司,99.5%)、无水乙醇、稀硫酸和去离子水反复清洗若干次以去除残留反应物与可溶性杂质,在真空条件下于130℃烘干15h,最终得到的黑色粉末即为Ni掺杂的黄铁矿型FeS2。
为了进行比较,通过同样的方法制备了未掺杂的FeS2,只是在合成过程中未添加NiSO4·2H2O 作为反应物。
1.2 电极制备
以制备的FeS2或Ni掺杂FeS2作为活性物质,碳纳米管(CNTs,北京纳辰科技发展有限责任公司)和导电石墨(天津福辰化学试剂厂)作为导电剂制备电极。将活性物质,CNTs和导电石墨的混合物(粉末总量为2g)按照质量比7∶1∶1的称量后置于不锈钢球磨罐中,并添加10个φ10mm 的氧化锆磨球。将球磨罐在充满Ar气的手套箱中密封,并置于行星式高能球磨机中,以250r/min的转速机械研磨2h,使各种组分混合均匀。将1份聚四氟乙烯(PTFE,天津市天试化工贸易有限公司,99.9%)添加到混合好的粉末中,并滴入适量的乙醇超声混合30min。将制备好的浆料碾压成厚度约为100μm 的膜,在真空条件下130℃烘干15h,然后切成直径为10mm(质量约为5mg)的电极片。以所制备的电极片为正极,金属锂箔为负极,Celgard 2400为隔膜,1mol的LiPF6在碳酸乙烯酯EC/碳酸二甲酯DMC/碳酸二乙酯DEC(体积比为2∶2∶1)混合体系的溶液为电解液,在手套箱中装配电池。为了使电池内部达到平衡,装配好的电池要在80℃保温2h,待自然冷却到室温后进行电化学测试。
1.3 性能表征
利用Bruker AXS D8Focus型X 射线衍射仪对样品的相组成进行表征,辐射源为Cu Kα,扫描范围为10°~80°,工作电压与电流分别为40kV 和40mA。利用S-4800 型扫描电子显微镜和JEM-2100F型高分辨率透射电子显微镜对样品的形貌进行观察,并利用透射电子显微镜附带的EDS装置和X-ray mapping装置对样品的化学成分及元素分布状况进行测试。
利用武汉LAND(蓝电)电子有限公司CT-2001A 型电池测试系统测试电池的充放电性能,电流密度为90~1 800mA/g,终止电压范围为1.0~2.5V。电池的放电比容量基于电极中活性物质的量进行计算。利用Zahner IM6e型电化学工作站测试电池的循环伏安特性曲线,扫描速率为0.1mV/s,电压范围为1.0~3.0V。利用此电化学工作站对电池在放电之前的电化学阻抗谱进行测试,频率为1Hz~1MHz,信号电压10mV。利用PPMS-9型多功能物理性能试验机测试材料的电子电导率,测试温度为210~305K,样品尺寸为10mm×3mm×3mm,采用四电极体系,以银浆为电极。
2 结果与分析
图1为所合成样品的XRD 谱。由图1可见:所有的衍射峰均与黄铁矿型FeS2的衍射峰对应(JCPDS 65—3321)。在XRD 谱中未发现其它衍射峰,说明利用溶剂热法可以合成纯净的Ni掺杂FeS2粉体,并且掺杂的Ni以固溶体形式存在于FeS2中。和未掺杂的FeS2相比,Ni掺杂FeS2的衍射峰明显宽化、强度变弱,说明其晶粒尺寸有所减小。而且,Ni掺杂FeS2的XRD 谱略向低角度方向偏移。这是由于Ni2+离子半径(0.069nm)大于Fe2+离子半径(0.061nm),Ni2+掺杂使FeS2的晶格膨胀、晶面间距增大的结果。
图2为所制备样品的SEM 照片。Ni掺杂不仅使FeS2由形状不规则的粗大颗粒转变成光滑的球状,而且使FeS2的颗粒尺寸明显减小,这与图1的XRD测试结果一致。在Ni向FeS2掺杂的过程中,所有原材料均溶解于溶剂中以原子尺度混合,Ni2+能够均匀地分布于溶液中。因此在Ni掺杂进入FeS2晶格的过程中,也能够均匀地存在于FeS2中。图3为Ni掺杂FeS2样品中各个元素的分布状况,表明Ni2+离子均匀地分布在FeS2颗粒表面。
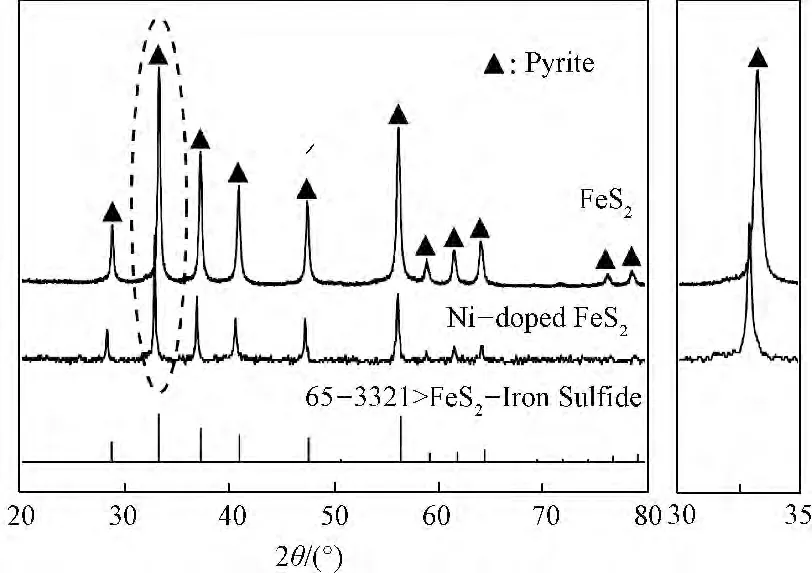
图1 Ni掺杂前后FeS2的XRD 谱Fig.1 XRD patterns of the FeS2before and after Ni doping

图2 Ni掺杂前后的FeS2样品的形貌Fig.2 SEM images of the FeS2before and after Ni doping
Ni掺杂前后FeS2的首次充放电曲线如图4a所示。2种FeS2均在1.5V 附近出现放电平台,在1.8V 出现充电平台,然而Ni掺杂FeS2的充放电平台均比未掺杂的长。在90mA/g的电流密度下,Ni掺杂FeS2的首次放电容量为904mAh/g,比未掺杂的FeS2提高约20%。与Choi等[7]报道的FeS2颗粒表面沉积Ni相比,样品在同样放电条件下,不仅放电平台高,而且放电容量(尤其是平台容量)提高约77%。这是由于掺杂后的FeS2中Ni均匀分布,对材料性能的改善不仅仅局限在材料表面,而是通过改善FeS2颗粒之间的电接触以及颗粒内部的电子传输状况,来减少电池反应过程中的不必要损失,从而起到提高材料电化学性能的作用。
虽然增加电流密度均使材料的首次放电容量降低,但在测试范围内,Ni掺杂FeS2的数据均高于未掺杂的(图4b)。并且,随着电流密度的增加,Ni掺杂前后FeS2的放电容量差距变得越来越大。在900mA/g的电流密度下,Ni掺杂FeS2的首次放电容量为410mAh/g,高于未掺杂的FeS2约50%,约相当于未掺杂FeS2在490mA/g电流密度下的放电容量。在1 800mA/g的高电流密度下,Ni掺杂FeS2的首次放电比容量仍能达到370mAh/g,而此时未掺杂的FeS2却很难有明显的放电。
图5为Ni掺杂FeS2的循环充放电性能。从图5可见,与Choi等[7]报道的Ni沉积FeS2不同,Ni掺杂FeS2的充放电容量随循环次数的增加逐渐降低,但充放电曲线变化较为缓慢,并能够观察到明显的充放电平台。在不同电流密度下,Ni掺杂的循环性能明显优于未掺杂的FeS2。
FeS2在室温下的循环伏安特性曲线(I--V 曲线)如图6所示。Ni掺杂前后FeS2的I--V 曲线类似,它们都在1.2V存在一个还原峰,在2.0V 和2.6V 存在了2个氧化峰。1.2V的还原峰与图4a中的1.5V放电平台相对应。与文献[13]所报道的一致,1.2V还原峰所发生的电化学反应如式(1):

根据Montoro等[14]和Choi等[7]的报道,2.0V和2.6V 的氧化峰所发生的电化学反应则分别对应式(2)和(3):

图3 Ni掺杂FeS2的元素分布Fig.3 Elemental mapping of the Ni-doped FeS2sample

图4 Ni掺杂对Li/FeS2电池首次充放电曲线和首次放电容量的影响Fig.4 Effect of Ni doping on the first discharge-charge curves and capacity rate of the Li/FeS2cell
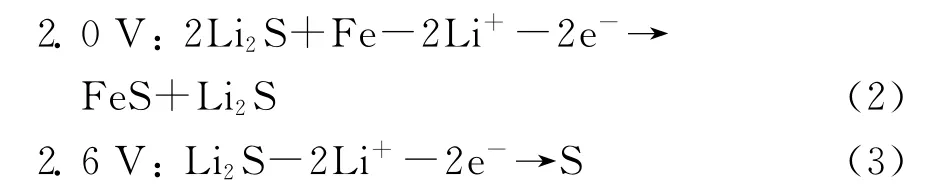
与Ni沉积FeS2的CV 曲线类似[7],Ni掺杂FeS2自第二次循环开始,在1.8V 出现一新的还原峰,说明式(3)的充电产物S参与了后续的循环过程:

而1.3V 的还原峰则与FeS与Li之间的作用有关:
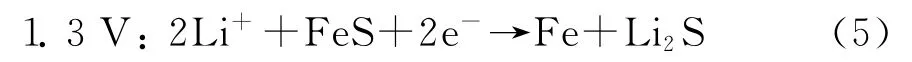
对比图6可以发现,Ni掺杂FeS2的氧化/还原峰强度高于未掺杂FeS2的,并且随着循环次数的增加,Ni掺杂FeS2的氧化/还原峰的位置几乎保持不变。这些结果表明:前者的循环性能优于后者,证实了Ni掺杂能够提高极片中活性物质的利用率,进而能够改善电池的电化学性能,这一结果与图4、图5结果一致。
图7为Ni掺杂前后Li/FeS2电池的电化学阻抗谱。它们均由高频区的半圆和位于低频区的倾斜直线组成。根据对阻抗谱曲线等效电路的模拟可知,阻抗谱半圆高频端与实轴的交点为电池的欧姆阻抗(RΩ),包括电极阻抗和电解质阻抗等。半圆与实轴的另一个交点为电池的电荷传输电阻(Rct),而倾斜的直线为锂离子向活性物质内部进行半无限扩散的Warburg阻抗(ZW)。此外,等效电路中的常相位元件(CPE)代表电极/电解液界面上的双电层电容。对比发现,2条阻抗谱曲线的差别主要是半圆直径(即Rct)的差别。Ni掺杂使电荷传输电阻(Rct)明显减小,说明电子在电极/电解液界面上的传输速度加快,从而使电极反应能够更迅速、更充分地进行。

图5 Ni掺杂FeS2在90mA/g电流密度下的循环充放电曲线和在不同电流密度下的循环性能Fig.5 Charge-discharge curves at a current density of 90mA/g and cycle performances of the Ni-doped FeS2at various current density
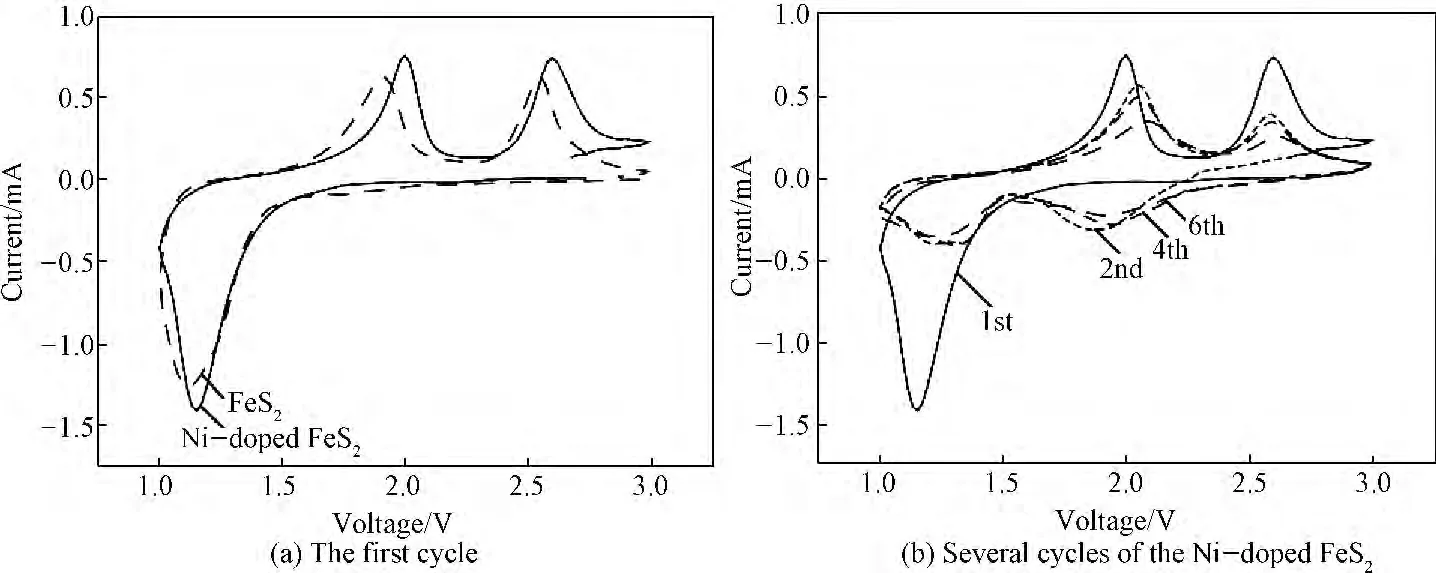
图6 FeS2样品在扫描速率为0.1mV/s下的I--V 曲线Fig.6 I--Vcurves of the Ni-doped FeS2samples at a scanning rate of 0.1mV/s
研究发现,Ni掺杂使FeS2的电子电导率明显提高(图8)。这一结果与Ho等[15]的报道一致,也是前面所测定的Ni掺杂FeS2电化学性能改善的主要原因。另外,在极片制备过程中添加的碳纳米管导电剂在机械球磨过程中会断开,并与其他导电剂和活性物质均匀混合,这些断开的碳纳米管会形成三维网络。网络状的碳纳米管不仅可以提高极片中电子的传输速度,还可以减少电极的内阻。所以,添加碳纳米管作为导电剂使电极电化学反应速度提高,从而也能提高电池的放电容量。正如Endo等[16]所报道的碳纳米管也可以作为电极的物理粘结剂。由于其具有良好的可压缩性和回弹能力,电极可以吸收活性物质在循环过程中由于体积变化而产生的内应力,从而使极片获得较好的循环性能。
3 结论
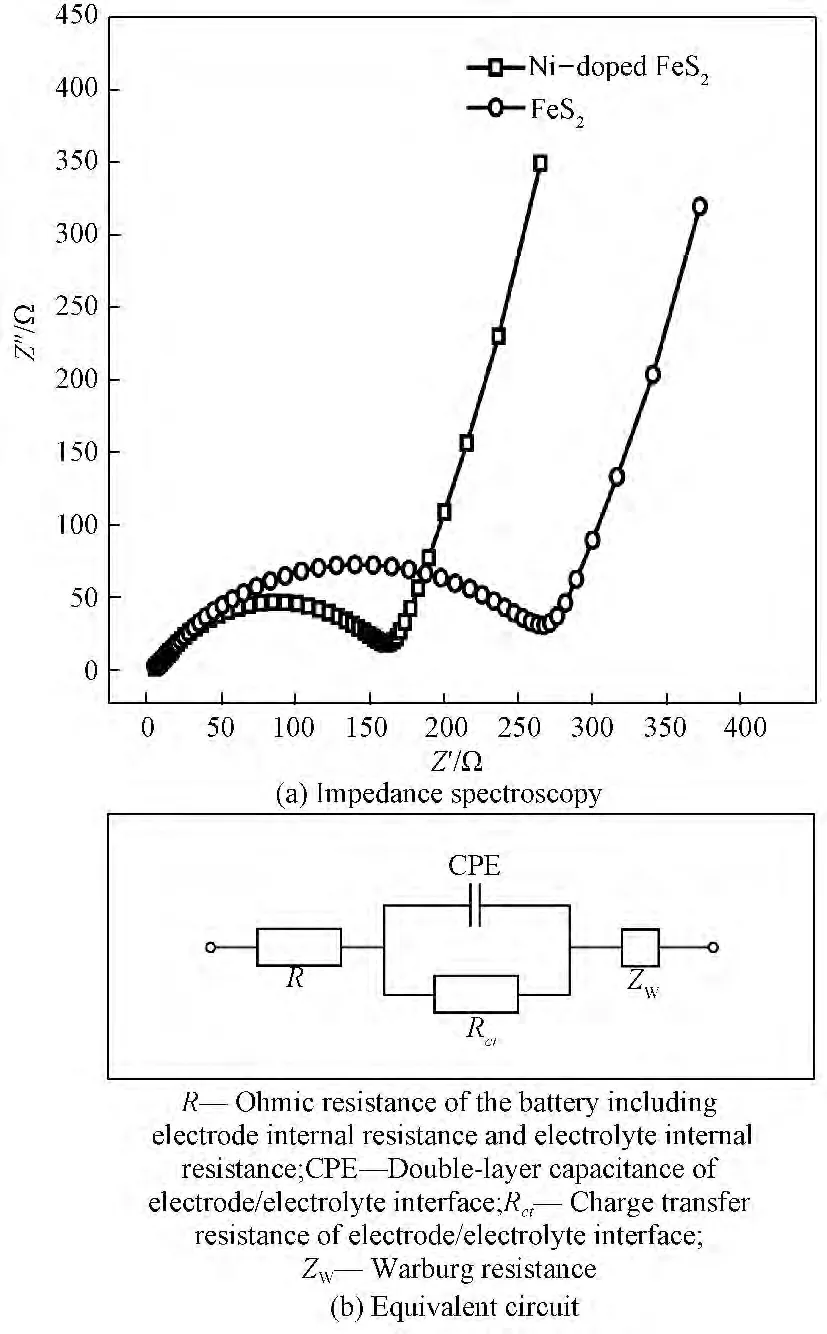
图7 Ni掺杂前后Li/FeS2电池的阻抗谱及等效电路Fig.7 Impedance spectroscopy of the Li/FeS2batteries before and after Ni doping and equivalent circuit
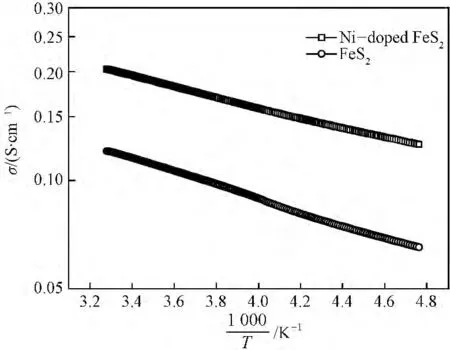
图8 Ni掺杂前后FeS2的电子电导率Fig.8 Electrical conductivity of the FeS2before and after Ni doping
采用溶剂热法能够合成纯的Ni掺杂FeS2,Ni掺杂将尺寸较大、形状不规则的FeS2颗粒转变成尺寸较小的球状。Ni掺杂FeS2在90mA/g电流密度下的首次放电容量为904mAh/g,这数值比未掺杂的FeS2高20%。在450mA/g 的电流密度下,Ni掺杂FeS2的首次放电容量为480mAh/g;20次循环后的放电容量仍大于150mAh/g。这是由于Ni掺杂能有效提高FeS2的电子电导率,降低FeS2电极内阻的结果。
[1]ZOU M J,YOSHIO M,GOPUKUMAR S,et al.Synthesis of high-voltage(4.5V)cycling doped LiCoO2for use in lithium rechargeable cells[J].Chem Mater,2003,15(25):4769-4702.
[2]WU X L,JIANG L Y,CAO F F,et al.LiFePO4nanoparticles embedded in a nanoporous carbon matrix:Superior cathode material for electrochemical energy-storage devices[J].Adv Mater,2009,21(25/26):2710-2714.
[3]SHAO-HORN Y,OSMIALOWSKI S,HORN Q C.Reinvestigation of lithium reaction mechanisms in FeS2pyrite at ambient temperature [J].J Electrochem Soc,2002,149(12):A1547-A1555.
[4]SHAO-HORN Y,OSMIALOWSKI S,HORN Q C.Nano-FeS2for commercial Li/FeS2primary batteries[J].J Electrochem Soc,2002,149(11):A1499-A1502.
[5]SHAO-HORN Y,HORN Q C.Chemical,structural and electrochemical comparison of natural and synthetic FeS2pyrite in lithium cells[J].Electrochim Acta,2001,46(17):2613-2621.
[6]CHOI J W,CHERUVALLY G,AHN H J,et al.Electrochemical characteristics of room temperature Li/FeS2batteries with natural pyrite cathode[J].J Power Sources,2006,163(1):158-165.
[7]CHOI Y J,KIM N W,KIM K W,et al.Electrochemical properties of nickel-precipitated pyrite as cathode active material for lithium/pyrite cell[J].J Alloy Compd,2009,485(1/2):462-466.
[8]AHN I S,KIM D W,KANG D K,et al.The effects of the particle size and active materials on the discharge properties of the Li/Fe(X)S2electrode[J].Met Mater Int,2008,14(1):65-70.
[9]JIN S D,LI D G,LI J,et al.Influence of heat treatment on electrochemical performance of positive material pyrite(FeS2)[J].Inorg Chem Ind,2011,43(12):23-25.
[10]WU R,ZHENG Y F,ZHANG X G,et al.Hydrothermal synthesis and crystal structure of pyrite[J].J Cryst Growth,2004,266(4):523-527.
[11]MENG Z Y,PENG Y Y,YU W,et al.Solvothermal synthesis and phase control of nickel sulfides with different morphologies[J].Mater Chem Phys,2002,74(2):230-233.
[12]PEI L Z,WANG J F,TAO X X,et al.Synthesis of CuS and Cu1.1Fe1.1S2crystals and their electrochemical properties[J].Mater Charact,2011,62(3):354-359.
[13]FONG R,DAHN J R.Electrochemistry of pyrite-based cathodes for ambient temperature lithium batteries[J].J Electrochem Soc,1989,136(11):3206-3210.
[14]MONTORO L,ROSOLEN J M.Gelatin/DMSO:a new approach to enhancing the performance of a pyrite electrode in a lithium battery [J].Solid State Ionics,2003,159(3/4):233-240.
[15]HO C H,HUANG C E,WU C C.Preparation and characterization of Ni-incorporated FeS2single crystals[J].J Cryst Growth,2004,270(3/4):535-541.
[16]ENDO M,KIM Y A,HAYASHI T,et al.Vapor-grown carbon fibers(VGCFs):Basic properties and their battery applications[J].Carbon,2001,39(9):1287-1297.

