烟草半胱氨酸蛋白酶抑制剂(CPI)基因家族的克隆及组织表达谱分析
林世锋,元野,任学良,邹颉,黎瑞源,郭玉双,赵杰宏,王仁刚
1贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵州贵阳 550081;2黑龙江省烟草科学研究所,牡丹江 157011
烟草半胱氨酸蛋白酶抑制剂(CPI)基因家族的克隆及组织表达谱分析
林世锋1,元野2,任学良1,邹颉1,黎瑞源1,郭玉双1,赵杰宏1,王仁刚1
1贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵州贵阳 550081;2黑龙江省烟草科学研究所,牡丹江 157011
运用生物信息学方法,结合RT-PCR和SMART RACE技术从烟草(Nicotiana tabacum)中克隆了4个CPI基因的全长cDNA序列,分别命名为NtCPI1、NtCPI2、NtCPI3和NtCPI4, GenBank登陆号分别为KF057988、KF057989、KF057990和KF057991。基因序列分析表明4个基因分别编码98、98、120和123个氨基酸残基的蛋白质,都具有CPI反应位点的保守基序GG、QXVXQ和A/PW,同时具有植物CPI所特有的LARFAV基序,其中NtCPI3和NtCPI4的N端还包含一段27个氨基酸残基组成的信号肽。实时荧光定量PCR试验表明,4个基因的组织表达谱很广,在根、茎、叶和芽组织中都有表达。研究结果为进一步研究半胱氨酸蛋白酶抑制剂在植物中的生理功能奠定了基础。
烟草;半胱氨酸蛋白酶抑制剂;基因家族;克隆;组织表达谱
半胱氨酸蛋白酶抑制剂(Cysteine proteinase inhibitor,CPI),也称巯基蛋白酶抑制剂,是一类广泛存在于动植物体内的蛋白超家族,其生理作用是与巯基蛋白酶相互作用和制约达到动态平衡,调节机体内蛋白酶活性,进而制约蛋白质代谢,阻止不良的蛋白水解作用[1-2]。在植物中,CPI参与调控植物体胚胎发育[3-4]、种子萌发[5-6]、幼苗生长[7]、果实成熟[8]以及组织分化衰老[9-10]和细胞程序性死亡[11-12]等机制。近年来,研究发现植物CPI在提高作物对病虫害的抗性[13-15]以及缓解非生物胁迫造成的损伤[16-17]等方面具有重要作用,因而研究和利用CPI基因,阐述该基因的作用机理,对提高我国作物品质和产量,开发绿色生态农业具有重大意义。
目前,已从水稻[18]、玉米[19]、小麦[20]、大豆[21]、番茄[13,15,22]等多种植物中克隆到CPI基因,它们在进化上高度保守,而烟草CPI基因序列尚未见报道。为此,本研究利用生物信息学方法,结合RT-PCR和SMART RACE技术,克隆了烟草CPI基因cDNA全序列;并运用RT-PCR方法,对其在烟草组织中的表达情况进行研究,以期为烟草CPI基因功能的研究奠定基础。
1 材料与方法
1.1 植物材料
分别收集烟草栽培品种K326(Nicotiana tabacumL. cv. K326)生根期幼苗的根、茎、叶和芽组织,液氮迅速冷冻,-80℃保存备用。
1.2 方法
1.2.1 RNA的提取与cDNA第一链的合成
采用Trizol Reagent(Invitrogen公司)法提取总RNA。参照TaKaRa公司反转录试剂盒说明书合成cDNA第一链。
1.2.2 CPI全长cDNA的克隆
以番茄CPI全长cDNA序列(登陆号:XM_004228432)为信息探针,在NCBI烟草EST数据库中进行BLAST检索,将检索到的来自烟草品种K326的全部EST序列利用DNAMAN6.0软件进行拼接,形成序列重叠群(Contig)。
根据获得的重叠群序列设计各自基因3′RACE嵌套引物和5′RACE嵌套引物,利用SMARTTMRACE cDNA Amplification Kit(TaKaRa公司)进行RACE扩增,分别获得各个基因的3′端序列和5′端序列。再用DNAMAN软件组装以上序列,获得全长cDNA序列信息,分别设计合成1对基因全长引物C1-F和 C1-R、C2-F和 C2-R、C3-F和 C3-R、C4-F和C4-R,以合成的烟草品种K326 cDNA第一链为模板,进行PCR扩增,获得4个烟草CPI基因的全长cDNA序列。

表1 引物序列及预期片段大小Tab. 1 Sequence of primers and preproduction length
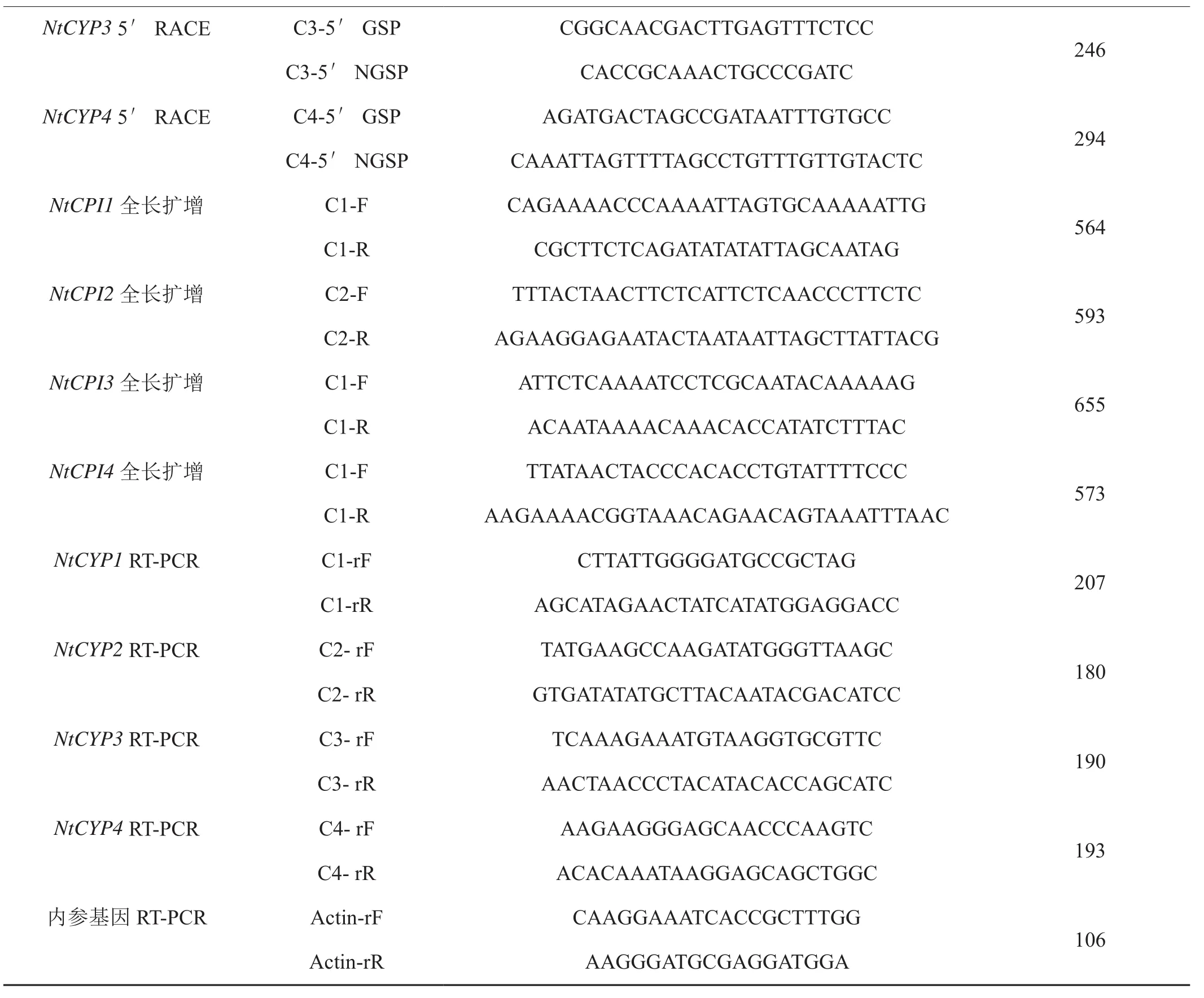
表1 (续)
1.2.3 CPI基因的生物信息学分析
应用ORF Finder( http: //www. ncb.i nlm. nih.gov/gorf/gor.f html)程序确定开放阅读框(ORF);通过 NCBI 上 的 BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列相似性检索;蛋白质结构域分析采用SMART 程序(http://smart.embl-heidelberg.de/);运用DNAMAN 6.0、ClustalX 2.0和MEGA4.0软件进行氨基酸序列比对和进化树分析。
1.2.4 CPI的DNA序列克隆
采用CTAB法[23]从新鲜幼嫩的烟草叶片中提取基因组DNA。利用基因全长引物进行扩增、克隆和测序。
1.2.5 实时荧光定量PCR
根 据NtCPI1、NtCPI2、NtCPI3和NtCPI4的cDNA序列设计特异引物C1-rF和C1-rR、C2-rF和C2-rR、C3-rF和C3-rR、C4-rF和C4-rR。选用烟草Actin基因(NTU60495)为内参基因,并设计引物Actin-rF和Actin-rR。利用TaKaRa公司Taqman探针试剂盒在ABI Stepone Plus实时荧光定量PCR仪上进行RT-qPCR实验,采用2-ΔΔCt相对定量法[24]分析各基因在烟草不同组织中的表达水平。
2 结果与分析
2.1 NtCPI1、NtCPI2、NtCPI3和NtCPI4全长cDNA克隆及分析
以XM_004228432为信息探针,在烟草EST库中进行检索和重叠群分析,最终获得4个重叠群。由此设计合成RACE引物进行扩增,获得各自基因的3′端和5′端(图1)。通过测序拼接,获得各自基因的全长序列信息。经ORF搜索以及其它植物来源CPI基因比对分析,确定各自基因具有完整的ORF。根据全长基因拼接序列设计引物,用RT-PCR方法,获得全长cDNA序列(图2),将其命名为NtCPI1、NtCPI2、NtCPI3和NtCPI4,并在GenBank注册,基因登陆号分别为KF057988、KF057989、KF057990和KF057991(图3)。
NtCPI1基因cDNA全长564 bp(不包含多聚腺苷酸尾),由36 bp的5′端非翻译区(5′-UTR)、297 bp编码区和231 bp的3′端非翻译区(3′-UTR)组成,编码98个氨基酸,预测分子量约为10.819 kD,等电点为5.83;NtCPI2基因cDNA全长593 bp,由84 bp的5′-UTR、297 bp编码区和212 bp的3′-UTR组成,编码98个氨基酸,预测分子量约为10.807 kD,等电点为5.43;NtCPI3基因cDNA全长655 bp,由51 bp的5′-UTR、363 bp编码区和241 bp的3′-UTR组成,编码120个氨基酸,预测分子量约为12.993 kD,等电点为9.44;NtCPI4基因cDNA全长573 bp,由60 bp的5′-UTR、372 bp编码区和141 bp的3′-UTR组成,编码123个氨基酸,预测分子量约为13.419 kD,等电点为10.01。
SMART分析发现,NtCPI1、NtCPI2、NtCPI3和NtCPI4基因编码的多肽包含典型的CY superfamily保守功能结构域,其中NtCPI3和NtCPI4基因编码的多肽N端包含一段27个氨基酸残基组成的信号肽,而NtCPI1和NtCPI2基因编码的多肽不具有信号肽(图3)。进一步分析发现,NtCPI1、NtCPI2、NtCPI3和NtCPI4成熟多肽具有植物半胱氨酸蛋白酶抑制剂产生抑制活性所必须的一级结果:2个靠近N端的G、假定的反应域QXVXG和靠近C端的A/PW基序;并且存在典型的植物半胱氨酸蛋白酶抑制剂基因家族高度保守的特征模式 [LVI]-[AGT]-[RKE]-[FY]-[AS]-[VI]-x-[EDQV]-[HYFQ]-N(图3)。
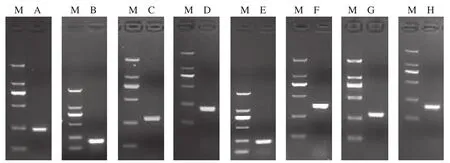
图1 烟草CPI基因的5′RACE 和3′RACE电泳结果Fig. 1 Electrophoresis analysis of 5′ RACE and 3′ RACE products of CPIs from Nicotiana tabacum
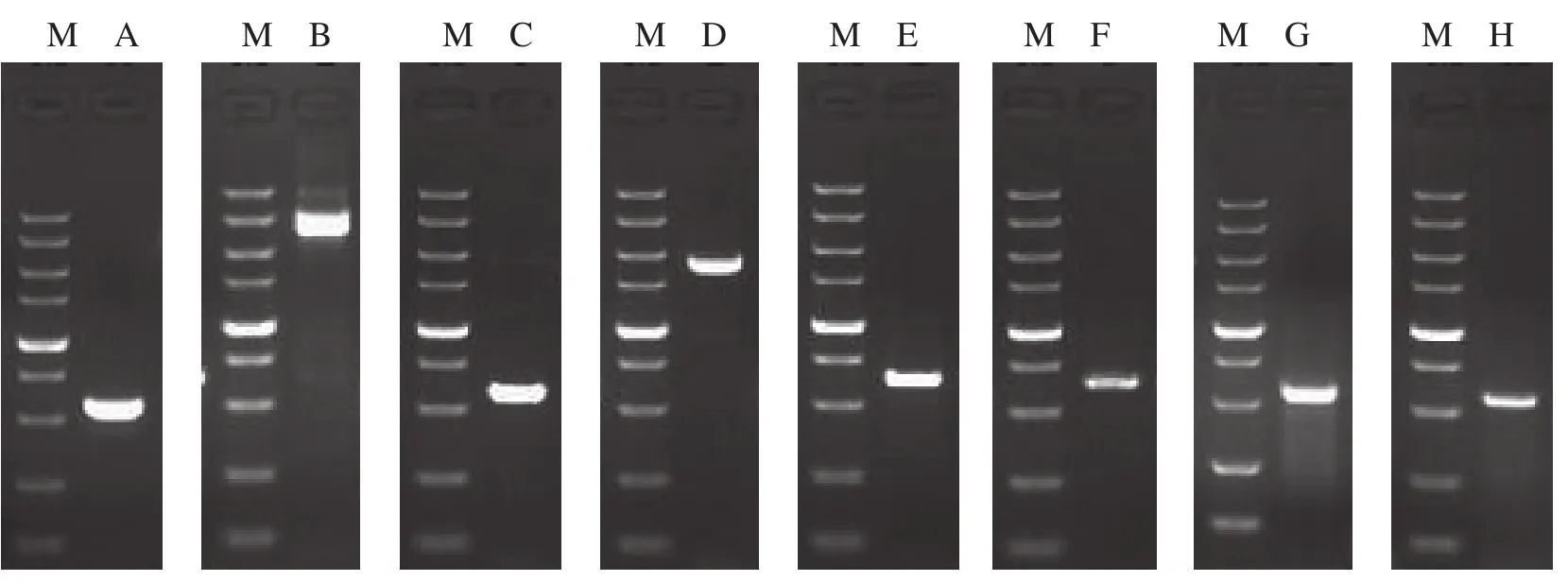
图2 烟草CPI基因全长cDNA和基因组DNA的PCR 扩增结果Fig. 2 PCR Amplification of the full length cDNA and genomic DNA of CPIs from Nicotiana tabacum

图3 烟草CPI基因的核苷酸序列及其编码的氨基酸Fig. 3 Nucleotide and deduced amino acid sequences of CPIs from Nicotiana tabacum
经氨基酸序列同源检索,发现NtCPI1与番茄SlCPI1(XP_004228480)同源关系最近,一致性为98%;NtCPI2与蓖麻 RcCPI(XP_002523225)同源关系最近,一致性为80%;NtCPI3与番茄SlCPI3(XP_004250271)同源关系最近,一致性为79%;NtCPI4与番茄SlCPI4(XP_004239826)同源关系最近,一致性为70%(图4)。系统进化分析显示,从烟草中分离的CPI分为2组,其中NtCPI1和NtCPI2聚合为一组,NtCPI3和NtCPI4聚合为另外一组。

图4 不同植物CPI基因氨基酸序列同源性比较Fig. 4 Alignment of deduced amino acid sequences of CPI genes of different plants
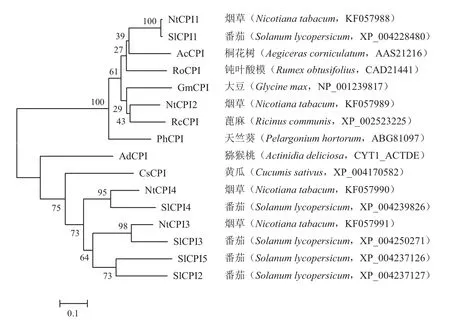
图5 烟草与其他物种CPI同源蛋白的系统进化分析Fig. 5 Phylogenetic analysis of amino acid sequences of CPIs from tobacco and other species
2.2 NtCPI1、NtCPI2、NtCPI3和NtCPI4 DNA序列分析
将克隆到的NtCPI1、NtCPI2、NtCPI3和NtCPI4对应的基因组序列(图1-E,1-J,1-O,1-T)与基因cDNA序列进行比对,结果表明,NtCPI1和NtCPI2全长分别为2835 bp和1873 bp,均由2个外显子和1个内含子组成。NtCPI1的2个外显子长度依次为138 bp和426 bp,内含子长度为2271 bp,位于第34Q和35N 2个氨基酸之间。NtCPI2的2个外显子长度依次为187 bp和407 bp,内含子长度为1280 bp,位于第34Q和35N 2个氨基酸之间。所有内含子的左右边界均为GT-AG结构,保证在RNA加工过程中内含子被正确识别和切除。而NtCPI3和NtCPI4不含内含子(图6)。
2.3 NtCPI1、NtCPI2、NtCPI3和NtCPI4 在不同组织中表达特性
以烟草根中NtCPI2的表达量为参照,测定NtCPI1、NtCPI2、NtCPI3和NtCPI4基因在烟草根、茎、叶和芽中的表达量(图7)。由图7可知在烟草不同组织间NtCPI1、NtCPI2、NtCPI3和NtCPI4的表达量无显著差异(P>0.05);NtCPI1和NtCPI4在各组织中的表达量略高于NtCPI2、NtCPI3,但差异均不显著(P>0.05)。
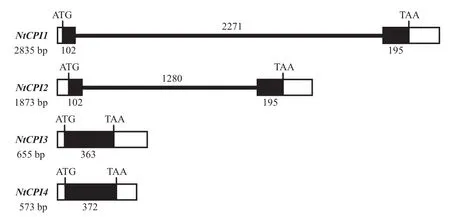
图6 CPI基因结构比较Fig. 6 Comparison of the genomic organization of CPI genes
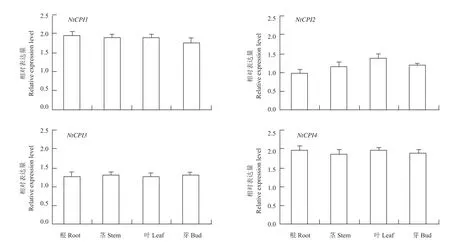
图7 NtCPI1~4基因的组织特异性表达特征Fig. 7 Expression characteristics of NtPGIP1-4 in different tissues of tobacco
3 结论与讨论
近年来,半胱氨酸蛋白酶抑制剂的研究越来越引起人们广泛关注,先后在各种植物中克隆出多种CPI基因。本研究通过对GenBank数据库信息的挖掘,分离到烟草CPI基因家族4个成员NtCPI1、NtCPI2、NtCPI3和NtCPI4。生物信息学分析发现这些基因编码的多肽均包含植物半胱氨酸蛋白酶抑制剂产生抑制活性所必须的活性位点:靠近N端的G、QXVXG区域和靠近C端的A/PW基序。并且存在典型的植物半胱氨酸蛋白酶抑制剂基因家族高度保守的特征模式 [LVI]-[AGT]-[RKE]-[FY]-[AS]-[VI]-x-[EDQV]-[HYFQ]-N。此外,NtCPI3和NtCPI4基因编码的多肽N端包含有一段信号肽,说明这2个基因很可能在细胞外行使其调节功能,实现其抑制活性,这一特征也同许多CPI家族基因相一致。上述序列分析结果也说明NtCPI1、NtCPI2、NtCPI3和NtCPI4应属于CPI家族。
Adeliana等[25]根据植物CPI结构域的数量将植物CPI分为两类:一类是单结构域的植物CPI,大多数植物CPI属于此类型;第二类是多结构域的植物CPI,如具有8个结构域马铃薯块CPI和各具有3个结构域的番茄叶部和向日葵种子的CPI[26-27]。根据这个分类依据,4个烟草CPI应该属于单结构域的植物CPI。Margis等[28]对32种植物CPI进行了系统的分析将这些植物CPI分为三类。认为所有的第一类植物CPI都含有一个与第一段植物CPI保守序列对应的核苷酸序列相隔12 bp的内含子,但是即便内含子具有相同的位置,每一种亚类此内含子的大小都有很大的不同。第一亚类的蛋白还含有第二个内含子位于mRNA 3’端非编码区域。第三亚类蛋白含有另外的两个内含子,一个位于蛋白酶抑制剂结构域与未知功能结构域的连接区所对应的核苷酸区段,另一个位于碳末端区域。第一类和第三类植物CPI的主要不同在于第三类蛋白缺少内含子。按照基因结构划分,很明显NtCPI1和NtCPI2属于第一类植物CPI中的第二亚类,即仅在第一段植物CPI保守序列对应的核苷酸序列之后存在一个内含子;而NtCPI3和NtCPI4不具有内含子,属于第三类植物CPI。
总之,植物CPI的种类较多,在植物体内以基因家族的形式存在,不同植物的CPI具有相同的保守区段,可能使其保持某种相似功能。植物CPI除了具有特定的保守序列外,不同植物CPI基因的一级结构是不同的,呈现出多样性和复杂性的特点,可能是植物对多样化的生物非生物胁迫的一种适应。因此,针对植物CPI不同家族成员表达的时空模式、对环境的应答反应以及表达产物的底物专一性还有待进一步研究。
[1]Xavier Filho J. The biological roles of serine and cysteine proteinase inhibitors in plants [J]. Revista Brasileira de Fisiologia Vegetal, 1992, 4(1): 1-6.
[2]文方德, 傅家瑞. 植物种子的蛋白酶抑制剂及其生理功能[J]. 植物生物学通讯, 1997, 33(1):1-9.
[3]Aberlenc-Bertossi F, Chabrillange N, Duval Y,et al.Contrasting globulin and cysteine proteinase gene expression patterns reveal fundamental developmental differences between zygotic and somatic embryos of oil palm [J]. Tree Physiology, 2008, 28(8): 1157-1167.
[4]Cervantes E, Rodríguez A, Nicolás G. Ethylene regulates the expression of a cysteine proteinase gene during germination of chickpea (Cicer arietinumL.) [J]. Plant Molecular Biology, 1994, 25(2): 207-215.
[5]Martinez M, Cambra I, Carrillo L. Characterization of the entire cystatin gene family in barley and their target cathepsin L-like cysteine-proteases, partners in the hordein mobilization during seed germination [J]. Plant Physiology,2009, 151(3): 1531-1545.
[6]Martinez M, Rubio Somoza I, Fuentes R. The barley cystatin gene(Icy)is regulated by DOF transcription factors in aleurone cells upon germination [J]. Journal of Experimental Botany, 2005, 56(41 2): 547-556.
[7]Hwang J E, Hong J K, Je J H,et al. Regulation of seed germination and seedling growth by anArabidopsisphytocystatin isoform, AtCYS6 [J]. Plant Cell Reports,2009, 28(11): 1623-1632.
[8]Neuteboom L W, Matsumoto K O, Christopher D A. An extended AE-rich N-terminal trunk in secreted pineapple cystatin enhances inhibition of fruit bromelain and is posttranslationally removed during ripening [J]. Plant physiology, 2009, 151(2): 515-527.
[9]SHEN Fafu,YU Shuxun,HAN Xiulan,et al. Cloning and characterization of a gene encoding cysteine proteases from senescent leaves ofGossypium hirsutum[J]. Chinese Science Bulletin, 2004, 49(24): 2601-2607.
[10]Yamada K, Matsushima R, Nishimura M,et al. A slow maturation of a cysteine protease with a granulin domain in the vacuoles of senescingArabidopsisleaves [J]. Plant Physiology, 2001, 127(4): 1626-1634.
[11]Solomon M, Bellenghi B, Delledonne M. The involvement of cysteine proteases and protease inhibitor genes in the regulation of programmed cell death in plants [J]. Plant Cell, 1999, 11(3): 431-443.
[12]Belenghi B, Acconcia F, Trovato M,et al. AtCYS1,a cystatin fromArabidopsis thaliana, suppresses hypersensitive cell death [J]. European Journal of Biochemistry, 2003, 270(12): 2593-2604.
[13]Krüger J, Thomas C M, Golstein C,et al.A tomato cysteine protease required for Cf-2-dependent disease resistance and suppression of autonecrosis [J]. Science, 2002, 296(5568):744-747.
[14]Srinidi Mohan, Peter W K, Ma W. Paul Williams,et al.A naturally occurring plant cysteine protease possesses remarkable toxicity against insect pests and synergizesBacillus thuringiensistoxin [J]. PLoS ONE, 2008, 3(3):e1786.
[15]Tian M, Win J, Song J. A phytophthom infestans cystatin-like protein targets a novel tomato papain-like apoplastic protease [J]. Plant Physiology, 2007, 143(1): 364-377.
[16]Van der Vyver C, Schneidereit J, Driscoll S. Oryzacystatin I expression in transformed tobacco produces a conditional growth phenotype and enhances chilling tolerance [J]. Plant Biotechnology Journal, 2003, 1(2): 101-112.
[17]Koizumi M, Yamaguchi-Shinozaki K, Tsuji H,et al.Structure and expression of two genes that encode distinct drought-inducible cysteine proteinases inArabidopsis thaliana[J]. Gene, 1993, 129(2): 175-182.
[18]Abe K, Emori Y, Kondo H,et al. Molecular cloning of a cysteine proteinase inhibitor of rice (oryzacystatin).Homology with animal cystatins and transient expression in the ripening process of rice seeds [J]. The Journal of Biological Chemistry, 1987, 262(35): 16793-16797.
[19]Yamada T, Ohta H, Shinohara A,et al.A cysteine protease from maize isolated in a complex with cystatin [J]. Plant &Cell Physiology, 2000, 41(2): 185-191.
[20]Kuroda M, Kiyosaki T, Matsumoto I, et al. Molecular cloning, characterization, and expression of wheat cystatins[J]. Bioscience, Biotechnology, and Biochemistry, 2001,65(1): 22-28.
[21]Zimacheva A V, Mosolov V V. Cysteine proteinase inhibitors from soybean seeds [J]. Biochemistry (New York), 1995, 60(1): 83-87.
[22]Girard C, Rivard D, Kiggundu A,et al. A multicomponent,elicitor-inducible cystatin complex in tomato,Solanum lycopersicum[J]. New Phytologist, 2007, 173(4): 841-851.
[23]Porebskis, Bailey G, Baumb B R. Modification of CTAB DNA extraction protocol for plant s containing high polysaccharide and polyphend components [J]. Plant Molecular Biology Reporter, 1997, 15(1): 8-15.
[24]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 2001, 25: 402-408.
[25]Adeliana S. Oliveira, José Xavier-Filho, Maurício P. Sales.Cysteine proteinases and cystatins [J]. Brazilian Archives of Biology and Technology, 2003, 46(1): 91-104.
[26]Waldron C, Wegrich L M, Merlo P A,et al.Characterization of a genomic sequence coding for potato multicystatin,and eight-domain cysteine proteinase inhibitor [J]. Plant Molecular Biology, 1993, 23(4): 801-812.
[27]Kouzuma Y, Inanaga H, Doi-Kawano K,et al.Molecular cloning and functional expression of cDNA encoding the cysteine proteinase inhibitor with three cystatin domains from sunflower seeds [J]. The Journal of Biochemistry,2000, 128(2):161-166.
[28]Margis R, Reis E M, Villeret V. Structural and phylogenetic relationships among plant and animal cystatins [J]. Archives of Biochemistry and Biophysics, 1998, 359(1): 24-30.
Cloning and tissue expression of cysteine proteinase inhibitor (CPI)gene family inNicotiana tabacumL.
LIN Shifeng1, YUAN Ye2, REN Xueliang1, ZOU Jie1, LI Ruiyuan1, GUO Yushuang1, ZHAO Jiehong1WANG Rengang1
1 Molecular Genetics Key Laboratory of China Tobacco, Guizhou Academy of Tobacco Science, Guiyang 550081,Guizhou,China;2 Heilongjiang Tobacco Research Institute, Mudanjiang 157011, Heilongjiang,China
Full-length cDNAs of fourCPIgenes includingNtCPI1、NtCPI2、NtCPI3andNtCPI4were cloned fromNicotiana tabacumL. cv. K326 using RT-PCR and SMART RACE technique. Their sequences were deposited in GenBank with accession number KF057988,KF057989, KF057990 and KF057991. Sequence analysis showed that these four genes were predicted products of 98, 98, 120 and 123 amino acid residues, respectively. In addition to the typical inhibitory motifs, i.e. central signature motif QXVXG, a GG doublet in terminal region, and A/PW residues in C-terminal part. These deduced amino acid sequences contained PhyCys-specific LARFAV-like motif in the N-terminal region, of which a N-terminal signal peptide of 27 residues was found in both NtCPI3 and NtCPI4. Meanwhile, transcripts of these four genes were found in roots, stems, leaves and buds by real-time quantitative PCR, which indicated that they were broadly expressed in tobacco. This study laid foundation for further exploring physiological functions of these cysteine proteinase inhibitor genes in plants.
Nicotiana tabacum; cysteine proteinase inhibitor (CPI); gene family; cloning; tissue expression
10.3969/j.issn.1004-5708.2014.04.016
Q81 文献标志码:A 文章编号:1004-5708(2014)04-0079-09
贵州省科技厅农业攻关项目(黔科合NY字[2011]3047号);中国烟草总公司重点项目(中烟办[2010]221号);贵州省优秀青年科技人才培养对象专项资金(黔科合人字[2013]02 号);贵州省科学技术基金项目(黔科合J字[2012]2256号)
林世锋(1978—),博士,副研究员,研究方向为烟草遗传育种与分子生物学,Email:linshifeng1978@163.com
通讯简介:王仁刚(1976—),硕士,副研究员,研究方向为烟草遗传育种与分子生物学,Email:rengangwang@126.com
2013-07-08

