不同输血输液方案对失血性休克大鼠肾功能及AQP2,BSC1的影响
李 凯,高 凤,冷亚书,赵国庆,李龙云
(吉林大学中日联谊医院,吉林 长春130033)
本实验针对大鼠重度失血性休克模型,采用临床常用的混合输血输液策略,对比重度失血性休克及两种液体复苏方案对肾脏功能的影响,及与BSC1、AQP2蛋白的关系。
1 材料与方法
1.1 材料 实验动物为清洁级雄性SD大鼠,体重220-250g,由吉林大学动物实验中心提供。盐酸氯胺酮注射液,乳酸钠林格氏液,羟乙基淀粉(130/0.4,万汶,费森尤斯卡比).AQP2、BSC1抗体为兔抗鼠抗体和辣根过氧化物标记羊抗兔IgG多克隆抗体购自Sigma公司;SP免疫组化试剂盒购自宝生物有限公司。全自动生化分析仪及比重仪购自徐州美康电子设备有限公司。
1.2 方法
1.2.1 急性重度失血性休克模型的建立[1]与分组实验将雄性SD大鼠24只,随机分为3组,每组8只。实验前12h禁食、自由饮水。腹腔注射氯胺酮100mg/kg麻醉后,右侧股动脉、股静脉插管,股动脉插管经三通管连接水银血压计和玻璃注射器,供观察血压,经插管注射肝素钠生理盐水(500U、kg)抗凝,股静脉插管供输血输液,术毕,动物稳定10 min,。C组仅行股动静脉插管,其余两组经股动脉20min内放血35%,使平均动脉压(MAP)低于40 mmHg,60min后按不同方案输入不同复苏液体,维持MAP在80mmHg 30min。缝合血管,彻底止血后,缝合切口,保温苏醒。
1.2.2 标本采集 术后24h再次麻醉采样。采集术前和术后24h尿液样本,记录尿量,检测尿比重。采集术前及术后24h的血液送检肌酐(Cr)及尿素氮(BUN),取血后迅速摘除大鼠左侧肾脏,将取出的左肾标本置于冰上沿正中线分割成左右两部分,其中一部分标本取材后放入10%福尔马林溶液中固定以行病理学及免疫组织化学检测,组织切片HE染色,光学显微镜观察肾组织病理变化。依据Paller法[2]对肾小管损害程度进行评分。另一部分将肾脏于显微镜下分离出皮质和髓质后马上放入液氮中冻存,1h后置于-80℃冰箱保存以行Western blot检测。
1.2.3 生化指标检测 标本集齐后生化分析仪测定BUN和Cr,比重计测量尿液比重。
1.2.4 免疫组织化学检测BSC1、AQP2的表达肾脏石蜡标本切成3μm切片,经二甲苯脱蜡,梯度酒精水化后按SP试剂盒说明书操作。在200倍光镜下观察以细胞膜显色棕黄色颗粒为阳性。
1.2.5 蛋白印迹(Western blot)肾组织加入含蛋白酶抑制剂的蛋白裂解液(250mM suCrose包含1mM EDTA,20μg/mlPMSF,1μg/ml pepstatinA,和1μg/ml leupetin pH 7.4)后匀浆(电动匀浆仪1 250rpm,5s),提取膜蛋白。应用蛋白分析试剂(Bio-Rad,USA)测定总蛋白浓度,50μg蛋白质溶于蛋白上样缓冲液中煮沸5min,12%的聚丙烯酰胺凝胶电泳(电压120V)30min后,100V电泳1 h,将胶版上的蛋白带转至纤维素膜上(PVDF膜),将PVDF膜放入含5%脱脂奶粉的PBS液中于37℃下封闭1h,因蛋白分布的部位不同,皮质检测AQP2,髓质检测 BSC1,PBS冲洗后加入一抗(AQP2 1∶200,BSC1 1∶500)放置在摇床上4℃过夜,PBST洗膜后加入二抗(羊抗兔,稀释度1:10000)孵育1h,加入PBS洗膜后扫描照相。
2 结果
2.1 尿量和尿比重改变 见表1。
表1 失血性休克损伤术前和术后24h尿比重及尿量变化(n=8,±s)
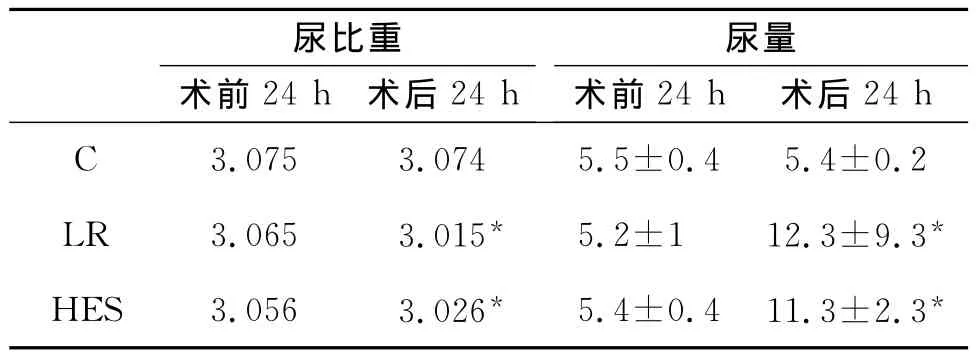
表1 失血性休克损伤术前和术后24h尿比重及尿量变化(n=8,±s)
*与术前比较P<0.05。
?
2.2 血清BUN和Cr变化 见表2。
表2 失血性休克损伤术前和术后24hBUN和Cr变化(n=8,±s)

表2 失血性休克损伤术前和术后24hBUN和Cr变化(n=8,±s)
*与术前比较P<0.05。
?
2.3 肾组织形态学改变见图1,C组:肾单位结构完整,肾小球和肾小管未见明显异常;LR及HES组:肾小球轻度淤血,间质充血水肿,少量肾小管上皮细胞水肿,空泡变性,刷状缘扁平、皱缩、少量核深染、裸露,有少量中性粒细胞侵润。肾小管Paller评分:与C组相比,HES组和LR组评分均显著增加(P<0.05)。但 HES组和LR组间无差异(P>0.05),见图2。

图1 肾组织形态学改变(HE×400)

图2 肾小管Paller评分,*与C组比较P<0.05,#与LR组比较P>0.05)。
2.4 肾组织AQP2,BSC1免疫组化结果 见图3、4,肾脏集合管细胞膜和髓袢升支粗段细胞膜有棕黄染色,分别为AQP2和BSC1表达。与C组比较,LR组和HES组BSC1、AQP2在肾脏缺血-再灌注损伤后染色较浅,HES组染色深于LR组。
2.5 肾组织AQP2,BSC1蛋白表达变化 Western blot结果示见图5,AQP2的分子量位于29kDa和35-50kDa的蛋白带,BSC1的分子量位于42kDa的蛋白带。GAPDH的分子量位于45kDa的蛋白带。与C组比较,LR组和HES组AQP2,BSC1表达显著下调,HES组表达高于LR组。
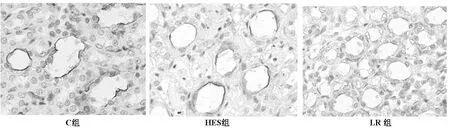
图3 肾脏内髓部集合管AQP2的表达

图4 肾脏髓袢升支粗段BSC1表达

图5 Western blot法检测蛋白表达,*与C组比较P<0.05,#与LR组比较P<0.05。
3 讨论
严重创伤易导致急性失血休克,失血量达30%就可能危及患者的生命,严重失血性休克后短期内不积极救治死亡率达32.6%-59.5%[3]。目前休克后复苏液体主要有晶体液和胶体液,由于晶体液和胶体溶液均不具备携氧能力,且缺乏血小板和凝血因子,如果不复合输注血制品,两种液体的输注量必然增大,进而引起凝血功能障碍,离子紊乱及加重肾功能障碍。以往的研究多为不复合输血[1,4],其结果不符合临床实际,参考价值大大降低。本研究选择了临床常用的复合输血输液方案,进行了不同方案差异的比较。
水通道蛋白是与水通透有关的细胞膜转运蛋白,迄今已从哺乳动物中鉴定的水通道共有13种(AQP0~12)[5],它们分布于不同的组织器官中,分别介导不同类型细胞膜的跨膜水转运。AQP2只存在于肾脏,是肾脏集合管上皮细胞调节集合管对水通透性的主要水通道蛋白[6]。由于肾脏钠水重吸收常为偶合过程,BSC1具有回吸收 Na+、Cl-、K+的功能,并参与尿液浓缩的过程[2],二者在肾脏缺血-再灌注损伤后表达显著减低,与缺血时间呈正相关[7],其与失血性休克继发的肾脏损伤的关系值得关注。
BUN、Cr是判定肾功能损伤严重程度的重要指标,能够直接反映肾细胞的受损情况。与对照组相比,失血性休克补液后,两组大鼠都出现了BUN、Cr明显升高,尿比重升高等肾功能障碍的表现,与肾细胞上皮细胞病理改变相吻合,而两组间病理改变没有差异。本研究同时显示,失血性休克补液后,BSC1、AQP2表达下调,这表明BSC1、AQP2在失血性休克所致肾损伤中起着非常重要的作用。结果与Basile法[8]夹闭肾动脉所致肾缺血再灌注损伤模型的结论相类似,提示两种模型的损伤机制和研究结论可以相互借鉴。
两种输血输液方案间对比,常规的肾功能指标及病理损伤没有差异。但HES组与林格组相比,BSC1、AQP2下降程度有所减低,提示二者可能是肾脏损伤的更为敏感的指标,而HES组比林格组在该方面的优势,可能与HES可稳定内皮细胞膜,抑制中性粒细胞的黏附,维持循环稳定作用更为持久有关[9]。故提示临床工作中对重度失血性休克的病人,可以更多的选择HES与血制品一起使用。
[1]李 涛,刘良明,刁有芳,等.不同液体对失血性休克大鼠复苏效果的影响[J].第三军医大学学报,2009,31(6):467.
[2]Wang W,Kwon TH,Li C,et al.Reduced expression of Na-K-2Cl cotransporter in medullary TAL in vitamin D-induced hypercalcemia in rats[J].Am J Physiol Renal Physiol,2002,282(1):33.
[3]刘良明,胡沛红.严重创伤休克的液体复苏新进展[J].中国危重病急救医学,2003,15(5):314.
[4]于帮旭,刘佳宁,李 堃,等.延迟液体复苏对失血性休克大鼠炎性反应的影响[J].实用医学杂志,2008,24(13):2214.
[5]Noda Y,Sasakis S.Molechlar mechanisms and drug development in aquaporin water channel disease molecular mechanism of water channel aquaporin-2trafficking[J].Pharmacol Sci,2004,96(3):249.
[6]Loffing J,Macher A.Localization of epithelial sodium channel and aqpuaporin-2in rabbit kidney cortex[J].AmJ Physiol Renal Physiol 2000,278(4):F530.
[7]Kim GH,Ecelbarger C,Knepper MA,et al.Regulastion of thick ascending limb ion transporter abundance in response to altered acid/base intake[J].J Am Soc Nephrol,1999,10(5):935.
[8]Basile DP,Dono hoe D,Cao X,et al.Resistance to ischemic acute renal failure in the Brown Norway rat:a new model to study[J].Cytoproection Kidney Int,2004,65(6):2201.
[9]Neff TA,Doelberg M,Jungheinrich C,et al.Repetitive large dose infusion of the novel hydroxyethyl starch130/0.4in patients with severe head injury[J].Anesth Analg,2003,96(5):1453.

