超高效液相色谱-串联质谱法检测清瘟败毒散中非法添加金刚烷胺的研究
刘雪红,董紫凌,韩凤丽,郑 洁,马慧楠,宋 平,田晓玲
(1.大连市兽药饲料监察所,辽宁大连116037;2.辽宁省兽药饲料监察所,沈阳110000)
金刚烷胺(Amantadine),又名三环癸胺、三环葵胺,为一种对称的三环状胺,分子式:C10H17N,分子量:151.25[1]。它可以抑制病毒穿入宿主细胞,并影响病毒的脱壳,抑制其繁殖,起治疗和预防病毒性感染作用,是最早用于抑制流感病毒的抗病毒药。国内主要将金刚烷胺用于鸡、猪流感的预防和早期治疗,以及猪传染性胃肠炎的防治。金刚烷胺作为人用抗病毒药移植兽用,缺乏科学规范、安全有效试验数据;用于动物病毒性疫病会给动物疫病控制带来不良后果,影响国家动物疫病防控政策的实施[2];在动物性食品中的残留对人体具有潜在危害,使中枢神经系统受刺激或中毒,严重者出现充血性心力衰竭。2005年农业部第560号公告规定禁止生产、使用金刚烷胺兽用原料药及其制剂。金刚烷胺因其良好的治疗和预防病毒性感染作用,常被添加到一些兽用中药制剂中,以增加中药制剂的治疗效果,并且针对清瘟败毒散中非法添加金刚烷胺的检测方法未见报道,因此,本文对该检测方法进行了研究。
1 材料与方法
1.1 仪器与设备 电子天平RD-200,德国Sartorius公司;超声波清洗机;离心机RJ-TDL-40B;涡旋振荡器;XEVO TQ-S ACQUITY UPLC超高效液相色谱-串联质谱仪,配置电喷雾离子源,美国Waters公司;色谱柱 BEH C18 2.1 mm×100 mm,1.7 μm,Waters公司。
1.2 药品与试剂
1.2.1 标准品 金刚烷胺 00001381-1951,含量99.0%,北京振翔公司;盐酸金刚烷胺,批号100426-200301,含量99.0%,中国药品生物制品检定所。
1.2.2 供试品
1.2.2.1 阴性对照散剂 清瘟败毒散:本溪嘉德生物科技有限公司,经检测不含金刚烷胺。
1.2.2.2 阳性添加散剂 分别按照1、5、10 mg/g的比例在阴性对照散剂中添加金刚烷胺标准品(盐酸金刚烷胺标准品),混匀。
1.2.3 试剂 甲醇色谱纯、甲醇分析纯、甲酸分析纯、水为符合GB/T 6682-1992规定的一级水。
1.2.4 标准贮备液的配制 准确称取金刚烷胺标准品25 mg,以甲醇定容至25 mL,混匀,即为1000 μg/mL的标准贮备液;-25℃保存,有效期为3个月。
1.2.5 标准工作液配制 精密量取1.2.4项下标准贮备液1 mL置100 mL容量瓶中,以甲醇定容至刻度。混匀,制成浓度为10 μg/mL的标准工作液。
1.2.6 提取液配制 甲醇 ∶水=50∶50。
1.2.7 稀释液配制 甲醇∶水∶甲酸=10∶90∶0.2。
1.3 测定方法
1.3.1 样品处理 精密称取中兽药散剂1 g,置于100 mL聚乙烯离心管中,加提取液50 mL,超声10 min,离心 5 min(4000 r/min);精密移取上清液1 mL加提取液,定容至100 mL;精密移取1 mL加稀释液1.2.7,定容至100 mL,过0.22 μm滤膜后供测定用。
1.3.2 液相色谱条件 柱温:30℃,进样量:5 μL,梯度洗脱程序见表1。
1.3.3 质谱条件 离子扫描方式:正离子,检测方式:多反应监测,雾化器压力:7.0 Bar,干燥气流量:850 L/h,干燥气温度:550 ℃,毛细管电压:3000 V。
定性、定量离子对和锥孔电压及碰撞能量见表2。

表2 定性、定量离子对和锥孔电压及碰撞能量
1.3.4 标准曲线绘制 精密量取标准工作液1.2.5逐级稀释,以稀释液1.2.7定容配制成浓度分别为0.05、0.2、1、5、25 ng/mL 标准曲线溶液,混匀后上机测定。
2 结果
2.1 标准曲线 以特征离子质量色谱峰面积为纵坐标,标准工作液浓度(ng/mL)为横坐标,绘制标准曲线,药物的回归方程为y=64+96230x,相关系数R2=0.9998。从回归方程及相关系数可以看出金刚烷胺在0.05~25 ng/mL的范围内线性关系良好。
2.2 检测限和定量限 阴性对照散剂按1.3.1的方法步骤处理后,测定结果表明,在相应的保留时间,空白试料对所测药物无干扰。空白基质谱图见图1。 添加 1000 μg/mL 金刚烷胺标准溶液 100 μL于1 g空白试料中,经提取后测定,金刚烷胺的信躁比均 S/N>10,表示方法的定量限为 0.1 mg/g。 添加1000 μg/mL金刚烷胺标准溶液 25 μL 于1 g空白试料中,经提取后测定,金刚烷胺的信躁比均S/N>3,表示方法的检测限为 0.025 mg/g。

图1 空白基质谱图
2.3 精密度试验 取1 ng/mL金刚烷胺标准工作液重复进样6次,每次5 μL,记录峰面积,计算相对标准偏差RSD,结果如表3所示。结果表明6次重复进样的RSD为0.2%,外标法测定金刚烷胺具有良好的重现性。1 ng/mL标液中金刚烷胺特征离子质量色谱图见图2。
2.4 回收率及重复性试验 采用标准添加法,在空白试料中添加 3 个不同浓度(1、5、10 mg/g)金刚烷胺进行回收率试验,各浓度进行5个样品平行试验,重复3次,求批内、批间相对标准偏差,结果见表3。从表中试验结果可以看出本方法的回收率为86.9%~95.2%,批内、批间相对标准偏差均小于3.8%。

图2 金刚烷胺特征离子质量色谱图
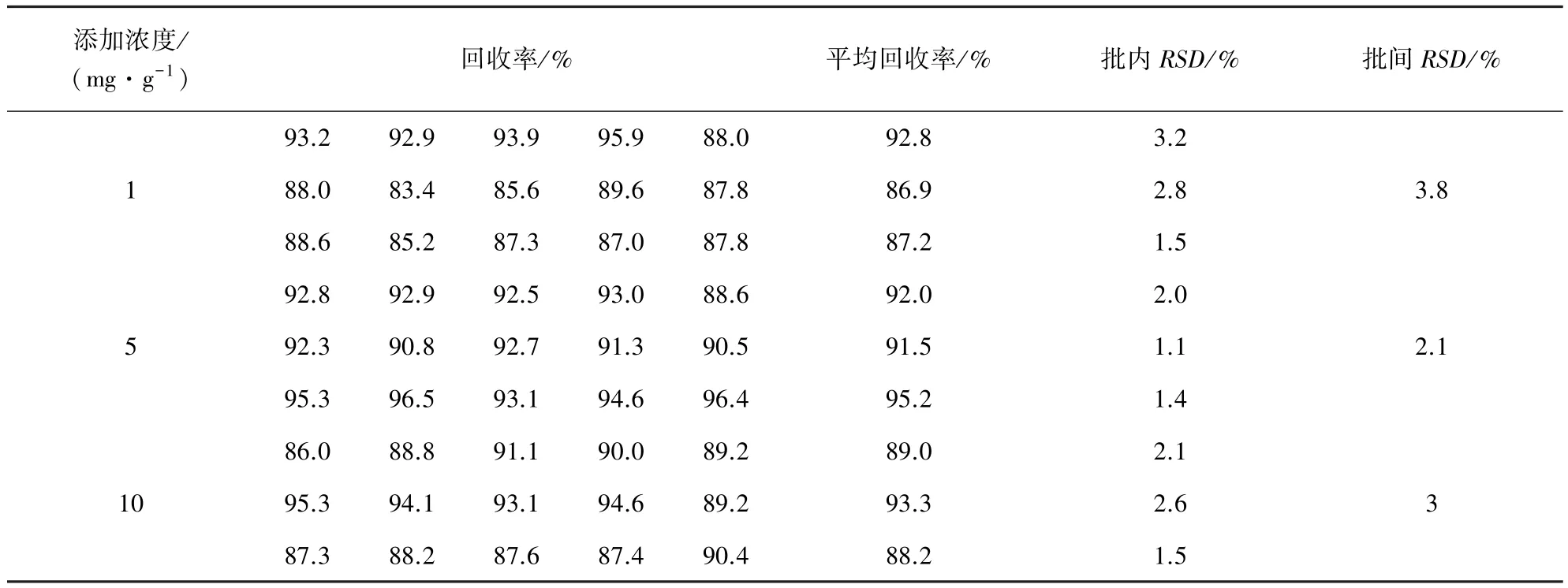
表3 添加不同浓度金刚烷胺回收率及重复性试验结果 (n=5)
2.5 稳定性试验 取上述2.4项下制备的供试液,分别于 0、2、4、6、8、12、24 h 进样测定,记录峰面积。结果表明,样品溶液在24 h稳定性良好。
3 讨论与小结
3.1 检测方法的选择 金刚烷胺的分子结构缺少生色基团,且由于结构中有伯胺基而不易挥发,文献中多采用柱前衍生化后GC测定,其中的衍生化过程复杂费时[3]。HPLC-放射免疫法,专属性较低[4]。容量分析法,无论是以高氯酸为滴定溶液的非水滴定法[1]或以氢氧化钠为滴定溶液的双相滴定法[5],均以溶液颜色变化指示终点,而中药散剂配成溶液,本身颜色较深,干扰测定。本文采用的LC/MS/MS法,灵敏度高、选择性强;且在该色谱条件下,不到3 min便可将样品中的金刚烷胺检测,测试快速,分析周期短。
3.2 提取溶剂的选择 根据盐酸金刚烷胺溶于水而金刚烷胺溶于有机溶剂的性质,考虑到非法添加物是原料药盐酸金刚烷胺或金刚烷胺,采用50%的甲醇水溶液,两种原料药均可完全溶解,保证添加物质提取完全。
3.3 样品处理方法的选择 中药散剂与肌肉、肝、血液等样品相比,无蛋白及脂肪的干扰,无需过固相萃取柱净化[6-7]。且中兽药散剂添加量较大,无需浓缩。按本文方法处理样品,无基质干扰,方法简单、快速,回收率高。
3.4 添加回收率试验浓度的选择 根据此中兽药散剂在预防和治疗畜禽的用量及临床中金刚烷胺的预防和治疗的用量,选择添加1、5、10 mg/g金刚烷胺作为添加回收试验浓度,符合非法添加的实际情况,测定回收率及相对标准偏差。
3.5 中兽药散剂种类的选择 清瘟败毒散具有清热解毒、泻火凉血、抑菌抗病毒等功效。用于治疗禽流行性感冒、传染性法氏囊炎、新城疫、传染性喉气管炎、传染性支气管炎等。金刚烷胺可以抑制病毒穿入宿主细胞,并影响病毒的脱壳,抑制其繁殖,起治疗和预防病毒性感染作用,在畜禽养殖中极可能被添加到中兽药散剂中增强抗病毒疗效。故选清瘟败毒散作为检测对象。
本研究确立的用超高效液相色谱-串联质谱技术,可检测兽用中药制剂清瘟败毒散中非法添加的金刚烷胺。检测限及定量限均能满足要求。样品处理简单,快速,检测方法准确、可靠。
[1]国家药典委员会.中华人民共和国药典二○○五年版二部[S].
[2]中华人民共和国农业部第560号[S].
[3]Sioufi A, Pommier F.Gas chromatographic determination of amantadine hydrochloride in human plasma and urine[J].ChromatograB,1980, 183(1): 33.
[4]Midha K K ,Rauw G,Mckay,et al.Subnanogram quantitation of chlorpheniramine in plasma by a new radiocommanoassay and comparison with a liquld chromatographic method [J].Jpham Sci.1984,73(8):1144.
[5]涂 琼,吴澄清,卢庆红.双相滴定法测定金刚烷胺合剂的含量[J].儿科药学杂志,2004, 10 (4):45-46.
[6]李士敏,王 玮.液相色谱-质谱联用法测定大鼠血浆中盐酸金刚烷胺浓度及体内药动学研究[J].药物分析杂志,2007,01:66-68.
[7]DB32/T 1163-2007鸡肝中金刚烷胺残留量的测定-液相色谱-串联质谱法[S].

