UPLC-MS/MS法检测动物性食品中肝脏、肾脏组织氯霉素残留量
薄永恒,高迎春,陈 玲,陆庆泉,张呈军,魏秀丽
(1.山东省兽药质量检验所,济南250022;2.山东省畜产品质量安全监测与风险评估重点实验室,济南250022)
氯霉素由Ehrlich等在1947年从委内瑞拉链丝菌的培养液中提取获得,现在基本使用化学合成法大量生产,已广泛用于动物各种传染性疾病的治疗,对各类家禽、家畜、水产品及蜂蜜制品各种传染性疾病的控制和治疗起重要作用。由于氯霉素还可与人体线粒体的70S结合,因而也可抑制人体线粒体的蛋白合成,对人体产生毒性。氯霉素在动物性食品中的残留对人类健康可以造成严重危害,主要表现在以下几个方面[1]:(1)引起骨髓造血机能紊乱;(2)对早产儿和新生儿产生蓄积毒性;(3)引起胃肠道症状及口部炎症;(4)其他不良反应可引起视神经炎、视力障碍、多发性神经炎、神经性耳聋以及严重失眠,有时发生中毒性精神病。基于以上危害,世界各国都对其做出了严格规定,严禁氯霉素在食源性动物上使用,欧盟规定动物源食品中氯霉素残留的最低要求执行限(MRPL)为0.3 μg/kg。我国农业部235号公告中把氯霉素列为禁用药物[2]。
资料显示[3-4],氯霉素在动物的肌肉组织中主要以原形药代谢,而在肝脏、肾脏多以氯霉素(CAP)、氯霉素葡萄糖酸苷(CAPG)和Hyocroxyam-酰胺醇类(HAP)及葡萄糖酸苷结合物等形式代谢。虽然已有相关氯霉素残留检测的国家标准以及其他行业标准,但由于农业行业标准的781号公告-2-2006的检测动物组织项目不足,特别是基于氯霉素在肝脏、肾脏代谢规律的以上新研究发现,本项目组根据农业部农业行业标准制定与修订[(2013)91]的要求制定了氯霉素残留在动物肝脏、肾脏的LC-MS/MS检测方法,检测方法快速、准确,可以满足大批量样品高灵敏测定,以期为食品安全检测提供可靠的确证检测方法。
1 材料和方法
1.1 仪器 Acquity UPLC-Quattro Premier XETM质谱联用仪,Waters公司;Acquity UPLC BEH C18色谱柱(500mg/3cc),Waters公司;AE260电子天平,Mettler Toledo公司;SIR4漩涡混合器,IKA公司;HY-4调速多用振荡器,台式高速冷冻离心机(贝克曼公司)。
1.2 试剂 氯霉素对照品:含量≥98%(Dr.Ehrenstorfer公司);氯霉素-D5对照品:含量≥98.0%(Dr.Ehrenstorfer公司);β -葡萄糖醛酸苷酶,德国默克;甲醇、乙酸乙酯、正己烷为色谱纯(Fisher公司);氨水为分析纯;乙酸钠为分析纯;实验用水均为超纯水。
1.3 标准溶液配制
1.3.1 氯霉素标准储备液 称取10 mg氯霉素对照品,用甲醇溶解定容至100 mL,溶液浓度为100 μg/mL,-20 ℃保存,有效期1年。
1.3.2 氯霉素-D5标准储备液 称取10 mg氯霉素-D5对照品,用甲醇溶解定容至100 mL,溶液浓度为100 μg/mL,-20℃以下保存,有效期1年。
1.3.3 标准工作液 用流动相稀释适量储备液,氯霉素浓度为 0.5、1.0、2.0、5.0、10.0 ng/mL 的系列标准溶液,其中内标氘代氯霉素浓度为5 ng/mL。
1.4 实验方法
1.4.1 UPLC-MS/MS 分析条件[5]Acquity UPLC BEH C18色谱柱,流动相A相为甲醇,B相为水,梯度洗脱条件:0~3.5 min,10%A线性变化至90%;3.5~ 4.5 min,90%A线性变化至10%;4.5 ~6 min,维持 10%A。流速为 0.3 mL/min,柱温为30℃,进样量为10 μL。
电离电压为3.1 kV;源温为110℃;雾化温度为400℃;锥孔气流速为50 L/h;雾化气流速为650 L/h;多反应监测(MRM)模式采集。确定各母离子大小的氯霉素与内标的扫描图如图1所示。氯霉素的定性、定量离子对及内标氘代氯霉素离子对、离子源、锥孔电压和碰撞能量如表1所示。

图1 氯霉素与内标的扫描图
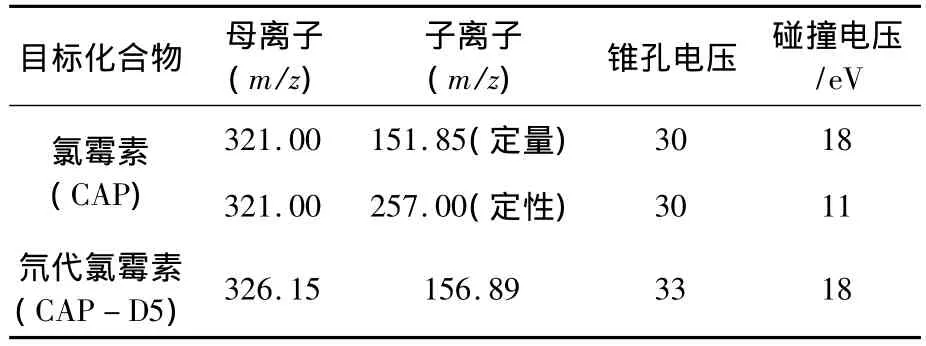
表1 氯霉素特征离子参考质谱条件
1.4.2 样品前处理
1.4.2.1 提取 准确称取(5±0.5)g均质样品,加入 20 mL 乙酸钠缓冲液(10 mmol/L),300 μL β-葡萄糖醛酸苷酶,于37℃温育过夜17 h。酶解样品中加入250 μL氯霉素-D5标准工作液,加入15 mL乙酸乙酯,充分涡旋混匀,中速水平震荡10 min,7000 r/min离心5 min,取上层有机层,旋蒸近干。依次加入正己烷、水各4.0 mL,充分涡旋,40℃水浴中静置5 min分层,取水层备用。
1.4.2.2 净化 取 C18固相萃取柱5 mL甲醇、5 mL水分别预洗,取备用液过柱,弃去流出液,用5 mL 20%甲醇水洗涤,抽干,5 mL甲醇洗脱,收集全部洗脱液,取上清液于50℃下氮气吹干,加1 mL 20%甲醇水溶液溶解,过0.22 μm微孔滤膜,上机测试。
1.4.3 标准曲线的绘制 准确量取氯霉素和氯霉素-D5的标准工作液适量,用流动相稀释,配制成氯霉素浓度为 0.5、1.0、2.0、5.0、10.0 ng/mL,氯霉素-D5作为内标浓度为5 ng/mL,供液相色谱-串联质谱测定,以标准溶液中被测组分峰面积与氯霉素-D5峰面积的比值为纵坐标,标准溶液中相应氯霉素浓度为横坐标,绘制标准曲线,求回归方程和相关系数。
1.4.4 灵敏度 在空白牛、羊、猪、鸡的肝脏、肾脏匀浆组织中分别添加氯霉素及氯霉素-D5标准溶液,分别制成0.1、0.2 μg/kg 的2 个空白添加样品,其中内标氘代氯霉素浓度为1 μg/kg,按确定的提取净化方法处理后,经UPLC-MS/MS检测,观察氯霉素色谱峰信噪比和对应的药物浓度,确定其检测限和定量限。
1.4.5 准确度与精密度 采用标准添加法,在牛、羊、猪、鸡的肝脏、肾脏的匀浆组织中添加3个不同浓度的氯霉素及氯霉素-D5进行回收率试验。各浓度进行5个样品平行试验,重复3次,求批内、批间相对标准偏差。
2 结果
2.1 标准曲线 氯霉素浓度在0.5~10.0 ng/mL范围内,色谱峰面积有良好的线性关系,标准曲线见图2。
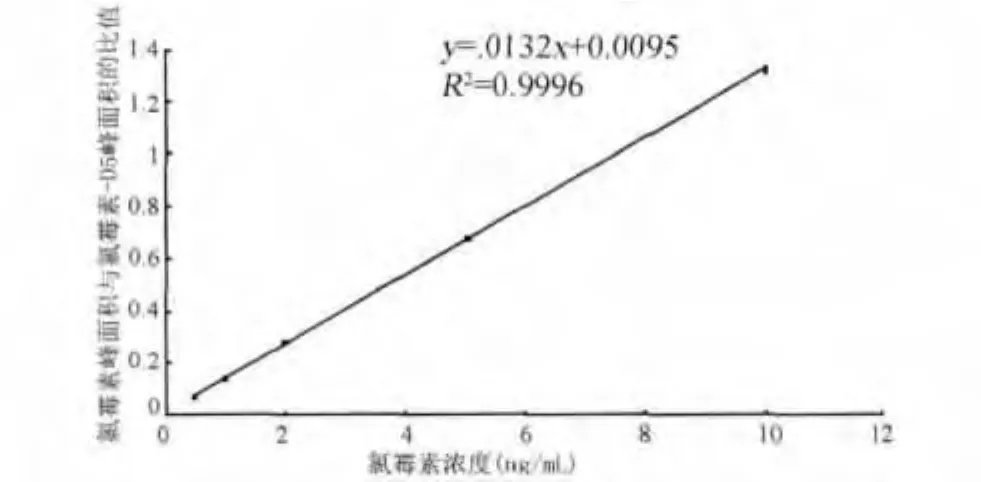
图2 氯霉素溶液的标准曲线
2.2 方法灵敏度 牛、羊、猪、鸡的肝脏、肾脏的匀浆组织按上述方法进行处理,氯霉素添加浓度为0.1 μg/kg 时,信噪比(S/N)均 >3,确定为方法的检测限,氯霉素添加浓度为0.2 μg/kg时,信噪比(S/N)均>10,确定为方法的最低定量限。其中猪肝空白组织中添加0.2 μg/kg氯霉素及相应的空白组织的离子色谱图,见图3~图4。氯霉素标准品溶液色谱见图5。

图3 猪肝空白试样离子质量色谱图
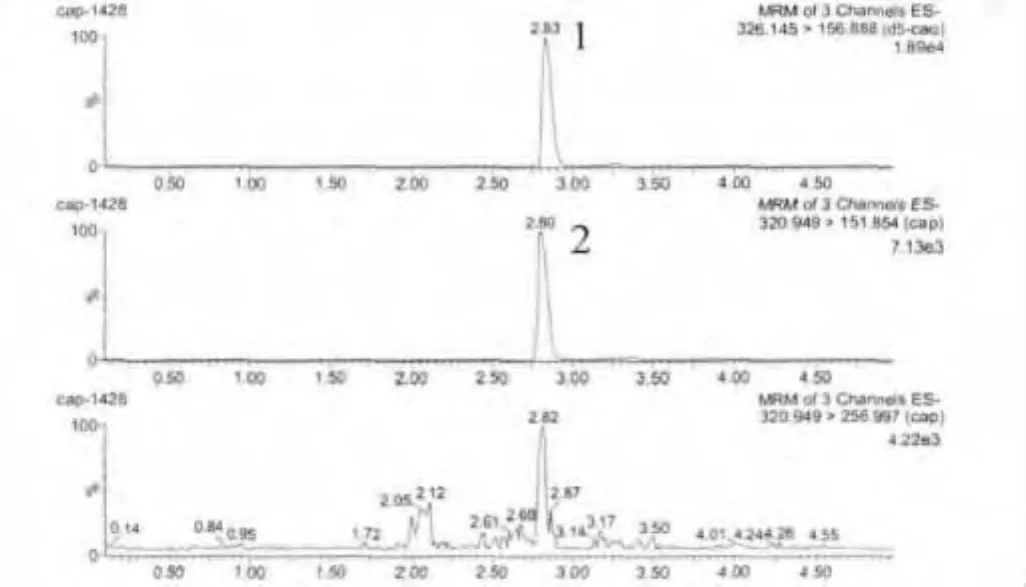
图4 猪肝空白添加氯霉素离子质量色谱图(0.2 μg/kg)
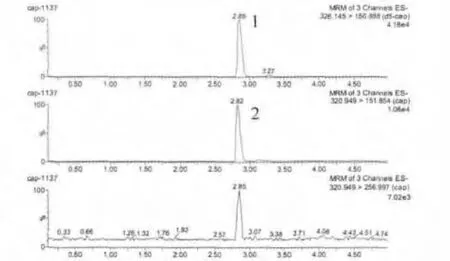
图5 氯霉素标准溶液离子质量色谱图(1 ng/mL)
2.3 方法准确度与精密度 各空白组织中在0.2、0.4、2 μg/kg 3 个不同添加浓度的氯霉素,其中内标为1 μg/kg,进行添加回收率试验,回收率为70% ~120%;本方法批内相对标准偏差≤15%,批间相对标准偏差≤20%,准确度和精密度均能满足有关法规的要求。其中猪肝中添加氯霉素的实验结果见表2。

表2 各组织中添加氯霉素的批内平均回收率、批内相对标准偏差及批间相对标准偏差
3 讨论与小结
3.1 样品前处理条件的优化 1994年Heitzman通过饲喂实验发现氯霉素在动物体内的代谢消除存在很大差异,其代谢的共同点是肌肉组织中原形药物最多,在牛和禽的肝脏组织中药物的主要残留形式是氯霉素(CAP)、氯霉素葡萄糖酸苷(CAPG)和Hyocroxyam-phenicol(HAP),猪的肾脏中多以葡萄糖酸苷结合物的形式存在[3]。因此,在提取肝脏、肾脏组织中的氯霉素时,考虑其葡萄糖酸苷结合物的存在,因此样品加入了β-葡萄糖醛酸苷酶,以酶解其形成原形药再做提取,从而使得检测结果更加接近真值。提取时采取乙酸乙酯提取,20%甲醇水饱和正己烷液液萃取净化的肉样提取方法,也可以提取到氯霉素,但是由于肝肾细胞组织提取裂解后,很多细胞成分不能有效去除,而降低了色谱柱的柱效,减少了有效使用时间,甚至直接堵塞色谱柱,因此使用C18固相萃取柱净化是必要的。
3.2 色谱方法的优化 实验中使用了ACQUITY UPLC BEH C18(1.7 μm,2.1 mm × 50 mm)色谱柱,分别使用了甲醇/水和乙腈/水系统作为流动相进行优化,发现甲醇/水液能得到良好的峰形,且具有更高的质谱响应,与已有报道的乙腈/水为流动相不同[6-8]。同时为了使基质中杂质在色谱柱中充分洗脱,在5 min的洗脱基础上,增加至6 min一个样品。
3.3 质谱方法优化 通过单针将一定浓度的氯霉素及氯霉素-D5注入离子源,在负离子检测方式下进行一级质谱分析、二级质谱分析,得到母离子及子离子信息,然后对锥孔电压、碰撞能量等参数进行优化,对离子源温度、脱溶剂气温度、脱溶剂气流量等进行优化,使样液中的离子化效率达到最佳。
本方法检测猪、牛、羊、鸡肝脏、肾脏试料中残留的氯霉素含量,用β-葡萄糖醛酸苷酶酶解后乙酸乙酯提取,C18固相萃取柱净化,液相色谱-串联质谱负离子模式测定,内标法定量,成功建立了动物性食品的肝脏、肾脏组织中氯霉素的残留检测方法。氯霉素的检测限为 0.1 μg/kg,最低定量限为0.2 μg/kg。整个实验过程简单、快速,回收率较高,适合样品动物性食品中氯霉素残留的定量检测。
[1]徐理奇,卢春香.动物食品中氯霉素类药物的残留状况及检测方法比较[J].饲料工业,2008,29(15):41.
[2]孙 雷,张 骊,王树槐,等.超高效液相色谱-串联质谱法检测动物源食品中氯霉素类药物及其代谢物残留[J].中国兽药杂志.2009,43(3):42-45.
[3]Heitzman.Residues of some veterinary drugs in animals and foods[J].FAO Food and Nutrition,1994,41(6):12 -22.
[4]孙丰云,张素霞,沈建忠,等.虾肉中氯霉素、甲砜霉素、氟苯尼考及氟苯尼考胺残留气相色谱-微电子捕获检测法[J].中国兽医杂志,2006,42(10):66-68.
[5]王树槐,门立强,孙 雷,等.高效液相色谱-串联质谱法检测猪肝组织中氯霉素残留的研究[J].中国兽药杂志,2007,41(10):18-21.
[6]Ramos M,Munoz P,A randa A,et al.Determ ination of Chloramphenicol Residues in Shrimps by Liquid Chromatography-Mass Spectrometry[J].Chromatogr B Analyt Technol Biomed Life Sci,2003,791(12):31 -38.
[7]Pfenning Allen P,Roybal Jose E,Rupp Heidi S,et al.Simultaneous Determinati on of Residues of Chloramphenicol Florfenicol Florfenicol Amine,and Thiamphenicol in Shrimp Tissue by GasCh rom atography with Electron Capture Detection[J].Journal of AOAC International,2000,83(1):26 -30.
[8]Jeffery Mvande Riet,RossA Potter,Melissa Christie Fougere,et al.Simultaneous Determination of Residues of Chloramphenico1,ThiamphenicolFlorfenicoland FlorfenicolAminein Farmed Aquatic Species by Liquid Chromatography-Mass Spectrometry[J].Journal of AOAC International,2003,86(3):510 -514.

