吉兰-巴雷综合征急性期病情严重程度及预测因素分析
李元 王爱民 唐红宇 欧阳松 段维维 王未飞
吉兰-巴雷综合征(Guillain Barre syndrome,GBS)是一种细胞免疫和体液免疫共同介导的急性炎性周围神经病,临床表现轻重不一,大部分患者起病时病情较轻,随后病情逐渐加重,甚至可能发展至不能独立行走或需要机械辅助通气。所以,在患者发病早期预测疾病发展趋势,从而进行有效的干预和治疗,对降低患者病死率有积极指导意义。国外已进行了一些相关研究,但结论尚不统一,我国多关注该病的临床特征、电生理改变及治疗措施,针对疾病严重程度预测因素的研究相对较少。本研究通过回顾性分析63例GBS患者的临床资料,旨在探讨预测疾病进展严重程度的相关因素,为干预GBS病情进展提供指导。
1 对象和方法
1.1 研究对象 收集2005-01-2012-04长沙市第一医院收治的GBS患者63例,均符合2001年GBS国际诊断标准[1]。排除标准:由重金属、农药中毒引起的多发性神经炎;合并明确颅内病变的神经炎;慢性炎症性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyneuropathy,CIDP);脊髓灰质炎;就诊时病情已明显缓解的GBS患者。
1.2 方法
1.2.1 资料收集:回顾性分析患者的临床资料,一般资料包括性别、年龄、居住地(城镇或乡村)等;临床表现如前驱事件类型(发病前3周内是否有上呼吸道感染、腹泻)、双侧面瘫、延髓功能障碍(构音障碍、吞咽困难、饮水呛咳或咽反射迟钝或消失)、自主神经功能障碍(出汗异常、皮肤潮红、手足肿胀、营养障碍、Horner征、无法解释的尿便功能障碍、不明原因的心率或血压的异常波动)和周围神经轴索损伤等;生化免疫指标如病情达高峰前的脑脊液(CSF)蛋白水平、外周血单核细胞百分比、纤维蛋白原(Fib)、T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)检测结果。
1.2.2 病情等级评定:根据患者发病高峰期的病情,参考Hughes评分标准进行病情等级评估:0分,正常,无神经功能缺损;1分,轻度的症状和体征,可进行一般的体力劳动;2分,无需辅助下能够行走;3分,需辅助下行走;4分,需借助轮椅或卧床;5分,需机械通气;6分,死亡。评分为0~2分者为轻型患者,3~6分为重型患者。发病高峰的界定:患者四肢肌力评分降至最低或开始气管插管或气管切开。
1.2.3 四肢肌力评分:采用英国医学研究理事会(medical research council,MRC)标准评分[2]:根据双侧肩外展、前臂屈曲、腕伸展、大腿屈曲、膝伸展、足背屈6组肌群的肌力进行评分,每组肌群的肌力按0~5级评定,评分从0分(完全麻痹)~60分(正常)。
1.2.4 电生理结果判断:具备脱髓鞘电生理表现,如运动、感觉神经传导速度减慢,远端潜伏期延长,F波潜伏期延长,有确切的波形离散等指标。若同时伴有运动诱发电位波幅明显下降则考虑为伴有轴索损伤。
1.3 统计学处理 采用SPSS13.0进行统计学分析。计数资料以率表示,采用χ2检验或确切概率法;计量资料用均数±标准差表示,采用t检验或秩和检验,以P<0.05为差异有统计学意义。预测因素的筛选用Logistic回归模型后退法,检验水准α=0.05。
2 结果
2.1 临床特征比较 63例GBS患者中男38例(60.3%),女25例(39.7%),发病年龄19~62岁,平均 (36.5±11.5)岁。年 龄 ≥50 岁 者 22 例(34.9%)。重型患者41例(65.1%),轻型患者22例(34.9%),两组间年龄≥50岁比例、腹泻、双侧面瘫、延髓功能障碍、自主神经功能障碍、轴索损伤比较差异有统计学意义(P<0.05),余指标两组间比较无统计学差异(表1)。
2.2 生化免疫指标比较 结果见表2。轻型组和重型组外周血单核细胞百分比、CSF蛋白、CD8+T细胞及CD4+/CD8+值比较差异有统计学意义(P<0.05)。CD3+T、CD4+T细胞、Fib在两组间比较无统计学差异。

表1 轻型与重型GBS患者临床特征比较 〔n(%)〕
表2 轻型与重型GBS患者生化免疫指标比较 ()

表2 轻型与重型GBS患者生化免疫指标比较 ()
注:与轻症组相比,*P<0.05;△表示例数有缺失,轻症患者行淋巴细胞亚群检测11例,重症患者24例
分组 例数 单核细胞(%)CSF蛋白(g/L) Fib(g/L) T淋巴细胞亚群△CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+轻症组 226.73±0.570.64±0.214.52±0.6271.32±5.2139.57±9.1630.24±5.361.24±0.45重症组 418.59±0.42* 0.91±0.33* 4.85±0.4773.53±6.3341.15±9.5327.35±8.11* 1.59±0.21*
2.3 重型GBS的多因素Logistic回归分析 将上述9个因素作为变量进行多因素Logistic回归分析,最终筛选出6个预测因素:腹泻、延髓功能障碍、自主神经功能障碍、轴索损伤、CSF蛋白升高程度、CD4+/CD8+值增高。模型预测的准确率达80.6%。具体结果见表3。
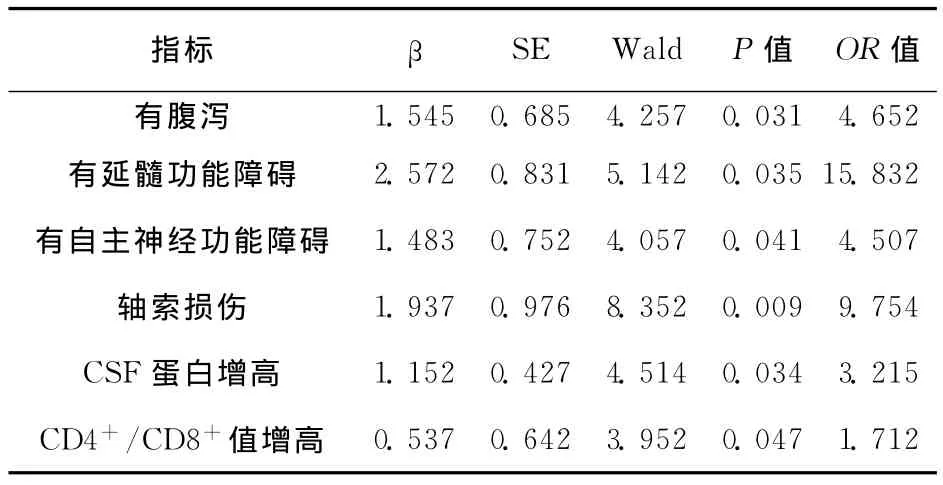
表3 重型GBS多因素Logistic回归分析
3 结论
GBS主要表现为对称性迟缓性肢体肌肉无力,部分患者有四肢远端感觉障碍和自主神经功能障碍,严重者发生呼吸肌麻痹、心律失常,甚至猝死,临床症状多在2周左右达高峰,其死亡率约5%[3]。因此,了解GBS重型病例的相关危险因素,早期进行积极的干预和治疗,可有效地降低GBS的致残率和病死率。
本研究分析了GBS临床特征与病情严重程度的关系,结果显示:急性期重型患者≥50岁者较多,病前多有腹泻史,易出现延髓功能障碍、自主神经功能障碍等,与轻症患者相比,外周血单核细胞百分比、CSF蛋白、CD4+/CD8+值增高更明显,且周围神经轴索损伤较严重;进一步进行多因素Logistic回归分析发现,前驱腹泻史、延髓功能障碍、自主神经功能障碍、周围神经轴索损伤、CSF蛋白升高、CD4+/CD8+值增高可能是急性GBS患者病情进展至重型患者有意义的临床预测因素。
该研究结果亦显示,具有延髓功能障碍的GBS患者在重型组占43.9%,远高于轻型组13.6%,延髓功能障碍使GBS患者发展为重型的几率增加14.832倍。Lawn等[4]回顾性研究结果显示有延髓功能障碍的患者发展至重型的风险增加16.5倍。其可能原因为咽喉肌麻痹使患者吞咽、咳嗽及清除呼吸道分泌物能力下降,容易引起肺部感染,加重病情,甚至诱发呼吸衰竭。
GBS出现自主神经功能障碍往往预示病情较重,病程较长。有研究[4]结果表明自主神经功能障碍是发展至重型GBS的相关因素。本研究结果亦显示:重型GBS出现自主神经功能障碍的几率为31.7%,远高于轻型组的13.6%;患者如有自主神经功能障碍,发展至重型的几率增加3.507倍。其可能原因为:(1)出现自主神经功能障碍的患者提示免疫损伤部位可能更为广泛;(2)尿便障碍易继发感染致抵抗力下降,增加病情进展的几率;(3)心律失常及体位性低血压等心血管功能障碍可直接导致患者死亡。相关文献报道3%~14%的GBS患者死于反复发作的心血管功能障碍[5]。
关于轴索损害是否与重型GBS相关,众多研究结果不尽相同。本研究经Logistic回归分析提示:有轴索损害者病情发展至重型是无轴索损害者的9.754倍。Durand等[6]研究显示脱髓鞘型GBS在需要机械辅助呼吸的患者中比例高于无需辅助呼吸者。因此,可能存在两种不同的病理机制导致轴索型患者的病情严重程度不同:重型者前根轴突损害严重,恢复困难;轻型存在抗体对于轴膜上神经节苷脂的直接攻击及巨噬细胞对郎飞结的侵犯,为可逆性损害[7]。另外,本研究结果还提示发病前有感染腹泻者易发展至重型GBS,这可能与该类患者以轴索损害型居多有关。
目前,GBS患者CSF蛋白含量升高的机制尚不十分不清,可能机制为:GBS早期钠通道阻滞因子QYNAD和干扰素γ(IFN-γ)明显升高,诱导CSF蛋白产生增多[8];GBS早期神经根水肿、神经周围间隙狭窄及阻塞导致CSF循环障碍。本研究Logistic回归分析显示,CSF蛋白升高的GBS患者发展至重型的几率要增加3.215倍。其可能原因是该类患者神经根损伤较重,并且免疫炎性反应强烈,炎性反应细胞因子如IL-6、肿瘤坏死因子-2(TNF-2)产生增加,其中TNF-2可选择性地损害周围神经髓鞘,导致轴索的最终破坏[9]。所以GBS患者病情严重程度与CSF蛋白含量呈正相关,CSF蛋白越高,致残率越高。
在GBS发病机制中,T淋巴细胞及其亚群的激活是一个重要环节:CD4+T细胞可导致B淋巴细胞克隆增殖并转化为浆细胞,继而产生攻击髓鞘的抗体;激活的CD4+T细胞还可释放一系列细胞因子(IL-2,IFN-γ等),趋化巨噬细胞到达病变组织;但CD8+细胞能抑制针对自身抗原反应的细胞浸润,并可通过调节CD4+细胞产生的可溶性辅助因子来抑制B细胞,因此当具有抑制B细胞功能的CD8+细胞减少时,免疫促进作用占优势,使得对髓鞘抗原的自身免疫反应的抑制作用减弱,体液免疫功能亢进,B细胞产生抗神经抗体增多,致GBS发病并使病情加重。本研究结果提示:重型GBS患者急性期外周血淋巴细胞亚群紊乱更明显,与轻型GBS患者相比,重型患者CD8+T细胞偏低,CD4+/CD8+值增高,差异有统计学意义,同时CD4+/CD8+值增高的GBS患者发展至重型的几率增加0.712倍,表明CD4+/CD8+值增高对重型GBS有一定预测意义。但本研究样本例数偏少,其能否真正反映GBS患者病情严重程度有待进一步探讨。
van Koningsveld等[10]研究发现,年龄小于50岁、前驱感染较少的男性患者易表现为轻型,发病年龄≥50岁、男性及合并有并发症等多见于重型患者。这可能与老年人免疫调节机制较差、易患各种疾病有关。本研究发现:年龄≥50岁者在重型组占41.5%,高于轻型组,但经Logistic分析并未显示其对重型GBS有预测意义,这可能与本研究病例数较少、年龄构成比与既往研究不同有关。
综上所述,本研究发现有前驱腹泻感染史、延髓功能障碍、自主神经功能障碍、周围神经轴索损伤、CSF蛋白升高、CD4+/CD8+值增高等对重型GBS有预测意义。了解这些预测因素,有助于临床医生在疾病的进展期密切观察临床表现,较好地把握病情的发展趋势,早期开展有效的干预和治疗措施,降低致残率和病死率。
[1]Van der Meche FG,Van Doorn PA,Meulstee J,et al.Diagnostic and classification criteria for the Guillain-Barreésyndrome[J].Eur Neurol,2001,45(3):133-139.
[2]Kleyweg RP,van der MechéFG,Schmitz PI.Interobserver agreement in the assessment of muscle strength and functional abilities in Guillain-Barrésyndrome[J].Muscle Nerve,1991,14(11):1103-1109.
[3]Sejvar JJ,Baughman AL,Wise M,et al.Population incidence of Guillain-Barrésyndrome:a systematic review and meta-analysis[J].Neuroepidemiology,2011,36(2):123-133.
[4]Lawn ND,Fletcher DD,Henderson RD,et al.Anticipating mechanical ventilation in Guillain-Barrésyndrome[J].Arch Neurol,2001,58(6):893-898.
[5]Flachenecker P.Autonomic dysfunction in Guillain-Barrésyndrome and multiple sclerosis[J].J Neurol,2007,254(Suppl 2):96-101.
[6]Durand MC,Porcher R,Orlikowski D,et al.Clinical and electrophysiological predictors of respiratory failure in Guillain-Barrésyndrome:aprospective study[J].Lancet Neurol,2006,5(12):1021-1028.
[7]Hughes RA,Cornblath DR.Guillain-Barrésyndrome[J].Lancet,2005,366(9497):1653-1666.
[8]Padmashri R,Chakrabarti KS,Sahal D,et al.Functional characterization of the pentapeptide QYNAD on rNav1.2 channels and its NMR structure[J].Pflugers Arch,2004,447(6):895-907.
[9]Lu MO,Zhu J.The role of cytokines in Guillain-Barrésyndrome[J].J Neurol,2011,258(4):533-548.
[10]van Koningsveld R,Van Doorn PA,Schmitz PI,et al.Mild forms of Guillain-Barrésyndrome in an epidemiologic survey in the Netherlands[J].Neurology,2000,54(3):620-625.

