TNF-α基因-238位点单核苷酸多态性与宫颈癌以及HPV感染的关系
尉春艳,彭慧霞,张 熙,孙学军,张 菊,高艳娥
(1西安交通大学医学院第二附属医院妇产科,西安710004;2西安交通大学医学院第一附属医院普外科;3西安交通大学医学院第二附属医院神经外科;4第四军医大学基因诊断技术研究所;*通讯作者,E-mail:weichy1023@163.com)
宫颈癌(cervical cancer)是女性生殖系统最为常见的恶性肿瘤之一,在发展中国家的妇女癌症死因中占88%[1]。自20世纪80年代以来,人乳头瘤病毒(human papillomavirus,HPV)与宫颈癌的关系越来越明确[2],世界卫生组织已经于1996年确认HPV是宫颈癌的主要病因。但是HPV感染并不是宫颈癌的唯一致病原因,70%以上的HPV感染具有一过性,病毒可在6-8个月内被清除,只有大约20%的高危型HPV感染会长期持续存在,导致浸润性宫颈癌的发生,HPV感染的持续化与宫颈癌发生的危险性增高有关[3]。因此,有效的免疫环境能够监视并清除HPV感染,减少宫颈癌的发生。基因差异可影响机体免疫反应,可能决定了宫颈癌变的危险性大小。
肿瘤坏死因子α(tumor necrosis factorα,TNF-α)是一种多效性的免疫因子,在病毒的免疫清除中具有重要作用[4],TNF-α基因的单核苷酸多态性(single nucleotide polymorphism,SNP)具有生物学上的重要性,可以影响TNF-α的产量和活性,从而可能从基因水平影响疾病的易感性。本实验采用模板介导的染料终止物掺入-荧光偏振检测(TDI-FP)的方法研究探讨了TNF-α基因-238位点的单核苷酸多态性与宫颈癌以及HPV感染的关系。
1 材料与方法
1.1 组织标本
宫颈癌患者58例,平均年龄(46.8±9.7)岁,主要来源于西安交通大学医学院第一、二附属医院、陕西省肿瘤医院妇科,其中原位癌8例、Ⅰ期14例、Ⅱ期27例、Ⅲ-Ⅳ期9例;对照组22例,平均年龄(42.7±7.2)岁,包括11例宫颈炎和11例正常宫颈者,其中1例宫颈炎标本因取样少无法检测多态性予以剔除,宫颈炎标本均经过临床确诊且巴氏涂片检查未见癌变迹象;正常宫颈组织来源于因非恶性肿瘤原因行子宫全切而且术后病理检查确诊无宫颈癌变的宫颈组织。
1.2 主要试剂、仪器
TaqDNA聚合酶、T4 DNA连接酶(大连TaKaRa公司);Wizard® PCR Preps DNA Purification System、pGEM®-T Easy Vector SystemⅠ(美国Promega公司);GenEluteTMPlasmid Miniprep Kit(美国Sigma公司);DH5α菌株(第四军医大学全军基因诊断研究所提供);96微孔板(美国MJ Research公司);PCR扩增仪、荧光偏振检测仪、荧光偏振检测试剂盒(美国PerkinElmer公司)。根据GenBank收录的TNF-α基因序列设计包含TNF-α-238位点的引物和 TDI探针,扩增片段长189bp,P1:5’-gttagaaggaaacagaccacagacc-3’,P2:5’-ggacacacaagcatcaaggataccc-3’,TDI探针:5’-aagacccccctcagaatc-3’,P2:5’-tccccatcctccctgctc-3’,由上海生工生物技术有限公司合成。
1.3 阳性对照的建立
用酚/氯仿法粗提 DNA,测 OD 值,取 5.0μl DNA,加入上、下游引物各 1.0 μl,0.5 μl Taq 聚合酶,2.5 μl MgCl2,1.5 μl dNTPs,2.5 μl 10×Buffer,11.0μl双蒸水,按照以下扩增条件:95℃ 5 min;94℃ 30 s,54 ℃ 40 s,72 ℃ 30 s,总共 35 个循环,72℃ 10 min进行PCR基因扩增,取10μl PCR反应产物进行1.5%的琼脂糖凝胶电泳,参照 Wizard®PCR Preps DNA Purification System核酸纯化试剂盒说明书回收DNA片段。取3.0μl回收产物,1.0μl T4 DNA连接酶,1.0μl pGEM-T载体,2×T4连接酶缓冲液5.0μl,参照pGEM®-T Easy Vector SystemⅠ试剂盒说明书进行连接反应。5.0μl的连接产物与100μl的DH5α感受态细菌混合培养过夜,连续收集共10 ml菌液的菌体,参照 GenEluteTMPlasmid Miniprep Kit质粒提取试剂盒说明书提取质粒DNA,由上海生工生物技术有限公司测序鉴定。
1.4 TDI-FP法检测-238位点的多态性
组织标本初步处理后,PCR基因扩增(反应体系、条件同1.3 中的 PCR),取 PCR 产物15.0 μl,加入以1∶9的比例预先混合的PCR Clean-up Reagent和 PCR Clean-up Dilution Buffer 6.0 μl,37 ℃水浴 2 h后95℃4 h,以消化PCR反应中剩余的引物和dNTPs;消化后的产物7.0μl加入已配好的掺入反应混合物(0.5 μl点突变检测探针,1.5 μl Acyclopol Terminator MIX,0.05 μl Acyclopol聚合酶,2.0 μl 10×Buffer,8.95 μl去离子水)13.0 μl,95 ℃ 变性2 min,94 ℃ 15 s,49 ℃ 30 s,53 ℃ 30 s,总共30 个循环,15℃延伸10 min,以掺入检测点突变的探针;将掺入产物10μl加入96孔微孔板,置于荧光偏振检测仪Victor2 Multi Label Counter中进行FP检测。利用荧光偏振分析软件“SNP Macro Victor 384 v 4.0”来分析检测结果。
1.5 统计学分析以及遗传平衡检验
利用拟合优度χ2检验的方法检验基因型频率是否符合 Hardy Weinberg遗传平衡定律。利用SPSS11.5进行 χ2检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 PCR扩增以及多态性检测
以宫颈癌组织和宫颈炎分泌物中提取的DNA为模板,以预先设计的特异引物扩增包含待测位点的目的片段,取扩增产物10μl进行1.5%的琼脂糖凝胶电泳紫外灯下观察,与TNF-α基因-238位点对应的扩增产物为一条位置大约在190 bp的清晰条带,与预先设计的扩增片段长度接近(189 bp)(图1)。提取的质粒测序结果显示:重组质粒中含有包含待测位点的目的序列,序列长度与预先设计的相同(189 bp),与Genbank发表的已知序列同源。在后续的多态性检测中采用与此序列对应的模板DNA作为阳性对照。对TNF-α基因-238位点进行多态性检测,共检测到两个等位基因G、A,3个基因型:GG、GA、AA,其中G为优势等位基因,GG基因型为优势基因型。各基因型的检测结果示例见图2(GG为高TAMRA、低R110;GA为高TAMRA、高R110;AA为低TAMRA、高R110;对照:低TAMRA低R110)。

图1 包含-238位点的扩增片段(189 bp)电泳结果Figure 1 The electropherotyping results of fragment including-238
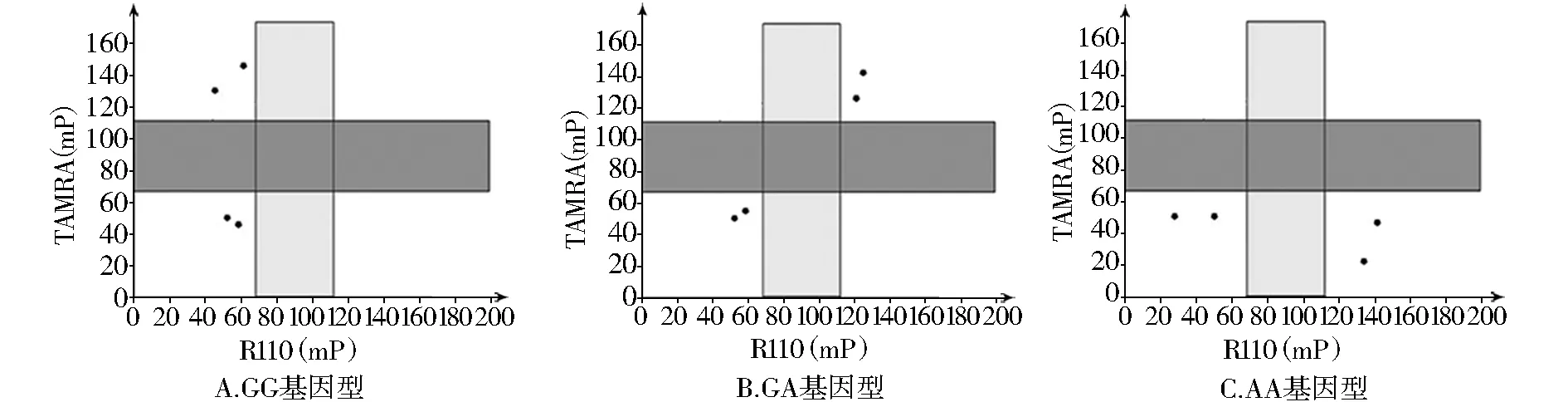
图2 TDI-FP法检测TNF-α基因-238位点基因型Figure 2 Detection of all genotypes of-238 of TNF-α gene by TDI-FP
2.2 Hardy Weinberg遗传平衡检验
TNF-α基因-238位点等位基因频率已达遗传平衡,说明本实验研究资料具有较好的人群代表性。
2.3 宫颈癌与HPV感染的关系
所有宫颈癌标本中共41例完成HPV检测,HPV阳性 36例(阳性率为 87.8%),阴性 5例。HPV16型感染阳性率为68.3%(28例),HPV18阳性率为14.6%(6例)。
2.4 TNF-α基因-238位点多态性与宫颈癌的关系
TNF-α基因-238位点三种基因型的分布在宫颈癌和对照组之间没有显著性差异(P>0.05),但是AA基因型在宫颈癌组为8.6%,对照组没有出现。两个等位基因G和A在两组之间也没有显著性差异(P> 0.05,OR=1.448,95%CI 0.685-3.064,见表1)。
2.5 TNF-α基因-238位点多态性与HPV感染的关系
同时检测HPV感染和-238位点多态性的患者中,HPV阳性者36例,HPV阴性者10例。TNF-α基因-238位点各等位基因的分布在HPV感染组与HPV感染阴性组之间非常相似,G等位基因在感染阳性和阴性组中分别为83.3%和85.0%,A等位基因在感染阳性组和感染阴性组分别为16.7%和15.0%,两个等位基因的分布在两组之间无显著差异(P>0.05,OR=1.111,95%CI 0.347-3.559,见表2)。
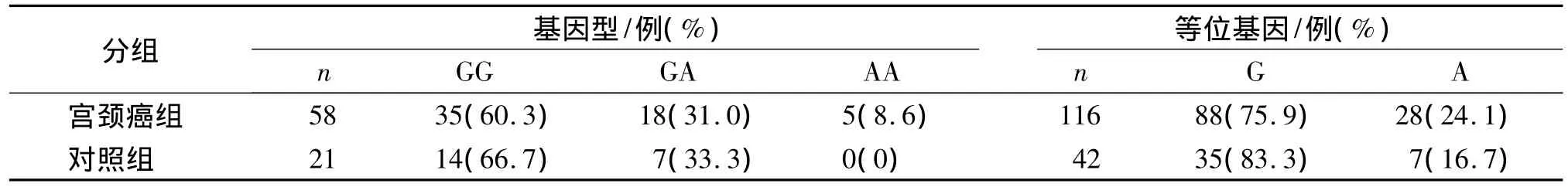
表1 TNF-α基因-238位点多态性在宫颈癌和对照组中的分布Table 1 Frequency distribution of TNF-α-238 polymorphisms in cervical cancer group and control group

表2 TNF-α基因-238位点多态性在HPV感染阳性组和阴性组中的分布 例(%)Table 2 Frequency distribution of TNF-α-238 polymorphisms in HPV positive group and nagative group cases(%)
3 讨论
宫颈癌在中国每年有大约132 300例新发病例,位列女性恶性肿瘤的第二位[6]。高危型HPV已经被确认为宫颈癌的主要致癌原,尤其是HPV16型和18型。本研究中利用TDI-FP的方法检测了41例宫颈癌组织的HPV感染情况,发现HPV感染阳性率高达87.8%,其中,高危型16型感染阳性率为68.3%,高于美国(59.5%)、非洲(42.5%)、欧洲(65.1%)[7]。由此可见,HPV 感染在不同国家和地区间存在一定的差异。
绝大多数疾病的发生发展都是遗传因素与环境因素相互作用的结果,人类基因组是一个高度变异的体系,多态性的存在导致了个体之间的表型不同,个体在基因构成上的内在差异可以从一定程度上阐明人体对疾病、毒物的易感性与耐受性、疾病临床表现的多样性以及治疗效果的差异。基因多态性的研究不但可以揭示同一种疾病不同临床表型的实质,也可以为更具个体化的预防、诊断以及治疗疾病打下基础。有关基因多态性在临床医学中的应用已日益广泛,包括临床医学的各个专业、各类疾病。一项meta分析表明:caspase-8的基因多态性与结直肠癌的易感性有关[8]。UGT2B17多态性与罹患前列腺癌的风险增高有关[9]。TNF-α基因-238位点的单核苷酸多态性与疾病的相关性被广泛研究[10-12],其机制可能与碱基突变后影响转录因子的结合,进而影响了TNF-αmRNA的表达并最终导致TNF-α的产量改变有关。研究发现-238位点G置换为A与TNF-α 的产量下降相关[13],携带-238A 的外周血细胞经刺激后TNF-α的产量明显下降[14]。
鉴于TNF-α在免疫清除方面的重要作用及宫颈癌与病毒感染持续化的密切关系,TNF-α基因的多态性与宫颈癌的关系近几年受到关注。有研究发现,TNF-α基因-238位点 G→A多态性与宫颈癌的风险性降低有关[15-16],本实验中此位点的各基因型、等位基因与宫颈癌的易感性未见明显关联,分析原因可能为:①基因的多态性在不同种族人群中的分布并不一致,导致本实验结果与其他种族结果的不一致;②样本量少,导致突变所致的A等位基因及AA基因型的数值太少,无法反映此位点多态性的真实情况,故后期研究宜尽量增大样本量。
[1]Ferlay J,Shin HR,Bray F,etal.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]zur Hausen H.Papillomaviruses and cancer:from basic studies to clinical application[J].Nat Rev Cancer,2002,2(5):342-350.
[3]Alexander-Miller MA.High-avidity CD8+T cells:optimal soldiers in the war against viruses and tumors[J].Immunol Res,2005,31(1):13-24.
[4]Aggarwal BB.Signaling pathways of the TNF superfamily:a double-edged sword[J].Nat Rev Immunol,2003,3(9):745-756.
[5]Skoog T,van’t Hooft FM,Kallin B,etal.A common functional polymorphism(C-->A substitution at position-863)in the promoter region of the tumour necrosis factor-alpha(TNF-alpha)gene associated with reduced circulating levels of TNF-alpha[J].Hum Mol Genet,1999,8(8):1443-1449.
[6]Parkin DM,Pisani P,Ferlay J.Estimates of the worldwide incidence of 25 major cancers in 1990[J].Int J Cancer,1999,80(6):827-841.
[7]Heise A.The clinical significance of HPV[J].Nurse Pract,2003,28(10):8-19.
[8]Peng Q,Lao X,Tang W,etal.CASP8-652 6N del polymorphism contributes to colorectal cancer susceptibility:evidence from a meta-analysis[J].PLoSOne,2014,9(2):e87925.
[9]Kpoghomou MA,Soatiana JE,Kalembo FW,etal.UGT2B17 polymorphism and risk of prostate cancer:A meta-analysis[J].ISRN Oncol,2013,2013:465916.
[10]Elhawary NA,Tayeb MT,Abdel-Ghafar S,etal.TNF-238 polymorphism may predict bronchopulmonary dysplasia among preterm infants in the Egyptian population [J].Pediatr Pulmonol,2013,48(7):699-706.
[11]Lee GH,Choi YM,Kim SH,etal.Association of tumor necrosis factor-{alpha}gene polymorphisms with advanced stage endometriosis[J].Hum Reprod,2008,23(4):977-981.
[12]Sharma R,Agrawal S,Saxena A,etal.Association of IL-6,IL-10,and TNF-α gene polymorphism with malnutrition inflammation syndrome and survival among end stage renal disease patients[J].J Interferon Cytokine Res,2013,33(7):384-391.
[13]D’Alfonso S,Richiardi PM.A polymorphic variation in a putative regulation box of the TNFA promoter region[J].Immunogenetics,1994,39(2):150-154.
[14]Kaluza W,Reuss E,Grossmann S,etal.Different transcriptional activity and in vitro TNF-alpha production in psoriasis patients carrying the TNF-alpha238A promoter polymorphism[J].JInvest Dermatol,2000,114(6):1180-1183.
[15]Barbisan G,Pérez LO,Contreras A,etal.TNF-α and IL-10 promoter polymorphisms,HPV infection,and cervical cancer risk[J].Tumour Biol,2012,33(5):1549-1556.
[16]Pan F,Tian J,Ji CS,etal.Association of TNF-α-308 and-238 polymorphisms with risk of cervical cancer:a meta-analysis[J].Asian Pac J Cancer Prev,2012,13(11):5777-5783.

