HBV BCP区1762/1764和1896突变位点检测新技术研究
王 泽,唐景峰
(1.阳泉市第三人民医院,山西 阳泉 045000;2.武汉大学生命科学学院/病毒学国家重点实验室,湖北武汉 430072)
乙型肝炎病毒(hepatitis B virus,HBV)严重危害人类健康,是引起肝脏疾病的主要致病病毒之一[1,2]。全球约有20亿人感染过HBV,其中慢性HBV携带者有4亿人之多,每年造成的死亡人数约有100万。乙型肝炎病毒的发病机制主要是机体清除HBV而引发的细胞免疫病理改变,较早的研究显示在HBV感染过程中HBeAg的转阴预示病毒的清除和疾病的好转[3]。但近期研究发现乙肝病毒感染机体后,相当部分HBeAg转阴是为逃避免疫清除而发生的变异[4~6]。
HBV DNA C区启动子(The basal core promoter,BCP)负责调控编码HBeAg和核心抗原的RNA的转录,BCP序列中的双突变1762(A→T)和1764(G→A)经常相伴出现,研究资料表明BCP双突变与爆发性肝炎和慢性化有关[7]。前C区1896位点也是最常见的变异位点之一,该位点G-A的替换,使编码色氨酸的密码子UGG变为终止密码子。1762/1764和1896的突变均可引起HBeAg不表达,逃避机体的免疫清除,故临床检测该基因变异对肝炎的治疗有重要意义。本实验采用错配扩增和荧光PCR结合的突变分析法(MAMA-PCR)检测基因突变[8~10],每个位点含两对特异性引物(A和B)和1条特异性含荧光标记的Taqman探针,引物A对野生型和突变型序列都能正常扩增,而引物B为错配引物,对突变型序列能正常扩增,对野生型序列则不能扩增或扩增效率极低。对每个样本均分别用引物A和引物B在不同的PCR管内扩增,根据引物A和B两者扩增所得Ct值的差异即可判断位点突变的发生与否。

图1 错配扩增荧光PCR原理Fig 1 The Principle of Mismatch Amplification and Fluorescent PCR
本研究主要针对突变位点检测,对比金标准测序法和MAMA-PCR荧光法样本检测的差异,分析MAMA-PCR法检测样本的准确性,为临床HBV BCP区和前C区突变位点的检测提供新的检测方法。
1 资料与方法
1.1 一般资料
选取2010年1月~2013年6月就诊于山西省阳泉市第三人民医院的被确诊为慢性乙型肝炎患者血清132例,男70例,女62例,平均年龄36岁,均符合2000年西安会议修订的《病毒性肝炎防治方案》中的慢性乙型肝炎的诊断标准。收集血清于-70℃保存。
1.2 方法
1.2.1 仪器与试剂 SLAN96P实时荧光PCR仪购自上海宏石医疗科技有限公司,ABI7500实时荧光PCR仪购自ABI公司,病毒核酸提取试剂盒购自天根生化科技有限公司,BCP区1762/1764和前C区1896位点基因突变检测试剂盒购自武汉百泰基因工程有限公司,dNTPs和Taq酶等生化试剂均购自宝生物工程(大连)有限公司。
1.2.2 操作 a)样本处理:取患者的血清及试剂盒中的对照品各100 μL,严格按照核酸提取试剂盒说明书分离提取样本核酸用于项目检测。b)测序检测:从NCBI(http://www.ncbi.nlm.nih.gov/)查找 HBV 不同亚型核酸序列,经同源比对后选择保守区域针设计PCR扩增引物(见表1)。

表1 各组反应引物和探针序列Table 1 Various Reaction of Primer and Probe Sequence
结果判断标准:如果样品PCR反应管A扩增曲线不呈S型或Ct(A)>36,判定样品HBV DNA含量小于检测下限;若|Ct(A)-Ct(B)|≤7.00,则该样本的检测位点存在突变;若|Ct(A)-Ct(B)|>7.00,则该样本的检测位点为野生型突变的含量超出检测下限,即不存在突变。
PCR扩增程序为94℃,5 min;94℃,10 s;56℃,30 s;72℃,45 s;34 cyc;72℃,10 min。PCR 产物电泳切胶回收,送生物工程(上海)股份有限公司测序,分析基因位点是否为突变。c)荧光PCR扩增:通过软件Primer Express 3.0设计特定位点引物和探针,经引物筛选及体系优化后获得最优的组合(见表1),用于HBV样本检测。每个位点的检测分为A和B两管进行,反应体系为 50 μL:5 μL 10 × buffer,0.2 mM dNTPs,0.4 mM dUTP,1 U UNG,0.4 μM 引物,探针0.2 μM,2 U Taq 酶。反应条件为:50℃,2 min;95℃,3 min;95℃,10 s;60℃,1 min,40 cyc(收集荧光信号)。
2 结果
2.1 MAMA-PCR突变方法性能评估
稳定性和精密度检测:以该方法组装的科研试剂中野生型和突变性阳性参考品作为模板,分别以A和B反应液检测3次,每次反应设置10个重复,分析批间和批内差异,对方法的重复性进行考核。结果表明,BCP区1762/1764双突变和前C区1896突变试剂A反应液检测两种参考品的Ct值基本一致,差异无统计学意义(P>0.05);B反应液检测突变参考品的Ct值约为16,野生型参考品Ct值约为25.5,批间和批内变异系数均<5%,突变型和野生型的Ct值差异约为9.9,见表2和表3。
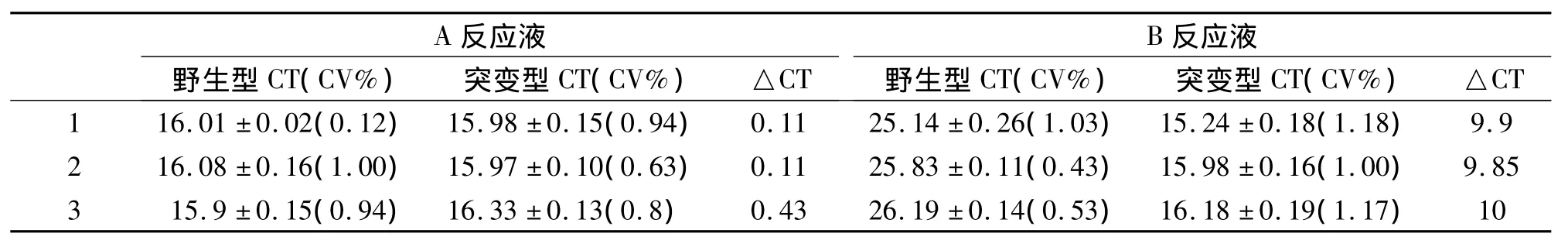
表2 BCP区1762/1764双突变检测试剂稳定性和精密度Table 2 The Stability and Precision of 1762/1764 of the BCP Double Mutations
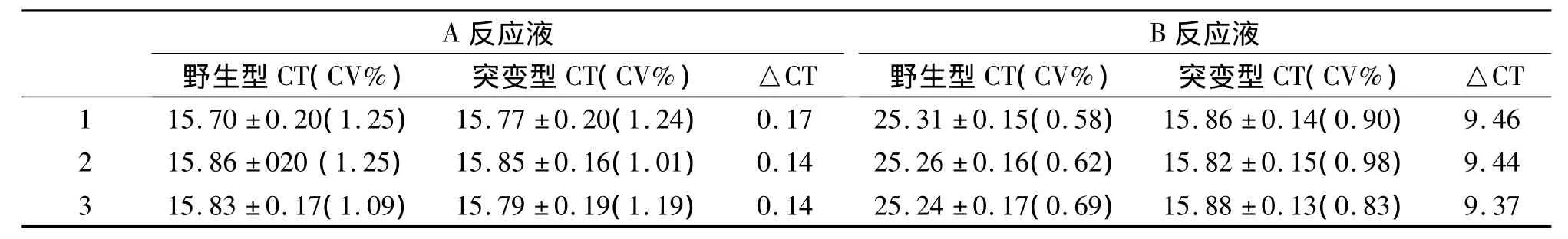
表3 前C区1896突变检测试剂稳定性和精密度Table 3 The Stability and Precision of Precore 1896 Site Mutation Test Reagents
2.2 特异性和灵敏度检测
依据特异性参考品选取原则,选定甲型肝炎病毒I型2份、甲型肝炎病毒Ⅱ型3份、丙型肝炎病毒Ⅰ型2份、丙型肝炎病毒Ⅱ型1份、戊型肝炎病毒Ⅰ型1份、戊型肝炎病毒Ⅳ型1份,共10份特异性参考品,所有检测结果均为阴性,MAMA-PCR试剂的特异性高,不存在交叉检测问题;以1.0×104 IU/mL的最低检测限突变型参考品检测20次,结果显示均为阳性,证明反应试剂的灵敏度可达到1.0×104 IU/mL(见图2)。

图2 灵敏度检测:1.A反应液2.B反应液Fig 2 The Sensitivity Detection:1.A The Reaction Liquid 2.B Reaction Liquid
2.3 试剂检测混合型HBV性能评估
将突变型和野生型质控品按照比例混合制备成突变型含量比例100%,90%,50%,20%,10%,1%和0的参考品,以1762/1764和1896两个试剂的A反应液和B反应液进行检测,结果表明BCP区1762/1764双突变和前C区1896位点突变试剂检测1%突变含量的混合参考品的Ct值差异均大于理论值6.6,可达到7,证明试剂可检测出1%突变比例的HBV样本(见图3,图4)。

图3 1762/1764不同突变含量HBV检测(Ct):1.A反应液2.B反应液Fig 3 1762/1764 Different mutations Content and HBV Detection(Ct):1.A Reaction Liquid 2.B Reaction Liquid
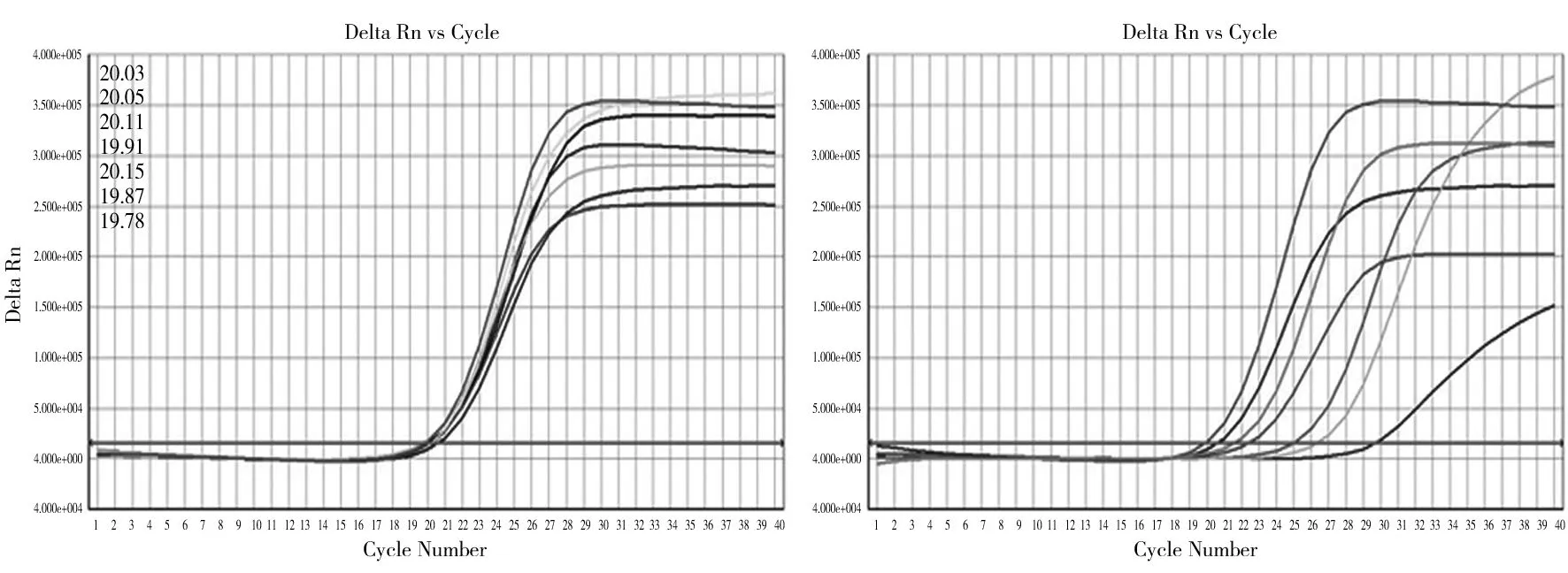
图4 1896不同突变含量HBV(Ct)检测:1.A反应液2.B反应液Fig 4 1896 Different Mutation HBV(Ct)Test:1.A Reaction Liquid 2.B Reaction Liquid
2.4 HBV样本BCP区和前C区核酸测序分析
132份样本核酸提取后经过PCR扩增后测序,与野生型HBV核酸序列比对分析(见图5)。
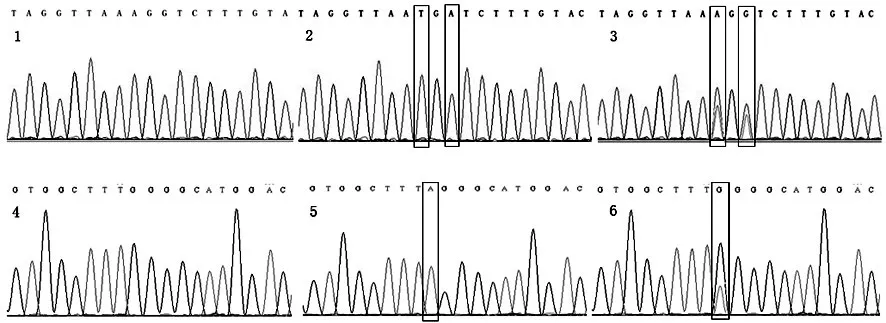
图5 样本测序图谱(1~3为1762/1764位点,4~6为1896 位点):1,4:野生型 2,5:突变型 3,6:混合感染型Fig 5 Sample Sequencing Atlas(1~3:1762/1764 Site,4~6:1896 Site):1,4:Wide Type 2,5:Mutant Type 3,6:Mixed Infection Type
分别统计1762/1764双突变和1896突变情况:检测出67例1762/1764双突变数,突变比例为50.8%;检测出39例1896突变,突变比例为29.5%,1762/1764和1896同时突变15例,突变比例11.4%,见表4。
2.5 HBV样本突变试剂盒检测分析
样本提取后严格按照试剂盒说明书进行PCR检测及结果判断,经统计BCP区双突变例数为69,突变比例52.3%,前C区1896位点突变例数为41,突变比例31.1%,1762/1764和1896同时突变18例,突变比例13.6%,见表4。
HBV样本BCP区和前C区核酸MAMA-PCR法分析,HBV样本检测结果表明BCP区双突变例数为69,突变比例52.3%,前 C区1896位点突变例数为42,突变比例31.8%,1762/1764和1896同时突变17例,突变比例12.9%,见表4。
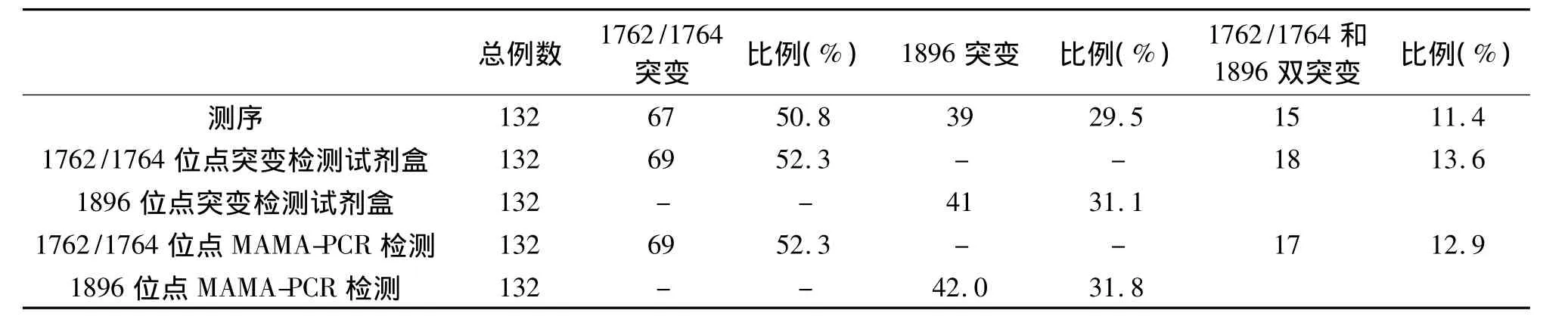
表4 HBV测序法和PCR法对比统计Table 4 Comparison Statistic of HBV Sequencing and PCR Method
3 讨论
HBeAg阳性在较早的研究中被认为是病毒在体内复制旺盛的一个重要指标,HBeAg由阳性转为阴性是部分病毒被清除以及病情缓解的标志。研究发现HBeAg阳转阴的感染者病情并非都趋于好转,相当部分的慢性肝病患者都检测到HBeAg阴性,但具有更高的HBV DNA复制活力。这主要是由HBV核酸突变导致HBeAg不表达或表达量下降引起,这些突变主要包括BCP区的1762/1764位点的双突变和前C区的1896位点突变引起。BCP区是HBV前C区mRNA转录的重要元件,BCP区1762A→T1764G→A的联合位点变异被认为可能阻碍前C区mRNA转录,从而造成HBeAg滴度下降或消失[6]。HBV前C区突变最常见的位点为nt 1896G-A的变异,使密码28由色氨酸TGG变换成终止密码TAG,导致HBeAg合成终止,在血清学上表现为HBeAg阴性,亚洲平均50%HBeAg阴性的慢性乙肝患者存在前C区突变。目前用于核酸位点突变检测的方法主要有单链构象多态性分析技术、DNA直接测序、限制性内切酶分析、同位素标记寡核苷酸探针技术和微型DNA阵列[11~13]。其中测序法是运用较为广泛和准确的方法,但也存在操作复杂、检测周期长和检测灵敏度较低的不足,对混合型30%以下的突变容易存在漏检的现象。微型DNA阵列是新开发出来用于检测多位点突变的方法,其主要优势在于可同时检测多个位点。
本研究采用错配扩增和荧光PCR结合的突变分析法(MAMA-PCR)检测HBV BCP区和前C突变,同时采用科研试剂盒和金标准测序法比对检测结果的准确性。在进行样本检测比对之前首先对MAMA-PCR两个检测位点的试剂性能进行检测与评估,检测结果表明BCP区1762/1764和前C区1896位点基因突变检测试剂的时间与批次的CV%均<5%,重复性好,10份特异性参考品检测均为阴性,证明反应特异性好,不存在交叉检测,同时其检测灵敏度可达到104IU/mL;对于感染混合型HBV样本,本试剂可稳定检测出1%突变含量的样本。MAMA-PCR法样本检测1762/1764结果与试剂盒一致,1896位点多检出1例样本,这1例样本的核酸含量较低,处于临界范围区间,故可认为结果基本一致;测序法两个位点突变检出率均低于MAMA-PCR和试剂盒,分析可能由于测序法对低于30%突变比例的样本存在漏检引起。测序法作为金标准对核酸位点的检测具有直观,高通量的优点,特别针对同一区间的多个突变,可一次性检测出所有位点,在临床上仍然具有不可替代的作用。但对于单位点的突变检测,MAMA-PCR具有更高的灵敏度,检测更为准确便捷。本研究采用MAMA-PCR方法针对1762/1764和1896位点开发的检测试剂与已有试剂盒检测结果无差异,丰富了HBV1762/1764和1896位点的检测方案,将为HBV患者治疗方案的制定提供依据。
[1]MariaNordin,Mikael Ingman,BeataLindqvist,et al.Variability in the Precore and Core Promoter Region of the Hepatitis B Virus Genome[J].Journal of Medical Virology,2014,86(3):437-445.
[2]Thomas F Baumert,Robert Thimme,Fritz von Weizs cker.Pathogenesis of Hepatitis B Virus Infection[J].World J Gastroenterol,2007,13(1):82-90.
[3]Gerner P,Lausch E,Friedt M,et al.Hepatitis B Virus Core Promoter Mutations in Children with Multiple Anti-HBe/HBeAg Reactivations Result in Enhanced Promoter Activity[J].JMed Virol,1999,59(4):415-423.
[4]Mayerat C,Mantegani A,Spertini F,et al.Mutations in the Basal core Promoter and Precore/core Gene of Hepatitis B Virus in Patients with Chronic Active but not Acute Hepatitis B[J].Eur J Clin Microbi-ol Infect Dis,1999,18(12):871-878.
[5]Lindh M,Hannoun C,Dhillon AP,et al.Core Promoter Mutations and Genotypes in Relation to Viral Replication and Liver Damage in East Asian Hepatitis B Virus Carriers[J].J Infect Dis,1999,179(4)∶775-782.
[6]Fang ZL,Sabin CA,Dong BQ,et al.The Association of HBV Core Promoter Double Mutations(A1762T and G1764A)with Viral Load Difference between HBeAg Positive and Anti-HBe Positive Individuals:a Longitudinal Analysis[J].J Hepatol,2009,50(2):273-280.
[7]Kramvis A,Arakawa K,Yu MC,et al.Relationship of Serological Subtype,Basic Core Promoter and Precore Mutations to Genotypes/subgenotypes of Hepatitis B Virus[J].J Med Virol,2008,80(1):27-46.
[8]C R Newton,A Graham,L E Heptinstall,et al.Analysis of Any Point Mutation in DNA.The Amplification Refractory Mutation System(ARMS)[J].Nucleic Acids Res,1989,17(7):2503-2516.
[9]郭奕斌,潘宏达,郭春苗,等.双错配碱基ARMS结合RE法快速检测FGFR3基因的突变超热点[J].分子诊断与治疗杂志,2010,2(1):5-8.
[10]Kwok S,Kellogg DE,McKinney N,et al.Effects of Primer-template Mismatches on the Polymerase Chain Reaction:Human Immunodeficiency Virus Type 1 Model Studies[J].Nucleic Acids Res,1990,18(4):999-1005.
[11]赵 伟,万建民,刘 伟,等.DNA芯片检测肝组织及血清中乙型肝炎病毒DNA的临床研究[J].中华检验医学杂志,2003,26(2):79-82.
[12]单万水,单金岚,詹能勇,等.DNA芯片快速检测耐利福平结核分枝杆菌rpoB基因突变[J].中华检验医学杂志,2003,26(11):680-682.
[13]孙 非,刘立侠,金扩世,等.传染性非典型肺炎限制性内切酶检测方法的研究[J].中华检验医学杂志,2006,29(1):72-73.

