石漠化区枫香、刺槐和柏木的抗逆性初步研究
陈 瑞, 童方平, 李 贵, 刘振华, 谭胜华, 安轩华
(1.湖南省林业科学院, 湖南 长沙 410004; 2.新邵县林业局, 湖南 新邵 422900)
石漠化区枫香、刺槐和柏木的抗逆性初步研究
陈 瑞1, 童方平1, 李 贵1, 刘振华1, 谭胜华2, 安轩华2
(1.湖南省林业科学院, 湖南 长沙 410004; 2.新邵县林业局, 湖南 新邵 422900)
于不同程度石漠化区的枫香、刺槐和柏木人工林中采集叶片为试材,通过比对3种植物叶片中叶绿素、SOD、丙二醛(MDA)和脯氨酸含量的变化,对石漠化区3种植物抗逆性进行分析评价。结果表明:不同石漠化程度区对植物体内SOD含量的影响显著。在轻度石漠化区,柏木SOD含量最高,刺槐SOD含量最低;在中度石漠化区,柏木SOD含量最高,枫香SOD含量最低;在重度石漠化区,枫香SOD含量最高,刺槐SOD含量最低。刺槐叶片MDA含量与叶绿素含量呈显著负相关,而柏木叶片MDA含量与叶绿素含量则呈显著正相关。
石漠化; 枫香; 刺槐; 柏木; 抗逆性
石漠化区是在岩溶及其发育的自然背景下形成的,其地表植被遭受破坏,同时人为活动造成土壤严重侵蚀,基岩大面积裸露,导致生长在该区的植物受到干旱瘠薄的胁迫[1]。植物具有对环境胁迫忍耐和抵抗的能力,即抗逆性[2]。大多数植物通过生长发育调节、代谢调节、自由基清除剂等膜保护物质来对抗逆境伤害[3]。枫香是我国重要的乡土树种,主产于湖南、江苏、安徽、湖北、浙江、江西、福建、台湾、广西等省,分布广泛。枫香对土壤要求不严,耐干旱瘠薄,属典型的荒山先锋树种,也是亚热带地区优良速生落叶阔叶树种[4]。刺槐于20世纪初引入中国后被广泛栽植,已经乡土化同时也是重要的速生造林树种之一,其保持水土、防风固沙、改良土壤能力很强[5~6]。柏木是华北、西北、华东及华南北部荒山绿化的先锋树种,也是干旱瘠薄石灰岩山地、沙荒及轻盐碱地区的主要造林树种之一。国内外在刺槐抗逆性研究上大部分侧重于耐旱和耐盐性,而枫香和柏木抗逆性的研究比较少。我们针对生长在不同石漠化区的枫香、刺槐和柏木人工林展开研究,对三种植物抗逆性进行分析评价,为石漠化区人工林的栽植提供参考。
1 研究区概况
湖南省新邵县地处东经111°08′—112°50′,北纬27°15′—27°38′。属亚热带季风湿润气候,光照充足,雨量充沛,四季分明,年平均气温17.2℃,年降雨量1115.5mm,年日照时数1688.3h,无霜期为276天。新邵县国土总面积1763km2。2010年3—5月的石漠化监测结果显示,全县岩溶地区面积为12.60万hm2,占全县总面积71.5%,分布在全县所有15个乡镇、3个国有林场。其中石漠化土地3.67万hm2,潜在石漠化土地1.80万 hm2,非石漠化土地7.13万hm2,分别占岩溶地区面积的29.1%、14.3%、56.6%。
2 研究方法
2.1样点选择与采样
于新邵县选择不同程度石漠化区,林龄为四年左右的枫香、刺槐和柏木人工林为采样点,进行采样。石漠化程度分级标准见表1。

表1 不同石漠化程度分级标准表Tab1 Thestandardtableofdifferentrockydesertificationclassification石漠化程度等级基岩裸露(%)土层厚度(cm)坡度(°)植被+土层厚度(cm)平均厚度(cm)轻度石漠化>60<30>1835~50<15中度石漠化>70<20>2220~35<10重度石漠化>80<10>2510~20 <5
在不同石漠化程度的枫香、刺槐和柏木人工林地随机设置3个5m×5m的样地。每个样地选取3株生长状况优于平均木的林木,采摘每株树不同部位叶片(混合5g左右),用塑料袋包好,做好记号,再用锡纸包裹好放入液氮中保存,带回实验室后放入-70℃的冰箱保存备用。
2.2生理生化指标测定[7-8]
测定时,分树种每株树不同部位的各个指标采用混合样进行测定,各重复3次。
2.2.1 叶绿素含量测定 取新鲜的叶片0.1g,剪成1cm左右的细条,放入25mL带有刻度有盖的试管,加入丙酮与乙醇(1∶1)溶液,放在避光处24h后测定。取叶绿素提取液至比色杯皿,以丙酮与乙醇(1∶1)溶液为空白,在波长665nm、649nm、470nm下测定吸光度A665、A649、A470。叶绿素含量计算公式如下。
叶绿素a含量(Chla)=13.95A665-6.88A649
叶绿素b含量(Chlb)=24.96A649-7.32A665
叶绿素总含量(Chl)= Chla+Chlb
2.2.2 超氧化物歧化酶(SOD)活性测定 取新鲜叶片0.3g,加入磷酸缓冲液(50mmol /L,pH= 7.8)6mL,把预冷的研钵放在冰上研磨。匀浆后移入离心管,10000r/min、4℃下离心15min。取上清液,在560nm处测定吸光值,测定SOD含量(U/g 鲜质量)[6]。
2.2.3 脯氨酸含量测定 以脯氨酸标准母液(100μg/L)配置0.0、1.0、2.5、5.0、10、15、20、30μg/mL系列溶液,在520nm下测定标准曲线。取叶片0.3g,剪碎,加入适量80%的乙醇,研磨成匀浆全部转移至10mL刻度试管中,最后以80%乙醇定容至刻度,混匀,80℃水浴20min。吸取提取液2mL,加入2mL冰醋酸和2mL茚三酮试剂,沸水浴15min,冷却后在520nm下测定,然后在标准曲线上查出脯氨酸含量(μg/gmf)。
2.2.4 丙二醛(MDA)含量测定 取新鲜叶片0.5g,剪碎,加入10%三氯乙酸(TCA)5mL进行研磨,在3000r/min下离心10min。吸取离心上清液2mL于带塞试管中(2个重复),加入0.5%TBA溶液2mL,混合后在沸水中沸水浴20min,迅速冷却后离心,上清液于532nm、600nm及450nm波长下测定OD值。采用2mL水作为对照。
MDA浓度C(μmol/L鲜质量)=6.45(OD532-OD600)-0.56OD450
2.3数据处理
采用SPSS、EXCEL等软件对所得数据进行显著性检验和方差分析等。
3 结果与分析
3.1枫香、刺槐和柏木叶片叶绿素含量变化
由图1、表2可知,因为树种差异刺槐叶绿素含量最高,柏木叶绿素含量最低。刺槐叶绿素含量随着石漠化程度的加剧呈逐渐递减的趋势;枫香叶绿素含量随着石漠化程度的加剧,呈逐渐递增的趋势;柏木叶绿素含量随着石漠化程度的加剧,呈先递增然后递减的趋势。由表3可知,石漠化程度对枫香、刺槐、柏木叶片叶绿素含量的影响极显著。

图1 不同程度石漠化区枫香、刺槐和柏木叶片中叶绿素含量Fig.1 chlorophyll contents of L.formosana, R. pseudoacacia and C.funebris leaves in different degree of rocky desertification area

表2 叶片叶绿素、MDA、SOD、脯氨酸含量在树种与不同石漠化区之间的双因子方差分析Tab2 Doublefactoranalysisofvarianceofchlorophyll,MDA,SOD,prolinecontentintreespeciesleaveswithdifferentrockydesertificationarea自变量因变量FSig叶绿素不同树种226.1680<0.0001不同石漠化区1.40310.2489MDA含量不同树种48.0536<0.0001不同石漠化区0.72540.4857SOD不同树种1.40050.2495不同石漠化区4.34920.0145脯氨酸不同树种123.0150<0.0001不同石漠化区1.52120.2216
3.2枫香、刺槐和柏木叶片MDA含量变化
由图2、表2可知,因为树种差异枫香MDA含量最高,而柏木MDA含量最低。随着石漠化程度的加深,枫香、刺槐MDA含量呈逐渐递增的趋势;柏木MDA含量随着石漠化程度的加剧,先呈递减然后递增的趋势。由表3可知,石漠化程度对枫香、刺槐、柏木叶片MDA含量的影响不显著。

表3 不同石漠化程度3树种叶片的叶绿素、MDA、SOD、脯氨酸含量方差分析Tab3 Varianceanalysisofchlorophyll,MDA,SOD,prolinecontentofthreetreespeciesleavesindif⁃ferentdegreeofrockydesertificationarea自变量因变量FSig叶绿素含量1329330.0001枫香MDA含量1.00920.3717SOD7.54990.0013脯氨酸1.69510.1938叶绿素含量5.90070.0050刺槐MDA含量1.47310.2388SOD4.21130.0203脯氨酸2.43770.0975叶绿素含量5.96320.0047柏木MDA含量0.42420.6566SOD2.54380.0885脯氨酸7.61970.0013

图2 不同程度石漠化区枫香、刺槐和柏木叶片中MDA含量Fig.2 MDA contents of L.formosana, R. pseudoacacia and C.funebris leaves in different degree of rocky desertification area
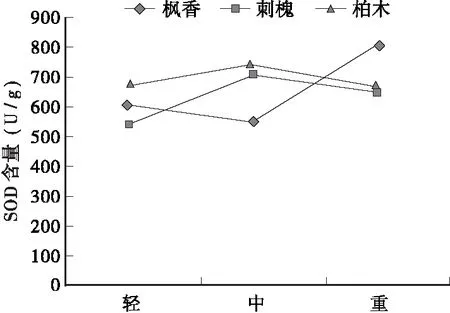
图3 不同程度石漠化区枫香、刺槐和柏木叶片中SOD含量Fig.3 SOD contents of L.formosana, R. pseudoacacia and C.funebris leaves in different degree of rocky desertification area
3.3枫香、刺槐和柏木叶片SOD含量变化
由图3、表2可知,树种因素对SOD含量影响不显著,不同石漠化区对SOD含量影响显著。在轻度石漠化区,柏木SOD含量最高,刺槐SOD含量最低;在中度石漠化区,柏木SOD含量最高,枫香SOD含量最低;在重度石漠化区,枫香SOD含量最高,刺槐SOD含量最低。刺槐、柏木SOD含量随着石漠化程度的加剧,呈先递增后递减的趋势;而枫香SOD含量与之相反,随着石漠化程度的加剧,呈先递减然后递增的趋势。由表3可知,石漠化程度对枫香叶片SOD含量的影响极显著,对刺槐叶片SOD含量的影响显著,而对柏木叶片SOD含量的影响不显著。
3.4枫香、刺槐和柏木叶片脯氨酸含量变化
由图4、表2可知,因为树种差异,刺槐脯氨酸含量最高,枫香脯氨酸含量最低。随着石漠化程度的加深,柏木脯氨酸含量呈逐渐递减的趋势,枫香脯氨酸含量呈先递减然后递增的趋势,而刺槐脯氨酸含量呈先递增然后递减的趋势。由表3可知,石漠化程度对柏木叶片脯氨酸含量的影响极显著,对枫香、刺槐叶片脯氨酸含量的影响不显著。

图4 不同程度石漠化区枫香、刺槐和柏木叶片中脯氨酸含量Fig.4 Proline contents of L.formosana, R. pseudoacacia and C.funebris leaves in different degree of rocky desertification area
3.5叶片叶绿素、MDA、SOD、脯氨酸含量的相关性
由表4可以看出,枫香叶片SOD含量与叶绿素含量、脯氨酸含量呈显著正相关,与MDA含量呈显著负相关;刺槐叶片MDA含量与叶绿素含量和SOD含量呈显著负相关,与脯氨酸含量呈显著正相关;柏木叶片MDA含量与叶绿素含量和脯氨酸呈显著正相关。

表4 叶片叶绿素、MDA、SOD、脯氨酸含量的相关性分析Tab4 Correlationofchlorophyllcontent,MDA,SODandprolinecontentofleaves叶绿素含量脯氨酸SODMDA含量叶绿素含量10.01340.3168∗-0.2478枫香脯氨酸0.013410.2834∗-0.2604SOD0.3168∗0.2834∗1-0.3253∗MDA含量-0.2478-0.2604-0.3253∗1叶绿素含量1-0.24700.0993-0.5044∗刺槐脯氨酸-0.24701-0.03260.4102∗SOD0.0993-0.03261-0.3197∗MDA含量-0.5044∗0.4102∗-0.3197∗1叶绿素含量10.18900.14150.3566∗柏木脯氨酸0.18901-0.08720.2839∗SOD0.1415-0.08721-0.1219MDA含量0.3566∗0.2839∗-0.12191
4 结论与讨论
(1) 叶绿素含量是植物光合作用的一种体现,抗旱性越强的植物在水分胁迫条件下叶绿素含量的变化幅度也越小[9]。本研究中随着石漠化程度的加深,刺槐和柏木叶片叶绿素含量大体是逐渐降低的并且变化幅度小,而枫香叶绿素含量是逐渐升高的同时变化幅度大,说明从叶绿素含量变化上反映不同程度石漠化区枫香、刺槐和柏木的抗逆性,枫香的抗逆性是三者中最低的。
(2) MDA是膜脂过氧化的最终产物,是膜系统受伤害的重要标志之一。其含量可以表示膜脂过氧化作用的程度,也可间接反映植物组织抗氧化能力的强弱[10],是鉴定植物抗旱性强弱的常用依据,MDA增幅小的植物耐旱性较强[11]。本研究中,随着石漠化程度的加深,枫香、刺槐和柏木叶片中MDA含量大体是逐渐增加的,但是变化幅度刺槐>枫香>柏木,说明在石漠化地区,随着石漠化程度的加深,从MDA含量变化上看出柏木抗逆性最强,更能适应石漠化地区的环境。
(3) 大量的研究表明,随干旱胁迫强度的加强和处理时间的延长,大多数植物体内SOD 含量先升高后下降[12]。这与本研究随着石漠化区程度的加深,刺槐和柏木叶片SOD含量的变化一致。但是枫香叶片SOD含量的变化却与之相反,可能因为在石漠化区除了干旱胁迫外,还有高温胁迫,而枫香在干旱胁迫的同时,抗热性强[13],从而出现SOD含量大幅度增加趋势。
(4) 脯氨酸主要存在于干细胞质中,当植物缺少水分时,体内脯氨酸含量增加,其含量在一定程度上反映了植物体内的水分情况,可作为植物缺水情况的参考性指标[14]。本研究中,刺槐的脯氨酸增幅高于枫香和柏木,可能因为刺槐属高耗水性树种[15]。当刺槐在中度石漠化情况下缺少水分时,体内脯氨酸含量增加,对干旱胁迫起了缓冲保护作用,但是长期在重度石漠化情况下,脯氨酸含量已经不能对干旱胁迫的影响进行有效缓冲,植物体内脯氨酸含量比中度石漠化情况下的要低。
(5) 植物的抗逆性受多种生理因素的共同作用,是一个复杂的生理调节机制,各个生理因子之间有着一定的关联。本研究通过对石漠化区3种植物的4个生理指标进行研究,各个指标所表达的植物的抗逆性能不同,不能很好的表明植物的抗逆性能大小。表2方差分析表明,不同石漠化程度对3种植物体内SOD含量的影响显著,这可能是在逆境情况下,植物为了更好生存所做出的变异性的生理反应。在日后的研究中只有增加更多的植物生理指标测定,从中找出反映抗逆性能的生理指标计算模型,才能更好地为石漠化区人工林栽植提供理论依据。
[1] 熊康宁,黎平,周忠发,等.喀斯特石漠化的遥感GIS典型研究—以贵州省为例[M].北京:地质出版社,2002.
[2] 齐宏飞,阳小成.植物抗逆性研究概述[J].安徽农业科学,2008 (32):13943-13946.
[3] 陈秀晨,熊冬金.植物抗逆性研究进展[J].湖北农业科学,2010,49(9):2253-2256.
[4] 章芹,薛建辉,刘成刚. Cd2+与CTAB复合污染对枫香幼苗生长与生理生化特征的影响[J]. 生态学报,2011,3(19):5824-5831.
[5] 刘朝华,韩骞,董军生,等.不同种源刺槐根瘤菌抗逆性研究[J].河北林果研究,2011,26(4):352-357.
[6] 杜振宇,张树岩.刺槐抗逆性研究进展[J].山东林业科技,2012(3):116-121.
[7] 陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006.
[8] 陈瑞,童方平,李贵,等. 石漠化区枫香抗逆性研究[J].湖南林业科技,2013,40(5):16-19.
[9] 潘昕,邱权,李吉跃,等.干旱胁迫对青藏高原6种植物生理指标的影响[J].生态学报,2014,34( 13) : 3558-3567.
[10] 丁玉梅,马龙海,周晓罡,等.干旱胁迫下马铃薯叶片脯氨酸、丙二醛含量变化及与耐旱性的相关性分析[J].西南农业学报,2013,26(1):106-110.
[11] 潘昕,李吉跃,苏艳,等.干旱胁迫对华南地区三种苗木膜脂过氧化及保护酶活性的影响[J].广东林业科技,2012,28( 1) : 13-18.
[12] 胡国霞,马莲菊,陈强,等. 植物抗氧化系统对水分胁迫及复水响应研究进展[J].安徽农业科学, 2011,39( 3) : 1278 - 1280,1282.
[13] Ye CL, Ke YQ, ChenW. A study on the physiology of heat t olerance in Chinese cabbage III. Abil ity to scavenge act ive oxygen of enzyme and non- enzyme system and heat tolerance[J] . Journal of Fujian Agricultural University, 1997, 26( 4) : 498-501.
[14] 伍世平,王君健,于志熙. 8种草坪禾草的抗逆性研究[J]. 武汉植物学研究,1995,13(1):75-80.
[15] 杨建伟,梁宗锁,韩蕊莲.不同土壤水分状况对刺槐的生长及水分利用特征的影响[J].林业科学,2004,40(5):93-98.
(文字编校:张 珉)
StressresistanceofLiquidambarformosana,RobiniapseudoacaciaandCupressusfunebrisontherockydesertificationarea
CHEN Rui1, TONG Fangping1, LI Gui1, LIU Zhenhua1,TAN Shenghua2, AN Xuanhua2
(1.Hunan Academy of Forestry, Changsha 410004,China;2. Forestry Bureau of Xinshao County, Xinshao 422900, China)
In different degree of rocky desertification, with leaves ofLiquidambarformosana,RobiniapseudoacaciaandCupressusfunebrisas materials, the three kinds of plant resistance were analyzed and evaluated through the comparison of leaves chlorophyll, SOD, MDA and proline changes. Results showed that, the influence of different degree of rocky desertification on SOD content in plant was significant. In the slight rocky desertification area, SOD content ofC.funebriswas the highest, while SOD content ofR.pseudoacaciawas the lowest. In moderate rocky desertification area, SOD content ofC.funebriswas the highest, while SOD content ofL.formosanawas the lowest. In the severe rocky desertification area, SOD content ofL.formosanawas the highest, while SOD content ofR.pseudoacaciawas the lowest. MDA content and chlorophyll content ofR.pseudoacaciawas significantly negative correlation, while MDA content and chlorophyll content ofC.funebrisleaf was significantly positive relation.
rocky desertification;Liquidambarformosana;Robiniapseudoacacia;Cupressusfunebris; stress resistance
2014-10-13
Q 945.78
A
1003 — 5710(2014)06 — 0018 — 05
10. 3969/j. issn. 1003 — 5710. 2014. 06. 005

