顺铂联合吉西他滨对肺癌PD-1/PD-L1途径的影响
孙德彬,留静
(1.浙江省丽水市中心医院 呼吸科,浙江 丽水323000;2.浙江省丽水市中心医院 急诊科,浙江 丽水323000)
在北美、东亚、东南亚,以及几乎所有的欧洲国家,肺癌均是癌症导致死亡的最常见原因之一[1-2]。资料表明,我国已成为世界肺癌发病率和死亡率最高的国家[3],近年来国内大中城市男性中肺癌的发病率已占所有恶性肿瘤的首位,女性也已升到第二位,仅次于乳腺癌;肺癌的死亡率也已成为男、女性因患恶性肿瘤死亡的第一、二病因[4]。对于肺癌的治疗,有研究报道采用术前单疗程化疗可提高术后生存率[5]。因此,本研究采用顺铂及吉西他滨进行术前化疗,研究其对PD-1/PD-L1途径的影响,以期为肺癌的临床治疗提供理论基础。
1 资料与方法
1.1 临床资料 选取2013年1月~2013年12月就诊于丽水市中心医院院且经病理学确诊的80例肺癌患者及10例良性肺部疾病患者(E组),80例肺癌患者的预计生存期超过6个月,将肺癌患者随机分为4组,即未经化疗药物治疗组(A组)、顺铂治疗组(B组)、吉西他滨治疗组(C组)和顺铂联合吉西他滨治疗组(D)组,每组20例。本实验得到所有患者知情同意,及医院伦理委员会的批准。
1.2 方法
1.2.1 治疗方法:A组给予常规治疗,B组在常规治疗的基础上采用30mg/m2静脉滴注顺铂注射液(云南生物谷灯盏花药业有限公司,国药准字H20043889,规格:6mL/30mg),1次/d,治疗4周;C组按1 000mg/m2静脉滴注吉西他滨(江苏豪森药业股份有限公司,国药准字 H20030104,规格:0.2 g)30 min,1次/周,连用3周休1周,治疗周期为4周;D组每天给予30mg/m2静脉滴注顺铂注射液,且1次/周 1 000mg/m2静脉滴注吉西他滨30 min,连用3周休1周,治疗周期为4周。
1.2.2 Western blot法检测 PD-1、PD-L1的表达:收集 A、B、C、D、E组患者的手术切除组织,将少量组织块用洁净的剪刀剪碎,置于2mL匀浆器中,加入400μL裂解液(含10%PMSF)后于冰上进行充分匀浆,裂解30 min后转入离心管中,4℃下12 000 r/min,离心5 min,取上清液,加入buffer,煮沸8 min后于-20℃保存。采用Western blot法检测PD-1、PD-L1(购自Cruz Biotechnology,Santa Cruz,CA,USA)的表达。
1.2.3 流式细胞仪检测PD-L1+CD68+巨噬细胞的表达:采集B、C、D组治疗前后外周血与健康体检人员外周血(F组),抗凝后加入20μL FITC标记的鼠抗人PD-L1(BD Pharmingen公司),振荡均匀后避光反应20 min,经破膜剂处理后加入PE标记抗的人 CD68(eBioscience公司),流式细胞仪检测(美国BECKMAN公司)。
1.2.4 ELISA法检测IL-2、IL-4和IL-10因子含量:采集B、C、D组治疗前后外周血,室温下自然凝固,离心收集上清液。以10例来本院体检的健康人员外周血(F组)作对照,按照ELISA试剂盒说明书进行操作(北京方程生物科技有限公司提供)。测定各样本吸光度值(OD值),计算各组IL-2、IL-4和IL-10因子含量。
1.3 统计学方法 采用SPSS19.0进行统计学分析,正态计量数据用“±s”表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料比较 4组患者在年龄、性别和临床分期上均无统计学差异(见表1)。

表1 患者临床资料比较Tab.1 Clinical datas of the patients
2.2 PD-1/PD-L1在肺癌组织与正常组织中的表达 PD-1/PD-L1阳性表达率 A组为60.0%(12/20),B组为35.0%(7/20),C组为40.0%(8/20),D 组为20.0%(4/20),E组未见表达(0/10)。为了观察PD-1/PD-L1在肺癌组织中的表达情况,本研究对A组与肺部良性疾病患者组(E组)进行比较,结果显示:A组较E组阳性表达率升高,且差异具有显著性(P<0.01)。B、C、D组较 A组PD-1/PD-L1阳性表达率均显著降低(P<0.05,P<0.01)。B、C 2组差异无统计学意义,但D组与B、C组比较差异均有统计学意义(P<0.05)。表明PD-1/PD-L1在肺癌细胞免疫中起负性调节作用,顺铂和吉西他滨均可降低PD-1/PD-L1的阳性表达率,2者联合应用效果更佳。
2.3 PD-1/PD-L1在肺癌组织中的表达量 PD-1/PD-L1在A组中表达量最高,B组和C组中表达显著降低(P<0.05),在D组中表达进一步降低,差异有统计学意义(P<0.01)。而E组中PD-1/PD-L1未见表达。B组和C组PD-1/PD-L1表达差异无统计学意义(见图1)。表明顺铂和吉西他滨均可抑制肺癌组织中PD-1/PD-L1的表达,2者抑制效果无明显差异,而联合用药可显著降低PD-1/PD-L1的表达,较单独用药效果更佳。

图1 各组PD-1/PD-L1的表达量*P<0.05,**P<0.01,与A组比较;#P<0.05,与D组比较Fig.1 The expression of PD-1/PD-L1 in each group*P<0.05,**P<0.01,compared with group A;#P<0.05,compared with group D
2.4 肺癌患者外周血中PD-L1+CD68+巨噬细胞的表达如图2和图3,B、C、D和F组中均可检测到PD-L1+CD68+巨噬细胞的表达,但B、C和D组中PD-L1+CD68+巨噬细胞的比例显著高于F组(P<0.01)。B组和C组均可降低PD-L1+CD68+巨噬细胞的比例(P<0.05),而D组PD-L1+CD68+巨噬细胞比例显著下调(P<0.01)。
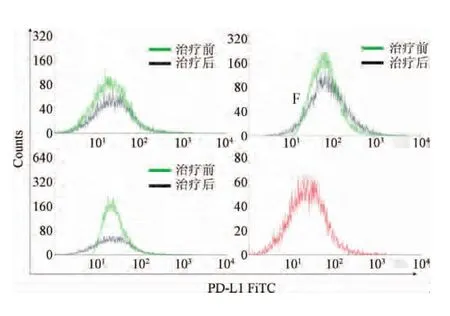
图2 流式细胞仪检测PD-L1+CD68+巨噬细胞Fig.2 PD-L1+CD68+macrophages detected by flow cytometry

图3 肺癌患者和对照组外周血中PD-L1+CD68+巨噬细胞的表达情况比较##P<0.01,与F组比较;*P<0.05,**P<0.01,与治疗前比较;ΔP<0.05,与D组治疗后比较Fig.3 Comparison on the expression of PD-L1+CD68+in peripheral blood of lung cancer patients and controls##P<0.01,compared with F group;*P<0.05,**P<0.01,compared with pre-therapy group;ΔP<0.05,compared with post-therapy in D group.
2.5 患者外周血血清中IL-2、IL-4和IL-10的释放 ELISA结果显示:B、C、D组治疗前外周血血清中IL-2和IL-4含量较F组低(P<0.01),IL-10含量较F组高(P<0.01);治疗后B、C组外周血血清中IL-2和IL-4的含量较治疗前均有一定程度的上调(P<0.05),D组上升幅度最大(P<0.01);B、C组IL-10含量较治疗前有一定程度的下调(P<0.05),D组下调幅度最大(P<0.01,见表2)。
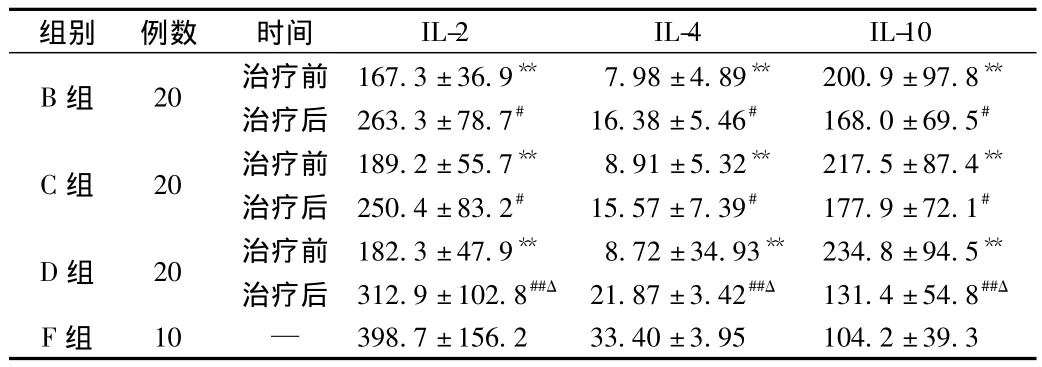
表2 外周血血清中IL-2、IL-4和IL-10的释放(pg/mL)Fig.2 Release of IL-2,IL-4 and IL-10 in peripheral blood serum(pg/mL)
3 讨论
近年来,研究人员发现PD-1/PD-L1在多种肿瘤的免疫耐受和免疫逃逸发生机制中发挥着重要的作用,如食管癌[6]、肝癌[7]、胃癌[8]、乳腺癌[9]等均中呈现高表达状态,且能抑制T、B细胞的增殖和功能,推测其可能参与了肿瘤免疫的负性调节,从而受到了研究人员广泛的重视。不仅如此,另有临床资料显示,PD-L1也可以作为某些肿瘤临床治疗效果的参考指标[10]。PD(programmed death-1)因参与了细胞的凋亡,而被命名为程序性死亡-1受体。PD-L1是PD-1的一个配体,2者在活化的T细胞表面相结合后,可通过诱导细胞凋亡和阻止细胞周期的进程而抑制T细胞的免疫反应,使肿瘤细胞逃离机体的免疫应答反应。
然而,PD-1/PD-L1在肺癌组织及正常肺部组织的表达如何,其是否参与肺癌细胞的的免疫逃逸,鲜见报道。本研究结果显示,PD-1/PD-L1在正常肺部组织(E组)中未见表达,而肺癌组织中阳性表达率高达57.1%,由此可推测PD-1/PD-L1途径可能参与了肺癌细胞免疫逃逸。由于本研究肺部正常组织的例数少于肺癌组织,因此是否会对试验结果又一定影响有待于今后进一步研究。
为探索顺铂联合吉西他滨对PD-1/PD-L1表达的影响,本研究引入顺铂和吉西他滨单独治疗组作对照,结果显示顺铂联合吉西他滨较单独用药下调PD-1/PD-L1的阳性表达率及表达量更加显著,提示顺铂联合吉西他滨可能对恢复肺癌细胞的免疫应答有一定的作用,且效果较单独用药明显。
有研究报道,肺癌组织和外周血中可检测到PD-L1阳性表达的巨噬细胞[11],其与预后差和生存期短密切相关[12]。本研究表明,肺癌患者外周血中PD-L1+CD68+巨噬细胞阳性表达率较正常人(F组)高,经顺铂及吉西他滨治疗后其表达率有所降低,且联合用药降低效果更加明显。表明顺铂联合吉西他滨治疗肺癌效果更佳。
另外,PD-1/PD-L1信号途径介导恶性肿瘤的免疫抑制,PD-L1可通过抑制CD4+,CD8+细胞的活化[13-14],增加IL-10因子的分泌,抑制IL-2、IL-4的分泌[15],从而使肿瘤细胞发生免疫逃逸。本研究表明顺铂及吉西他滨均可升高IL-2、IL-4的分泌,抑制IL-10的分泌,而联合用药效果更加明显。
综上,PD-1/PD-L1可能在肺癌细胞免疫逃逸发挥着重要作用,顺铂联合吉西他滨可下调肺癌组织中PD-1/PD-L1的阳性表达率及表达量,降低PD-L1+CD68+巨噬细胞阳性表达,恢复PD-L1对IL-2、IL-4,IL-10所产生的影响,较单独用药效果明显。该研究为肺癌的临床靶向治疗提供一定的理论依据。
[1]Jemal A,Thun MJ,Ries LA,etal.Annual report to the nation on the status of cancer,1975-2005,featuring trends in lung cancer,tobacco use,and tobacco control[J].J Natl Cancer Inst,2008,100(23):1672-1694.
[2]Boyle P,Smans M,editors.Atlas of cancer mortality in the European Union and the European economic area 1993-1997[J].IARCSci Publ,2008(159):1-259.
[3]Rivera MP.Multimodality therapy in the treatment of lung cancer[J].Semin Respir Crit Care Med,2004(1):3-10.
[4]Chen W,Zheng R,Zhang S,etal.Annual report on status of cancer in China,2010[J].Chin J Cancer Res,2014,26(1):48-58.
[5]张泽峰,高峰,王涛,等.术前单疗程化疗治疗ⅢA期非小细胞肺癌的疗效观察[J].中国生化药物杂志,2012(4):484-486.
[6]Tomimaru Y,Yano M,Takachi K,etal.Correlation between pretherapeutic d-dimer levels and response to neoadjuvant chemotherapy in patients with advanced esophageal cancer[J].Dis Esophagus,2008,21(4):281-287.
[7]PanXC,Li L,Mao JJ,etal.Synergistic effects of soluble PD-1 and IL-21 on antitumor immunity against H22 murine hepatocellular carcinoma[J].Oncol Lett,2013,5(1):90-96.
[8]Savabkar S,Azimzadeh P,Chaleshi V,etal.Programmed death-1 gene polymorphism(PD-1.5 C/T)is associated with gastric cancer[J].Gastroenterol Hepatol Bed Bench,2013,6(4):178-182.
[9]Muenst S,Soysal SD,Gao F,etal.The presence of programmed death 1(PD-1)-positive tumor-infiltrating lymphocytes is associated with poor prognosis in human breast cancer[J].Breast Cancer Res Treat,2013,139(3):667-676.
[10]Duraiswamy J,Freeman GJ,Coukos G.Therapeutic PD-1 pathway blockade augments with other modalities of immunotherapy T-cell function to prevent immune decline in ovarian cancer[J].Cancer Res,2013,73(23):6900-6912.
[11]Dong H,Strome SE,Salomao DR,etal.Tumor-associated B7-H1 promotes T-cell apoptosis:a potential mechanism of immune evasion[J].Nat Med,2002(8):793-800.
[12]陈延斌.PD-L1/PD-1在非小细胞肺癌中的临床应用研究[D].苏州大学,2011.
[13]Bos PD,Plitas G,Rudra D,etal.Transient regulatory T cell ablation deters oncogene-driven breast cancer and enhances radiotherapy[J].J Exp Med,2013,210(11):2435-2466.
[14]Kearl TJ,Jing W,Gershan JA,etal.Programmed death receptor-1/programmed death receptor ligand-1 blockade after transient lymphodepletion to treat myeloma[J].J Immunol,2013,190(11):5620-5628.
[15]Maine CJ,Aziz NH,Chatterjee J,etal.Programmed death ligand-1 overexpression correlates with malignancy and contributes to immune regulation in ovarian cancer[J].Cancer Immunol Immunother,2014,63(3):215-224.

