川芎嗪对原发性痛经大鼠模型血液及组织中VEGF及其受体的影响
段成英,杨中东,赵嫣红,武晓泓
(1.山东科技大学校医院 药房,山东 青岛 266590;2.南京医科大学,江苏 南京 210029)
原发性痛经(primary dysmenorrhoea,PD)又称功能性痛经,是年轻女性较为常见的病症性痛经,其症状并不伴有明显的盆腔器质性疾病,但常呈现下腹部痉挛性阵痛和其他常见症状包括头痛乏力、头晕、恶心呕吐、腹泻、腰腿痛[1]。
川芎嗪(tetramethylpyrazine,TMP)是伞形科植物川芎Rhizoma Chuanxiong的一种活性生物碱——四甲基吡嗪。该药具有抗血栓形成、改善微循环、抗氧化、拮抗钙离子及抗纤维化等作用,现已在临床上用于治疗多种疾病[2]。而有关盐酸川芎嗪治疗原发性痛经性疾病的相关研究并不多。因此,本文旨在探究川芎嗪是否可以用于治疗原发性痛经性疾病及其可能的作用机制,为其临床应用提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:昆明种SD大鼠,体质量160~180 g,雄性,由安徽长临河医药科技有限公司提供,许可证号:SYXK(皖)2007—003。本动物实验遵循《实验动物保护条例》。
1.1.2 药品:注射用盐酸川芎嗪(郑州卓峰制药有限公司,国药准字H20055479);田七痛经胶囊(云南白药集团股份有限公司,国药准字Z53021392);缩宫素针剂(天津市生物化学制药厂生产,国药准字H12020487);苯甲酸雌二醇注射液(广州白云山明兴制药有限公司生产,国药准字H44022008)。
1.1.3 仪器:722分光光度计(上海第二分析仪器厂);F1-2021型C-放射免疫计数器(美国 Bio-Tek公司);LDZ5-2型离心机(黑马仪器公司);低温高速离心机(德国EPPENDORF公司);ELX800uv型酶标仪(美国 Bio-Tek公司);LD4-8型低速离心机(北京医用离心机厂)。
1.2 实验方法
1.2.1 实验分组与造模:雄性SD大鼠40只,随机分为4组:正常对照组,模型组,盐酸川芎嗪注射液组,田七痛经组,每组10只。除正常对照组外,其余各组大鼠连续皮下注射己烯雌酚10 d((第1天、第10天皮下注射,0.8mg/只;第2~9天注射,0.4mg/只)。
1.2.2 给药方法:在注射己烯雌酚的第4天开始给药,田七痛经胶囊组按2 g/kg剂量灌胃,盐酸川芎嗪注射液20mg/kg,痛经模型组灌胃等体积的蒸馏水。
1.2.3 指标检测:①给药28 d后,末次给药45 min结束后,腹腔注射缩宫素0.2 U/只,观察40 min内各组动物扭体反应次数及扭体反应发生率,发生率=扭体动物数/试验动物数×100%。
②给药结束后,末次给予缩宫素后1.5 h,大鼠腹腔注射20%乌拉坦(3.0mL/kg)麻醉,腹主动脉取血8mL,其中4mL制备血清,采用酶联免疫吸附实验检测血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、NO 和免疫比浊法检测超敏 C 反应蛋白(hypersensitive C-reactive protein,hs-CRP)含量。另外4mL制备血浆,通过6-酮前列腺素F1a(6-ketoprostaglandin F1a,6-keto-PGF1a)免疫分析药盒测定6-keto-PGF1a的含量。
③取血后剥离子宫,加入IP裂解液(含PMSF)研磨子宫组织,冰上裂解30 min,12 000 r/min,4℃离心10 min,取上清。收集组织蛋白,BCA法定量。Western blot检测子宫组织中VEGFR-3蛋白表达。步骤如下:制备10%SDS-PAGE,蛋白上样电泳;采用NC膜进行湿转;BSA室温封闭2h;VEGFR-2单抗(鼠抗羊,1∶1 000)一抗4℃孵育过夜;TBST洗膜3次,每次10 min;加入辣根过氧化物酶标记的山羊抗小鼠IgG(1∶5 000)室温孵育1 h;TBS洗膜3次,每次10 min;采用发光试剂盒ECL反应,曝光、显影。
1.3 统计学方法 用SPSS17.0软件进行统计学处理,正态计量数据用“±s”表示,组间比较采用两独立样本t检验和单因素方差分析。
2 结果
2.1 盐酸川芎嗪注射液对大鼠子宫收缩的影响 与正常对照组比较,模型组大鼠40 min内扭体反应次数和扭体反应发生率明显增高(P<0.01)。与模型组相比,川芎嗪注射液组可显著地降低大鼠扭体反应次数(P<0.01)和扭体反应发生率(P<0.05,见表1)。

表1 盐酸川芎嗪注射液对子宫收缩的相关影响Tab.1 Effect of tetramethylpyrazine injection on uterine contraction
2.2 盐酸川芎嗪注射液对痛经大鼠血液相关指标的影响与正常对照组比较,模型组大鼠血清中VEGF、hs-CRP含量明显增高(P<0.05),而盐酸川芎嗪注射液可显著减少血清中VEGF、hs-CRP的含量(P<0.05)。与正常对照组相比,模型组大鼠血清中NO含量显著减少(P<0.05)。而与模型组相比,盐酸川芎嗪注射液组的NO含量显著升高(P<0.05)。与正常对照组相比,模型组6-keto-PGF1a含量显著性降低(P<0.05),而川芎嗪注射液可显著升高 6-keto-PGF1a含量(P<0.05,见表2)。

表2 盐酸川芎嗪注射液对对痛经大鼠血液相关指标的影响Tab.2 Effect of tetramethylpyrazine injection on dysmenorrhea rats of blood indicators
2.3 盐酸川芎嗪注射液对痛经大鼠子宫组织中VEGFR-2蛋白表达水平的影响 Western blot结果显示:与正常组相比,模型组大鼠子宫中VEGFR-2蛋白表达水平明显升高(P<0.05),而盐酸川芎嗪给药组可显著减少痛经大鼠中VEGFR-2的蛋白的表达量(P<0.05,见图1)。
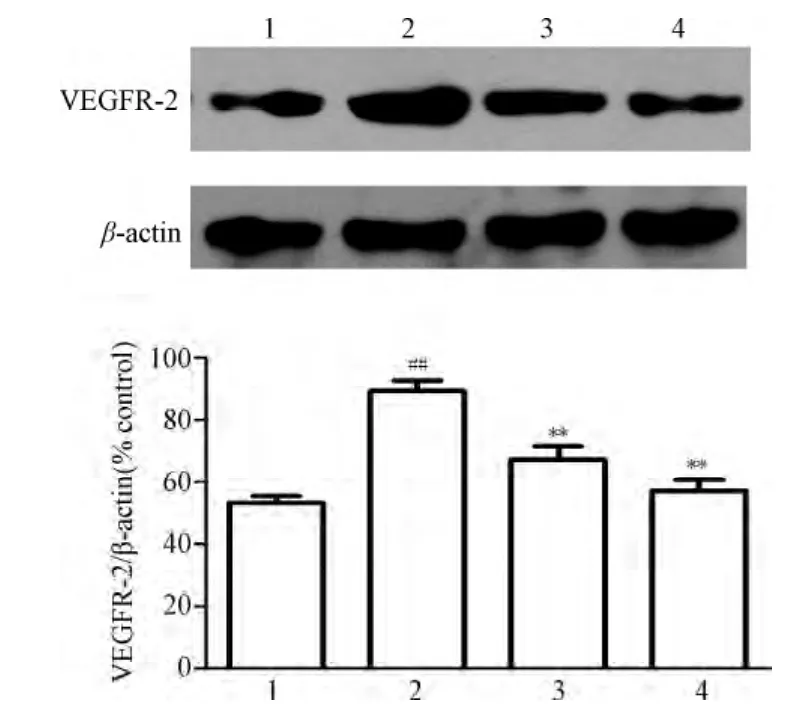
图1 盐酸川芎嗪注射液对大鼠子宫中VEGFR-2蛋白表达的影响1.正常对照组;2.模型组;3.盐酸川芎嗪注射液组;4.田七痛经组##P<0.01,与正常对照组比较,**P<0.01,与模型组比较Fig.1 Effect of tetramethylpyrazine injection on VEGFR-2 protein expression of rat uterus##P<0.01,compared with normal control group,**P<0.01,compared with model group
3 讨论
VEGF是一种作用很强的促血管生成因子,对内皮基质的增殖和血管生成有着极为重要的作用。研究表明,VEGF在肿瘤血管生成及生理条件下血管生成中起着重要的调控作用[4]。最近研究表明,原发性痛经的子宫内膜中VEGFR-2表达显著高于正常内膜的表达量[5]。因此,本文检测了原发性痛经大鼠血清中VEGF的含量及其子宫中VEGFR-2蛋白的表达,旨在探究盐酸川芎嗪注射液对原发性痛经大鼠的血清中VEGF含量及其子宫中VEGFR-2蛋白表达的影响。研究结果表明:与正常对照组大鼠相比,原发性痛经大鼠血清中VEGF含量明显升高,而盐酸川芎嗪注射液组可显著减少大鼠血清中VEGF含量。同时,模型组大鼠可显著上调VEGFR-2受体蛋白的表达,而盐酸川芎嗪注射液可显著下调VEGFR-2蛋白的表达。说明川芎嗪可能通过减少血清中VEGF的含量下调VEGFR-2蛋白的表达,减少子宫内皮血管的形成,从而减缓PD的发病症状。
内源性NO在调控血管张力中发挥着重要作用,其调控血管的作用机制与其提高细胞中鸟苷酸环化酶(guanylate cyclase,GC)的活性有关,通过提高细胞内cGMP表达水平,最终诱导血管舒张[6]。除调节血管张力外,研究表明,内源性NO的含量和合成与痛经患者的发病有密切关系,痛经患者内源性NO含量显著性减少后,会导致与其相关的生物信息传递功能发生异常,从而诱发痛经症状[7]。本研究结果表明,原发性痛经大鼠血清中NO含量较正常对照组显著性降低,而盐酸川芎嗪注射液可显著提高血清NO含量。说明盐酸川芎嗪注射液可通过升高NO含量,解除平滑肌痉挛,减缓原发性痛经症状。
hs-CRP是血浆中的一种C反应蛋白。C反应蛋白是一种全身性典型炎症反应蛋白,是急性期的非特异性标志物。血清hs-CRP具有激活补体、促进吞噬细胞的活性、刺激单核细胞表面和其他免疫调控功能[8-9]。最新相关研究表明,原发性痛经会导致血清中hs-CRP含量显著上升。因此,本文检测了大鼠血清hs-CRP含量,结果表明:原发性痛经性大鼠血清中 hs-CRP含量明显高于正常对照组,而盐酸川芎嗪注射液可显著减少血清中hs-CRP水平。说明盐酸川芎嗪可通过阻止hs-CRP诱发的级联炎症反应,促进炎症部位的修复,发挥其抗炎镇痛的药理作用。
原发性痛经主要的发病机制之一是前列腺素(PG)水平的升高,前列腺素主要包括前列腺素E2(PGE2)、前列腺素F2a(PGF2a)等。其中,6-酮前列腺素F1a(6-K-PGF1a)的主要来源是通过血管内皮细胞合成,其作用机制是促进腺苷酸环氧化酶的活性,增加血小板内源性cAMP的含量,抑制血小板的聚集,扩张微血管,增加血流量[10]。本研究结果表明:模型组大鼠血清中6-K-PGF1a的含量明显下降,而盐酸川芎嗪给药组可显著增加6-KPGF1a的含量。表明盐酸川芎嗪注射液可通过增加血清中6-KPGF1a含量,扩张子宫血管,促进微循环,发挥镇痛缓解的药理作用。
综上所述,盐酸川芎嗪注射液可显著减少子宫收缩导致的扭体次数,减少扭体频率。其可能作用机制是增加痛经大鼠血清中VEGF和hs-CRP含量,减少NO的血清浓度及增加血浆中6-keto-PGF1a含量,发挥其抗炎镇痛的作用。
[1]Bani S,Hasanpour S,Mousavi Z,etal.The effect of rosa damascena extract on primary dysmenorrhea:a double-blind cross-over clinical trial[J].Iran Red Crescent Med J,2014,16(1):e14643.
[2]杨雪梅.川芎嗪药理作用研究进展[J].中国生化药物杂志,2010,31(3):215-217.
[3]Jiang HR,Ni S,Li JL,etal.Systematic review of randomized clinical trials of acupressure therapy for primary dysmenorrhea[J].Evid Based Complement Alternat Med,2013,47(3):169-175.
[4]Nagineni CN,Raju R,Nagineni KK,etal.Resveratrol suppresses expression of VEGF by human retinal pigment epithelial cells:Potential Nutraceutical for Age-related Macular Degeneration[J].Aging Dis,2014,5(2):88-100.
[5]García-Manero M,Santana GT,Alcázar JL.Relationship between microvascular density and expression of vascular endothelial growth factor in patients with ovarian endometriosis[J].J Womens Health(Larchmt),2008,17(5):777-782.
[6]Hadi NR,Yusif FG,Yousif M,etal.Both castration and goserelin acetate ameliorate myocardial ischemia reperfusion injury and apoptosis in male rats[J].ISRN Pharmacol,2014,23(43):206-213.
[7]Molins-Cubero S,Rodríguez-Blanco C,Oliva-Pascual-Vaca A,etal.Changes in pain perception after pelvis manipulation in women with primary dysmenorrhea:A Randomized Controlled Trial[J].Pain Med,2014,31(3):211-217.
[8]Vedin O1,Hagström E,Gallup D,etal.Periodontal disease in patients with chronic coronary heart disease:Prevalence and association with cardiovascular risk factors[J].Eur J Prev Cardiol,2014,25(26):143-150.
[9]Carvajal-Zarrabal O,Nolasco-Hipolito C,Aguilar-Uscangamg,etal.Avocado oil supplementation modifies cardiovascular risk profile markers in a rat model of sucrose-induced metabolic changes[J].Dis Markers,2014,65(43):386-405.
[10]Zuo Y1,Cheng G,Gao DK,etal.Gross-total hematoma removal of hypertensive basal ganglia hemorrhages:a long-term follow-up[J].J Neurol Sci,2012,287(1-2):100-104.

