钨酸钠溶液氢氧化钙苛化-沉淀白钨的研究
万林生, 黄小晶, 杨亮, 邓登飞, 李红超, 谌勇明
(1.江西理工大学冶金与化学工程学院,江西 赣州341000;2.崇义章源钨业股份有限公司,江西 崇义341300)
实现白、黑钨的绿色冶炼是钨工业刻不容缓的技术发展目标[1-4].自1781年瑞典化学家K.W.席勒(K.W.scheele)用硝酸分解白钨矿制取出钨酸以来,全世界均采用白、黑钨矿酸、碱浸出-净化-铵盐转型工艺生产仲钨酸铵(APT).传统的化学沉淀工艺、萃取工艺和离子交换工艺必须使用氢氧化钠、盐酸(浸出剂)和氯化铵(转型剂),由于Na+和Cl-化学性质活泼,难与不溶化合物实现沉淀分离,体系中Na+和Cl-无法闭路循环.因此受工艺原理的限制,3种现行工艺均无法实现废水零排放.
作者摆脱沿袭二百多年传统工艺的束缚、研发出铵盐不变体系白钨冶炼工艺,实现了白钨矿闭路冶炼和废水零排放[5].由于难以找到黑钨矿的铵盐浸出剂,该工艺目前难以直接应用于黑钨和黑白钨混合矿的冶炼[2].因此设想先将黑钨或黑白钨混合矿加氢氧化钠分解,分解所得钨酸钠溶液加入钙盐沉淀出人造白钨,再后接铵盐不变体系白钨冶炼工艺以实现黑钨和黑白钨混合矿的绿色冶炼.
传统的钨冶炼经典工艺中,氢氧化钠分解所得钨酸钠溶液净化除磷、砷、硅后,采用氯化钙作沉淀剂获得人造白钨[6-9].虽然易溶的氯化钙可以获得较高的Ca2+离子浓度和白钨沉淀率,但产出的NaCl沉淀母液不能作为分解试剂返回钨矿分解工序,且由于Na+和Cl-化学性质活泼,难以形成不溶化合物实现沉淀分离,沉淀母液无法实现闭路循环,必须开路排放;因此设想采用氢氧化钙作沉淀剂,则反应生成固体CaWO4和NaOH溶液,可同时获得人造白钨和苛化母液,所得NaOH母液及未沉淀完全的少量钨酸钠可以返回用于黑钨或黑白钨混合矿分解,在提高钨回收率的同时实现沉淀母液的闭路循环.
本文在研究钨酸钠溶液氢氧化钙苛化-沉淀白钨原理的基础上,通过试验探明了氢氧化钙用量、钨酸钠溶液钨浓度、温度、保温时间和搅拌速度对白钨沉淀率的影响规律,确定了最佳的工艺技术条件.
1 实验部分
1.1 实验试剂
以某厂黑钨矿碱分解工序生产所得高浓度Na2WO4溶液 (其 WO3浓度为 314.9 g/L,NaOH 为54.32 g/L)和氢氧化钙(分析纯)为实验原料.
1.2 实验设备
低温试验采用DF-1型集热式恒温磁力搅拌器;高温试验采用WHF-1型自控反应釜.
1.3 实验方法
将高钨浓度钨酸钠原料溶液加入一定量的纯水稀释至设定的WO3浓度后,量取一定体积的钨酸钠溶液放入恒温磁力搅拌器或自控反应釜中,加入定量的氢氧化钙后按设定的温度和搅拌速度开始试验,达到温度后计时至设定的保温时间即完成试验.用纯水分次洗涤沉淀出的人造白钨,直至洗后液pH值至中性.将过滤得到人造白钨放入鼓风干燥箱内烘干、称重,并按要求作检测分析.
2 钨酸钠溶液氢氧化钙苛化-沉淀白钨的反应原理
2.1 反应的平衡常数和标准自由能变化
钨酸钠溶液氢氧化钙苛化-沉淀白钨反应式如下:

用离子反应式表示为:

反应达到平衡时,其平衡常数Ka和标准自由能变化ΔG°可由CaWO4和Ca(OH)2的溶度积计算得出:
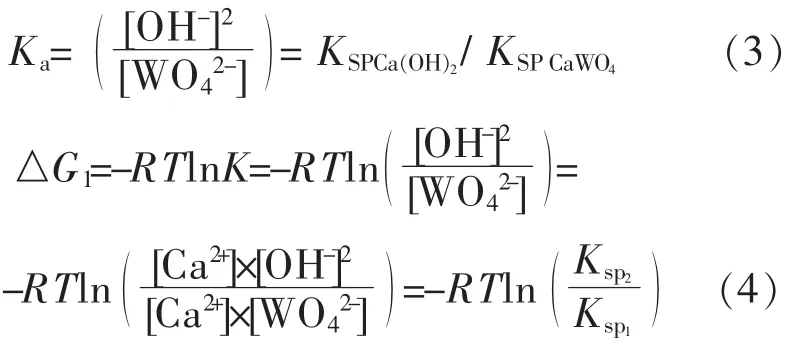
根据表1中不同温度下CaWO4和Ca(OH)2溶度积数据[10-11]计算出钨酸钠溶液氢氧化钙苛化-沉淀白钨反应的标准自由能变化ΔG°和反应的平衡常数Ka如表2所示.

表1 氢氧化钙和钨酸钙的溶度积

表2 反应的标准自由能变化ΔG1及平衡常数K a
理论计算表明,在常温下钨酸钠溶液氢氧化钙苛化-沉淀白钨反应的生成,其吉不斯自由能即为负值,反应能自动向右进行,但反应的平衡常数并不是很大,为提高钨的回收率沉淀母液必须返回用于钨矿的分解;虽然氢氧化钙和钨酸钙在水中的溶度积均随温度升高而降低,但由于钨酸钙的溶度积下降的幅度大于氢氧化钙,反应的平衡常数Ka随温度升高而增大,高温下沉淀白钨的反应较为完全.
2.2 氢氧化钠和钨酸钠的活度系数对反应平衡的影响
理论计算的平衡常数仅表征生成物和反应物的活度商.钨酸钠溶液氢氧化钙苛化-沉淀白钨的反应是Na2WO4浓度逐渐降低、NaOH浓度逐渐升高的过程,反应的平衡常数与不同浓度下Na2WO4和NaOH的活度系数密切相关.由表3和表4中NaOH溶液和Na2WO4溶液的平均活度系数[12-15]的变化趋势可知,随浓度增加NaOH活度系数增大而Na2WO4的活度系数减小.显然将WO3/NaOH比值一定的黑钨矿碱分解所得Na2WO4溶液进行适当稀释,作为反应产物NaOH的活度系数将相应减小,而反应物Na2WO4的活度系数相应增大,从而增大钨酸钠溶液氢氧化钙苛化-沉淀白钨反应的平衡常数,使沉淀白钨的反应更为完全.

表3 NaOH溶液在70℃下的平均活度系数

表4 Na2WO4溶液在252℃下的平均活度系数
3 钨酸钠溶液氢氧化钙苛化-沉淀白钨工艺的研究
3.1 温度对白钨沉淀率的影响
将300 mL钨酸钠料液 (WO3含量为105 g/L,NaOH 18.11 g/L)放入反应器中,在氢氧化钙用量为1.4倍理论量,转速350 r/min,保温时间2 h的条件下进行试验,温度对白钨沉淀率的影响见图1.

图1 温度对白钨沉淀率的影响
试验结果表明,温度对白钨沉淀率的影响非常显著.当温度从20℃升高到100℃时,白钨沉淀率由20.5%提高到96.4%.这与温度升高钨酸钙的溶度积下降的幅度大于氢氧化钙,反应的平衡常数Ka随温度升高而增大有关,结果与表1和表2数据中反映的规律相符.按照起始钨酸钠料液WO3和 NaOH的浓度及图1中试验结果(部分取插入值)计算,25℃、50℃、90℃、100℃时反应的平衡浓度商分别为2.29、4.62、55.1、109.9, 均低于表 2 中对应温度下的理论平衡常数.这表明试验条件下反应产物NaOH的活度系数大于反应物Na2WO4的活度系数.
3.2 稀释钨酸钠溶液对白钨沉淀率的影响
将实验用高浓度实验钨酸钠料液进行稀释,分别取300 mL WO3浓度为:314.9 g/L (含 NaOH 54.32 g/L)、262.4 g/L(含 NaOH 45.27 g/L)、209.9 g/L(含 NaOH 36.21 g/L)、157.5 g/L(含 NaOH 27.16 g/L)、105 g/L(含NaOH 18.11 g/L)的钨酸钠料液各自放入反应器中,在钨酸氢氧化钙用量为1.4倍理论量,温度100℃,转速350 r/min,保温时间2 h的条件下进行试验,钨酸钠溶液浓度对白钨沉淀率的影响见图2.
试验结果表明,对钨酸钠料液进行稀释可使沉淀白钨的反应更为完全.由图2可知,白钨沉淀率随钨酸钠料液钨浓度降低而显著升高.钨酸钠料液钨浓度由314.9 g/L稀释到105 g/L,白钨的沉淀率由35.5%大幅升高至96.4%.在钨浓度由314.9 g/L稀释至209.9 g/L阶段白钨的沉淀率升高的幅度较大.结果证明稀释将使NaOH活度系数增大而Na2WO4的活度系数减小,从而增大钨酸钠溶液氢氧化钙苛化-沉淀白钨反应的平衡常数.
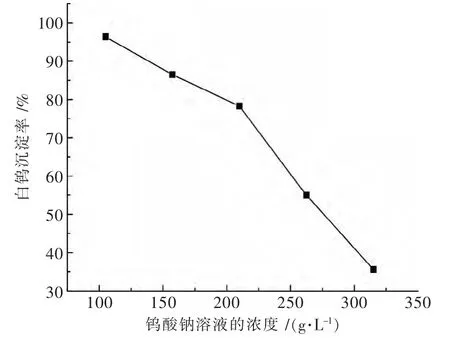
图2 钨酸钠溶液浓度对白钨沉淀率的影响
3.3 氢氧化钙用量对白钨沉淀率的影响
分别取 300 mL WO3含量为 105 g/L,NaOH 18.11 g/L的钨酸钠料液各自放入反应器中,在温度100℃,转速350 r/min,保温时间2 h的条件下,氢氧化钙用量对白钨沉淀率的影响见图3.
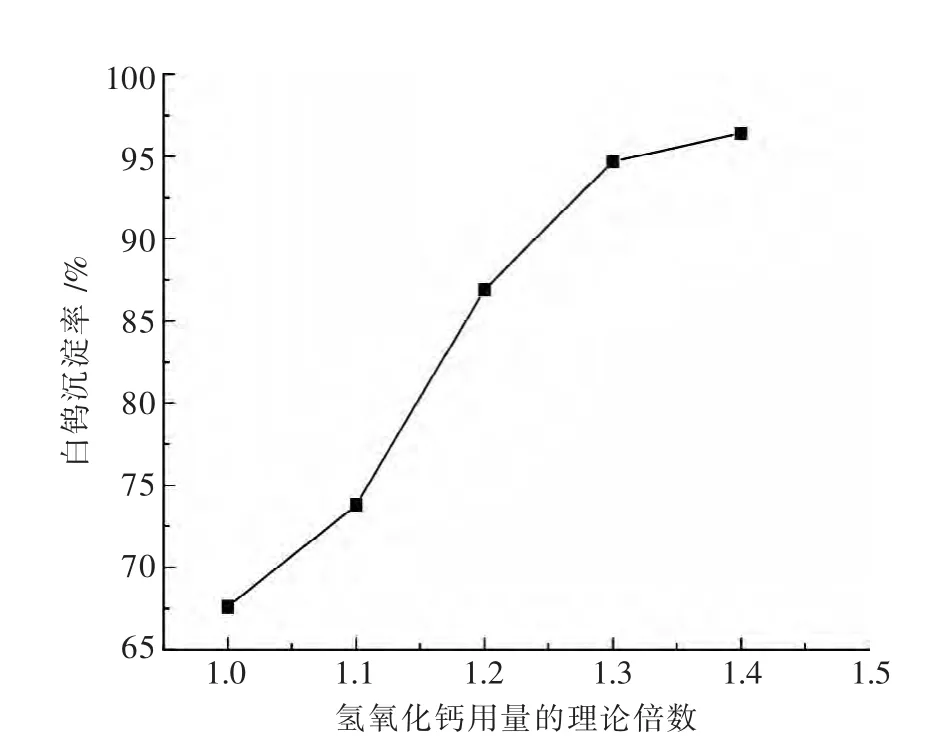
图3 氢氧化钙用量对白钨沉淀率的影响
由图3可见,在一定范围内随着氢氧化钙用量的不断加大,白钨的沉淀率也随之升高.当氢氧化钙用量由1.2倍加大到1.3倍时,白钨的沉淀率由86.9%提高到了94.7%.但当氢氧化钙用量大于理论用量1.4倍时,白钨的沉淀率达到最大值96.4%,继续增大氢氧化钙用量,沉淀率有所下降.
研究结果表明,与传统工艺采用氯化钙作为沉淀剂(理论量倍数1.05)相比,氢氧化钙沉淀白钨所需的理论量倍数较大,且白钨的沉淀率相对较低.这与氢氧化钙是溶解度较小的难溶化合物,反应溶液中Ca2+浓度较低,反应的平衡常数较小有关.沉淀所得NaOH母液可以也必需返回用于黑钨或黑白钨混合矿分解,以实现闭路循环.
3.4 保温时间对白钨沉淀率的影响
分 别 取 300 mLWO3含 量 为 105 g/L,NaOH 18.11 g/L的钨酸钠料液各自放入反应器中,在氢氧化钙用量为1.4倍理论量,温度100℃,转速350 r/min,保温时间对白钨沉淀率的影响见图4.
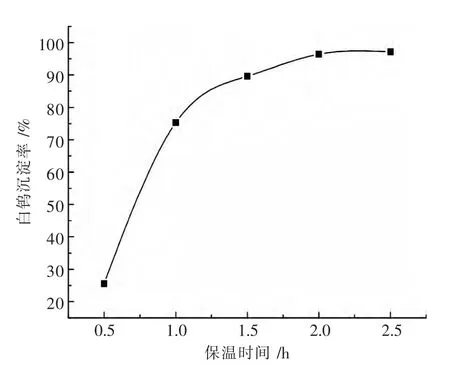
图4 保温时间对白钨沉淀率的影响
实验结果表明,随着保温时间的增加,白钨沉淀率呈快速递增的趋势.当保温时间由0.5 h增加到1 h,白钨沉淀率也由25.6%提高到75.3%.保温时间为2 h白钨沉淀率达到96.4%,继续延长保温时间,白钨沉淀率变化不大.与传统工艺采用氯化钙作为沉淀剂相比,氢氧化钙沉淀白钨所需的反应时间大幅度增加,这主要是因为氢氧化钙的溶解度远小于氯化钙,溶液中钙离子的浓度很低,且悬浮的氢氧化钙粒子严重影响了钨酸钙的扩散和长大,从而降低了氢氧化钙沉淀白钨的反应速度.
3.5 搅拌速度对白钨沉淀率的影响
分别取 300 mL WO3含量为 105 g/L,NaOH 18.11 g/L的钨酸钠料液各自放入反应器中,在氢氧化钙用量为1.4倍理论量,温度100℃,保温时间为2 h,搅拌速度对白钨沉淀率的影响见图5.
实验结果表明,白钨沉淀率随搅拌速度加快而增大.当搅拌速度由200 r/min提高到350 r/min时,白钨沉淀率由72.6%增加到96.4%.与传统工艺采用氯化钙作为沉淀剂相比,氢氧化钙沉淀白钨需要较快搅拌速度.这与工艺需要使用1.4倍理论量的氢氧化钙有关,因为过量的氢氧化钙悬浮粒子会阻碍钨酸钙分子扩散,影响白钨晶粒的生长,但提高搅拌速度有助于改善传质条件.
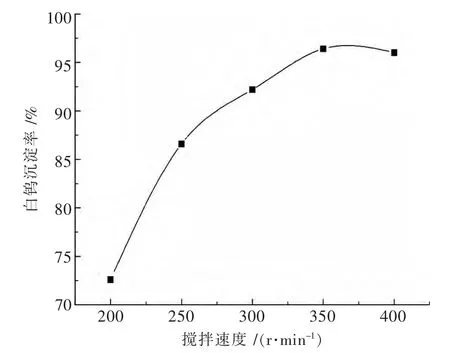
图5 搅拌速度对白钨沉淀率的影响
4 结 论
1)钨酸钠溶液氢氧化钙苛化-沉淀白钨工艺是实现钨矿NaOH分解试剂回收,以至黑钨和黑白钨混合矿绿色冶炼的技术途径.
2)钨酸钠溶液氢氧化钙苛化-沉淀白钨的技术条件为:氢氧化钙用量为1.4倍理论量,温度100℃,钨酸钠溶液钨浓度为105 g/L,保温时间为2 h,搅拌速度为350 r/min.上述试验条件下白钨沉淀率可以达到96%以上.
3)温度和钨酸钠溶液浓度对白钨沉淀率的影响非常显著.与传统工艺采用氯化钙作为沉淀剂相比,氢氧化钙沉淀白钨所需的理论量倍数较大,反应时间较长,搅拌速度更快.
[1]万林生,赵奎,羊建高,等.钨冶金[M].北京:冶金工业出版社,2011:49.
[2]万林生,邓登飞,赵立夫,等.钨绿色冶炼工艺方向和技术进展[J].有色金属科学与工程,2013,4(5):15-18.
[3]万林生,赵立夫,李红超.章源钨业APT绿色冶炼的技术进步和发展[J].中国钨业,2012,279(1):23-26.
[4]万林生,徐国钻,严永海,等.中国钨冶炼工艺发展历程及技术进步[J].中国钨业,2009,24(5):63-66.
[5]万林生,赵立夫,黄泽辉,等.一种铵盐分解白钨矿的方法:中国,ZL201110063533.0[P].2011-08-17.
[6]范树森.钨酸钙的粒度控制及白钨母液中钨的回收[J].稀有金属与硬质合金,1993(2):13-16.
[7]李裕芳,赖道玉.不同颗粒人造白钨的制取[J].中国钨业,1990(11):11-14.
[8]李自强,何良惠.沉淀白钨的条件分析[J].稀有金属,1987(4):249-252.
[9]路辉,谢刚,俞小花,等.仲钨酸铵结晶母液处理技术研究进展[J].稀有金属与硬质合金,2009,37(4):44-47.
[10]叶大伦,胡建华.实用无机物热力学数据手册[M].北京:冶金工业出版社,2002.
[11]王海川,董元篪.冶金热力学数据测定与计算方法[M].北京:冶金工业出版社,2005.
[12]李洪桂.钨矿物原料碱分解的基础理论及新工艺[M].长沙:中南工业大学出版社,1997.
[13]李运姣,李洪桂,刘茂盛.白钨矿碱分解过程的热力学和动力学研究[J].中国有色金属学报,1990(1):39-45.
[14]孙培梅,李运姣,李洪桂,等.白钨矿碱分解过程的热力学研究[J].中国有色金属学报,1993(2):37-43.
[15]李运姣,孙培梅,刘茂盛,等.白钨矿的机械活化碱分解[J].中国有色金属学报,1995(3): 27-29.

