药物性肝损害213例临床特点及诊治体会
崔忠敏 赵佳钧 任丽楠 吴春燕
药物性肝损害(Drug-induced liver injury,DILI)是指使用药物进行治疗过程中,由于药物和(或)其代谢产物的直接毒性作用,或者由于机体对药物和(或)其代谢产物的过敏反应,对肝脏造成损伤所引起的疾病[1]。近年来,随着医药科技的不断发展,各类新药的不断涌现和广泛应用,DILI的发病率呈上升趋势,可以导致DILI的药物已达1000余种[2]。文献报道[3],DILI占所有药物所致不良反应的10%~15%,据世界卫生组织统计[4],DILI已上升至全球死亡原因的第5位。因此,DILI已成为十分严重的用药安全问题,应引起广大临床医务工作者的高度关注。本研究通过对确诊的213例急性DILI患者的相关临床资料进行回顾性分析,探讨其临床特点和发病规律,以期为临床用药提供参考,同时,提高临床医师对DILI的认识,尽可能减少其发生。
材料与方法
一、一般资料
本研究收集整理了2003年1月至2013年12月间我院消化内科收治并确诊的急性DILI患者共213例。其中男77例,女136例。年龄16~83岁,平均(56.48±13.83)岁。
二、诊断标准[5-6]
①有明确的服药史。②用药后数周至数月内出现肝功能损害的临床症状、体征及实验室检查指标的异常;初发症状有疲乏、纳差、恶心、呕吐、发热、皮疹、瘙痒、黄疸等。③末梢血中嗜酸粒细胞>0.6。④有肝内淤胆或肝实质细胞损害的病理或临床征象。⑤各型肝炎病毒标志物(甲~庚型肝炎、EB病毒及巨细胞病毒)均阴性,并排除酒精性、自身免疫性、遗传性肝病及肝占位性病变。⑥偶然再次用药后又发生肝损害。上述标准①加上②~⑥中任何2项,就可确诊为药物性肝损害。
三、临床分型
按文献报道的分类标准[6-7]将药物性肝损害分为3型:肝细胞损害型,谷丙转氨酶(ALT)≥2倍正常值上限或ALT/碱性磷酸酶(AKP)≥5;胆汁淤积型,AKP≥2倍正常值上限或ALT/AKP≤2;混合型,ALT、AKP均≥2倍正常值上限且ALT/AKP介于2~5之间。
四、疗效判断标准[8]
显效:临床症状、体征消失,肝功能指标(ALT、AST、AKP、TBIL)恢复正常;有效:临床症状、体征好转,肝功能指标较治疗前下降50%以上;无效:临床症状、体征无明显改善,肝功能指标改善不明显或加重。以显效率和有效率合计为总有效率。
五、研究方法
采用回顾性调查方法,查阅病历,根据诊断标准记录用药史、用药途径、临床表现、血常规、肝功能检查结果、各种病毒性肝炎血清标志物、治疗经过、治疗用药及预后等。
结 果
一、导致DILI的药物及给药途径
所涉及的药品共9大类,涉及具体药物近50余种,几乎包括临床各内科系统用药。位列前四位的药品分别为:①非甾体类抗炎药,如阿斯匹林、对乙酰氨基酚类等55例,占25.8%;②中草药及中成药,如雷公藤、何首乌等中成药以及治疗外伤、生发、皮肤病等的中药方剂等46例,占21.6%;③抗结核药,如利福平、异烟肼等39例,占18.3%;④免疫抑制剂,如环孢霉素A、硫唑嘌呤等29例,占13.6%。其他尚有肿瘤化疗药、抗生素、降糖药、抗甲状腺功能亢进药、降脂药及神经精神疾病用药等,详见表1。其中应用2种及以上肝损害药物的比例达25.8%(55例)。用药途径以口服为多,占51.2%(106例),静脉滴注占22.1%(47例),静脉注射6.6%(14例),肌肉注射5.6%(12例),外用和皮下给药各0.5%(各1例),两种或两种以上途径给药16.4%(35例)。
二、临床表现
服药至发病的时间间隔为1~18个月,1个月内发病50例,2~3个月发病76例,3个月以上发病87例。小部分患者无明显临床症状,仅实验室检查结果异常,本组资料为6例,占2.82%。临床表现多样化,没有特异性,差异较大,与病毒性肝炎不易鉴别,以乏力、纳差最为多见。多数病例表现为消化道症状,如恶心、呕吐、腹部疼痛或不适、黄疸等,少数患者仅仅表现为皮疹、腹泻、关节痛或腰痛,应注意区别,见表2。

表1 引起药物性肝损害的药物种类及构成

表2 药物性肝损害的临床表现
三、实验室检查及临床分型
主要为肝功能化验异常,部分病例同时出现多项检验指标的异常。所有患者病毒性肝炎标志物均阴性。血常规:嗜酸性粒细胞比例增高者130例,占61.03%。肝功能:以ALT升高为最多见,占82.62%;其次是AST升高,占61.03%;再次为TBIL升高,占57.27%,以直接胆红素升高为主。此外,AKP及GGT也有不同程度的改变(见表3)。本组病例临床分型特点:肝细胞型46例,占21.60%;胆汁瘀积型116例,占54.46%;混合型51例,占23.94%。
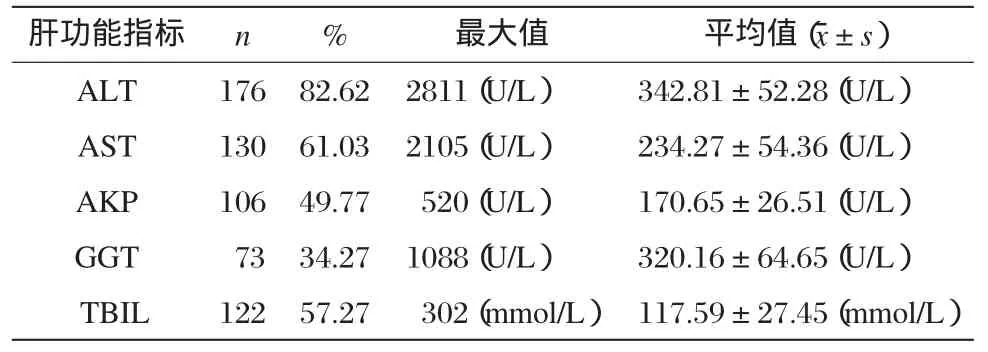
表3 213例药物性肝损害患者肝功能指标变化
四、治疗及转归
临床诊断一旦明确后,在患者病情允许的情况下,特别是器官移植术后及肿瘤接受化疗者,应立即停用引起肝损害的药物或可疑药物,卧床休息,给予高蛋白、高糖、低脂饮食,补充维生素B、C、E;应用解毒药物促进有害药物的代谢:根据情况选用改善肝细胞代谢、稳定肝细胞膜、保护肝细胞功能等药物,同时予支持治疗。治疗用药包括还原型谷胱甘肽、异甘草酸镁、复方甘草酸苷、甘草酸二铵、多烯磷脂酰胆碱、熊去氧胆酸等,淤胆型病例或胆红素升高者适当加用糖皮质激素或S-腺苷蛋氨酸等药物;防止并发急性肝衰竭,如并发急性肝衰竭,抢救时可用血液灌流、血浆置换等。本组病例资料显效154例,占72.3%,有效46例,占21.6%,总有效率为93.9%(200例)。无效9例,占4.2%,其中5例因经济状况自动出院,4例因肿瘤化疗无法停药。死亡4例,占1.9%,其中2例死于急性肝衰竭,1例死于肺癌化疗期间,另1例因同时合并急性肾功能衰竭而死亡。
讨 论
药物性肝损害在临床上较为常见,其发生率仅次于药物疹和药物热,位居药物反应的第三位[9]。它可以发生在以往没有肝病史的健康者或原来就有严重疾病的病人。由于各种新型药物和各种植物性药物不断地大量上市,目前应用于临床的药物已逾万种。肝脏是药物代谢的主要器官,大多数药物均系在肝内进行氧化、还原、水解、羟化、脱疏基和脱羧基等代谢过程,再由胆道系统排泄,这使肝脏与药物有着十分密切的关系,也决定了肝脏易受到药物的损害。目前已报道能引起肝损害的药物种类已达1 000多种[2,10]。本组资料仅收集了213例患者的有关资料,可所涉及的药物品种却有9大类,涉及的具体药物就有近50余种,再一次说明药物性肝损害的确是一个不容忽视的临床问题。
引起肝损害的药物可分为两类:一类为可预测的肝损害,其损害程度与药物剂量有关,由药物本身引起肝损害(直接损害),如四环素、利福平等;另一类为不可预测的肝损害,系因患者特异体质对某种药物或其代谢产物过敏所致,其肝损害程度与用药剂量无关,如氯丙嗪、磺胺、对氨基水杨酸等[11]。药物性肝损害的易感因素受年龄、性别、合并用药、环境因素、基础疾病及遗传易感性等多种因素影响,某些情况下多种药物的联合应用可使药物性肝损害的风险增加[12]。本组病例中有55例同时应用了2种及以上药物导致了肝损害,所占比例达25.8%,至于联合用药者肝损害发生率是否更高、损害程度是否更重等尚需进一步研究证实。
各类药物引起肝损害的比例国内外报道不一致,国内多以抗微生物药、非甾体类抗炎药、抗结核药和抗肿瘤药物为主,国外也有以抗生素为主的报道[13-15]。本研究显示位列前四位的药品分别为非甾体类抗炎药、中草药及中成药、抗结核药及免疫抑制剂,比例分别为25.8%、21.6%、18.3%及13.6%,这与上述的文献报道不完全一致,可能与样本量小有关。非甾体类抗炎药是我国消耗量最多的药物品种之一,滥用现象十分严重,也十分普遍,而且多为非处方用药,缺乏医师指导,如患者“感冒发烧”时往往自行购买抗感冒药(主要成分为对乙酰氨基酚)服用,加之随着人口老龄化,心脑血管疾病发病率不断上升,将有更多的人预防性长期应用此类药物(如阿司匹林等),因此,如何更好地规范此类药物的应用,以减少不必要的肝损害作用必须引起足够的重视。非甾体类抗炎药物造成肝损害的机制大多数为特异体质反应,少数为直接或者间接毒性,所以非必须情况下应尽量避免使用。值得注意的是本研究中有46例患者的肝损害与应用中草药及中成药有关,位列第二位,进一步说明中药也有肝毒性,这就提醒我们应警惕中药的毒副作用。传统观念认为“中药安全,不良反应少”,但实际上大多数中药制剂成分复杂,难以在药物上市前通过随机对照试验证明其有效性和安全性。因此临床医师应该提高对中草药毒副作用的认识,在临床实践中严格掌握适应证,规范中药制剂的使用,正确宣传中药的疗效,减少滥用及长期使用中药,用药期间动态检测肝功能,及早发现中草药的肝损害,及时停药以减少DILI的发生[16-18]。抗结核药物的肝毒性是毋庸置疑的,本研究中有39例,位列第三位。文献中报道[19],异烟肼、利福平、吡嗪酰胺对肝脏的损害作用明显,联合用药其药物性肝损害的发生率可高达17.2%~25.0%,少数能发生重症肝炎。因此作为临床医师,应严格掌握此类药物的适应证,密切观察患者的不良反应,如发生不良反应应当及时处理。随着器官移植的广泛开展,免疫抑制剂的使用对肝脏的损害也逐渐增加[20]。本研究中有29例为肾移植、肝移植术后患者,因长期服用环孢素A、骁悉等导致肝损害。而这些患者考虑为DILI后,又不能停用免疫抑制剂,只能调整剂量或改用其他替代药物并加用肝细胞保护剂和解毒、加速胆汁排泄等药物,并且定时监测肝功能变化。本研究显示可以引起肝损害的药物尚有肿瘤化疗药、抗生素、降糖药、抗甲状腺功能亢进药、降脂药及神经精神疾病用药等,文献报道的药物还包括:抗痛风药物(别嘌呤醇)、助消化药物、质子泵抑制剂、激素、维生素类、营养类药物、酶制剂、老年病用药(骨质疏松药、前列腺增生用药)以及调节水、电解质、酸碱平衡药物等[21-22]。
本研究中,以乏力、纳差等非特异性表现为DILI主要症状,有32.4%出现黄疸,仅11.6%患者出现明确的皮疹,8.2%出现皮肤瘙痒,尚有少数患者仅仅表现为皮疹、腹泻、关节痛或腰痛。说明DILI临床表现多样化,差异较大,其起病急缓、临床特征、疾病严重程度的变化很大,大部分表现为急性肝炎的临床症状、体征,故常被误诊、漏诊[23]。提示临床医师处理肝病患者时,应时刻考虑到DILI的可能性,仔细询问服药史。药物性肝损害分型中以胆汁淤积型为多见,这与药物通过肝脏代谢,致其在肝脏蓄积并引起胆汁淤积有关。
关于肝损害发生的时间及与用药途径的关系,本研究结果显示服药至发病的时间间隔1个月内者50例,2~3个月76例,3个月以上发病87例。用药途径以口服为多,占51.2%(106例),其次为静脉滴注占22.1%(47例),此外尚有静脉注射、肌肉注射、外用和皮下给药等,并且两种或两种以上途径给药者有35例,占16.4%。分析其原因是本研究中引起DILI最常见的两类药物是非甾体类抗炎药及中草药,而这两类药物给药途径均为口服为主,此外,口服药物进入胃肠后经吸收必定经过肝脏代谢,对肝脏的影响也较大。朱磊等[21]的研究也显示患者肝损害发生的时间存在很大差异,最早者用药1 d即出现肝损害,最长175 d。但他们的研究同时表明不同给药途径致肝损害时间有差别。在导致DILI的给药途径中,静脉滴注比例最高,高达71.83%,引起肝损害时间较短,这与药物直接毒性或高敏反应有关;口服给药占24.88%,引起肝损害时间较长,这与患者长期服用药物,药物口服后要经过肝脏代谢有关。本组资料总体预后良好,显效154例,占72.3%,有效46例,占21.6%,总有效率为93.9%。有作者报道[24]药物性肝损害多数预后良好(91.1%),预后不良者多为应用抗肿瘤药、中草药和有基础肝病患者应用抗结核药物,究其原因尚不能排除基础疾病较重所致。相关因素分析表明,TBIL、DBIL峰值水平和ALB、PLT谷值水平是与预后相关的因素。本组资料主要治疗用药包括还原型谷胱甘肽、异甘草酸镁、复方甘草酸苷、甘草酸二铵、多烯磷脂酰胆碱、熊去氧胆酸等及S-腺苷蛋氨酸等,并以甘草酸类制剂为主。临床研究也证实甘草酸类制剂用于治疗DILI,其疗效是明确的[8,25]。
综上所述,目前对于DILI尚无确切的诊断方法,因此详细了解患者的服药史,结合临床表现及实验室检查,排除病毒性肝炎等疾病以及做到及时诊断处理至关重要。DILI临床比较常见,应予以高度重视,重在预防,应避免滥用及大量用药。用药应注意个体化,对新生儿、老年人、肝肾功能不全者,药物的使用时间和剂量更要慎重考虑。对发生过DILI的患者,应避免再次使用相同或结构相似的药物。用药期间应注意患者的病情变化,动态检测肝功、血常规。尽早发现、尽早停药,尽早治疗。
1 Stine JG,Lewis JH.Drug-induced liver injury:a summary of recent advances.Expert opin Drug Metab Toxicol,2011,7(3):875-890.
2 Shi Q,Hong H,Senior J,et a1.Biomarkers for drug-induced liver injury.Expert Rev Gastroenterol Hepatol,2010,4(2):225-234.
3 蔡皓东.药源性肝损害.药物不良反应杂志,2003,5(2):101-106.
4 Liver Doctor Editorial Department.The mortality of drug indueed liver disease ranked at the fifth in the world.Liver Doctor,2006,(5):68-69.
5 郑芝田.胃肠病学.3版,北京:人民卫生出版社,2000:1026-1029.
6 Bénichou C.Criteria of drug-induced liver disorders.Report of an international consensus meeting.J Hepatol,1990,11(2):272-276.
7 Zakim D,Thomas D.Hepatology.Third edition,USA WB Sanders Company,1996:962-967.
8 刘超.异甘草酸镁治疗药物性肝损害36例.中国药业,2013,22(7):80.
9 胡志明.128例药物性肝病分析.中国当代医药,2012,19(4):21-22.
10 Ikeda T.Drug-induced liver injury.Nippon Yakurigaku Zasshi,2006,127(2):454-459.
11耿福云.药物性肝病的临床诊治体会.中外医学研究,2011,9(26):123-124.
12孟珺,曾康健,何光明.225例药物性肝损害临床分析.今日药学,2013,23(6):373-377.
13 Andrade RJ,Lucena MI,Fernández MC,et al.Drug-induced liver injury:an analysis of 461 incidences submitted to the Spanishregistry over a 10-year period.Gastroenterology,2005,129(2):512-521.
14中华医学会消化病学分会肝胆疾病协作组.全国多中心急性药物性肝损伤住院病例调研分析.中华消化杂志,2007,27(7):439-441.
15吴晓宁,尤红,贾继东.2003-2007年国内药物性肝损伤临床特点文献综合分析.肝脏,2008,13(6):463-466.
16贺俊英.85例药物性肝损害的临床分析.中国实用医药,2013,8(20):194-195.
17周世明,贾杰.696例药物性肝损害药物的临床分析.中国药物与临床,2007,7(6):442-443.
18刘平.中草药的肝损伤的问题.中华肝脏病杂志,2009,4(12):2119.
19李新成.药物性肝炎临床治疗体会.吉林医药,2011,32(15):3015.
20李岩.药物性肝病.中国实用内科杂志,2006,26(21):1670.
21朱磊,黄萍,李颖.162例药物性肝损害不良反应/事件报告分析.中国药物警戒,2013,10(7):415-418.
22 Tafazoli S,Mashregi M,Obrien PJ.Role of hvdrazine in isoniazidinduced hepatotoxicity in a hepatocyte inflammation model.Toxieol Appl Pharmaeol,2008,229(1):94-101.
23郑金莲,胡操寒,卢成鸿,等.药物性肝损害152例临床分析.全科医学临床与教育,2013,11(3):299-301.
24张琪,彭劫,侯金林.药物性肝损害临床特点及预后相关因素分析.广东医学,2008,29(7):1102-1103.
25刘鸿凌,尹明红,游绍莉,等.甘草酸制剂治疗药物性肝损害患者疗效观察.实用肝脏杂志,2013,16(3):257-258.

