马铃薯贮藏期主要病害拮抗内生细菌的筛选、鉴定及功能评价
王颖,王玉琴,杨成德,姚玉玲,陈秀蓉,薛莉
(甘肃农业大学草业学院 草业生态系统教育部重点实验室 甘肃省草业工程实验室 中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
我国是世界第二大草地资源国家,拥有天然草地近432 hm2,而在各类草地中,高寒草甸类草地面积最大,占全国草地总面积的17.77%;线叶嵩草(Kobresia capillifolia)是高寒草甸类草地的优势牧草之一[1],其大量的内生细菌是挖掘优良生物学功能菌株的微生物资源库。随着生态农业和绿色食品生产的兴起和发展,作物病虫害的生物防治越来越受到人们的重视。已从小麦(Triticum aestivum)[2-3]、水稻(Oryza sativa)[4]、马铃薯(Solanum tuberosum)[5]、番茄(Lycopersicon esculentum)[6]、柑橘(Citrus reticulata)[7]、烟草(Nicotiana tabacum)[8]、大豆(Glycine max)[9]、棉花(Gossypium)[10]和油茶(Camellia oleifera)[11]等植物中分离得到拮抗内生细菌。拮抗内生细菌防治范围广,对细菌病害、真菌病害和线虫病害都有一定的作用,因此,内生细菌作为一种生防资源,已成为近年来生防菌剂研制开发的热点[12-13]。不少学者对内生细菌的生物学功能进行了深入研究,发现内生细菌不仅可以通过产生植物生长素、赤霉素及细胞激动素等植物促生物质[14]来促进植物生长,而且可以通过溶磷作用[15-16]和固氮作用[17-18]转化无效营养为有效营养,刺激和调控植物生长,增强植物抗病和抗逆能力等。因此,开发应用内生细菌资源不仅能解决化学农药和肥料带来的诸多问题,还能保持农田微生态系统多样性,维持农田生态平衡,提高作物产量,实现农业的可持续发展。
马铃薯坏疽病(Phoma foveata)、炭疽病(Colletotrichum coccodes)和枯萎病(Fusarium avenaceum)是甘肃省马铃薯贮藏期最主要的病害,在重病区引起的烂薯率在30%以上[19-21]。因此,本研究以东祁连山高寒草地线叶嵩草内生细菌为对象,以马铃薯贮藏期坏疽病菌、炭疽病菌和枯萎病菌为指示菌进行了筛选,对拮抗细菌的分泌IAA、溶磷和固氮等能力进行了评价,并对其进行16S r DNA序列鉴定,以期为线叶嵩草生防内生细菌的利用与开发提供理论依据,也为马铃薯贮藏期病害生物防治提供优质菌种资源。
1 材料与方法
1.1 材料
1.1.1 供试拮抗细菌 2012年7月分离自东祁连山高寒草地线叶嵩草中的44株内生细菌,现保存于甘肃农业大学草业学院微生物多样性实验室。
1.1.2 供试病原真菌 马铃薯炭疽病菌、马铃薯枯萎病菌和马铃薯坏疽病菌,由甘肃农业大学草业学院植物病理实验室提供。
1.1.3 供试培养基 NA培养基、LB培养液、PDA培养基和金氏培养基按文献[22]配制;PKO培养基、蒙金娜培养基[23]和阿须贝无氮培养基[24]分别按文献的方法配制。
1.2 拮抗能力的测定
1.2.1 拮抗内生细菌的筛选 采用平皿对峙法测定抑菌效果。将病原真菌(马铃薯枯萎病菌、马铃薯炭疽病菌和马铃薯坏疽病菌)打成直径为6 mm的菌饼,接在PDA培养基中央,将内生细菌点接在距菌饼2.5 cm处,每皿接4点,以只接病原真菌为对照,3个重复,置于25℃恒温下培养8 d,测量抑菌带并计算抑菌率,对拮抗能力强的菌株进行以下试验。
1.2.2 对病原菌菌丝生长的影响 采用平板对峙法于接种后8 d观察病原菌菌丝形态并显微照相。
1.3 菌株的鉴定
1.3.1 培养性状和形态特征 将拮抗内生菌于NA平板划单菌落,28℃下培养3 d后观察并描述单菌落培养性状;在NA平板上培养18~24 h后进行革兰氏染色、测量菌体大小并显微照相。
1.3.2 16S r DNA序列鉴定 按上海生工提供的试剂盒(Ezup柱式基因组DNA抽提试剂盒,批号:82561202)提取DNA并检测,对具有特异性DNA条带的提取物进行PCR扩增。扩增使用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。扩增条件为:94℃预变性5 min,94℃变性1 min,48℃退火30 s,72℃延伸1 min,30个循环;最后在72℃下延伸8 min,终止反应。反应体系:10×buffer(不含 MgCl2)5μL,MgCl2(25 mmol/L)3μL,d NTP(2.5 mmol/L)1μL,引物27F(10μmol/L)1 μL,引物1492R(10μmol/L)1μL,Taq酶 (2 U/μL)0.5μL,Target DNA(10 ng/μL)1.2μL,dd H2O定容至50μL。经检测具特异性条带的扩增产物送上海生工测序,所测序列与GenBank数据库中序列进行同源性对比,采用Clustal 1.8软件和Mega 4.0软件构建系统发育树,确定菌株的系统发育学地位。
1.4 固氮、溶磷、产IAA能力的测定
1.4.1 产IAA能力的定性测定 采用Salkowski比色法[25]。将100μL菌悬液分别接到含100 mg/L色氨酸和不含色氨酸的金氏培养液中,设置3个重复,以加等量无菌水的培养液为空白对照,于28℃、120 r/min恒温振荡培养12 d,后分别取50μL加入等量比色液(PC比色液或S2比色液),室温静置15 min后,观察显色反应,3个重复均变红色表示能分泌IAA,否则不分泌IAA,颜色越深表示分泌数量越多。
1.4.2 产IAA能力的定量测定 采用纯3-IAA 制作标准曲线。配制2组浓度依次为2.5,5.0,7.5,10.0,12.5,15.0,17.5 mg/L和25,50,75,100,125,150,175 mg/L的标准溶液,分别取4 m L,第1组中加等量PC比色液,另1组中加等量S2比色液,设置3个重复,黑暗静置30 min后测定其OD530值并制作标准曲线。将培养12 d的菌悬液和空白对照10000 r/min离心10 min,取上清液4 m L分别加入等量比色液,黑暗静置30 min后测定OD530值,以只加比色液为空白对照。根据标准曲线计算菌株分泌IAA的量,并按照PC比色液和S2比色液的测定范围最终确定结果[26]。
1.4.3 溶磷能力的定性测定 将263XY1分别点接于PKO和蒙金娜平板培养基上,每皿4个接菌点,重复3次,28℃恒温培养7 d后,观察并测量菌株在培养基平板上形成的溶磷圈大小。根据溶磷圈直径/菌落直径(D/d值)确定内生菌的溶磷能力。比值越大,表示溶磷能力越强。
1.4.4 溶磷能力的定量测定 将1 m L 263XY1菌悬液接于PKO和蒙金娜培养液中,装液量为50/150 m L,以接入等量无菌水的培养液为对照,重复3次。28℃、160 r/min恒温振荡培养10 d后10000 r/min离心15 min,上清液采用钼锑抗比色法测定有效磷增量[27]。计算公式如下:
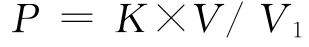
式中,P为有效磷增量;K为标准曲线查得显色液的磷含量(mg/L);V为显色时溶液定容的体积(m L);V1为显色时吸取上清液的体积(m L)。1.4.5 固氮能力的定性测定 将263XY1点接于阿须贝无氮平板培养基上,每皿4个接菌点,重复3次,28℃恒温培养;同时将200μL菌悬液接于阿须贝液体培养基中,重复3次,以接种等量无菌水为对照,28℃恒温振荡培养,于第3,5,7天观察其生长状况,若菌株能够在平板培养基上明显生长且能使液体培养基变浑浊则具有固氮能力。
1.5 统计分析
运用Excel 2007和SPSS 17.0统计分析软件进行试验数据处理与分析。
2 结果与分析
2.1 拮抗能力测定
2.1.1 拮抗菌株筛选 从44株内生细菌中筛选得到7株具拮抗作用的内生细菌,编号分别为262XY1、262XY2′、262XY3、263XY1、263XG5、263XG6和 263XG8,其 中 263XG5、263XG6 和263XG8分离自线叶嵩草根部,262XY1、262XY2′、262XY3和263XY1分离自茎部。263XY1与马铃薯枯萎病菌、马铃薯炭疽病菌和马铃薯坏疽病菌对峙培养,具明显的抑菌带(图1),抑菌率分别为67.17%,86.24%和70.89%(表1),其抑菌能力显著高于其他6株拮抗细菌(P<0.05),因此对该菌株进行了以下试验。
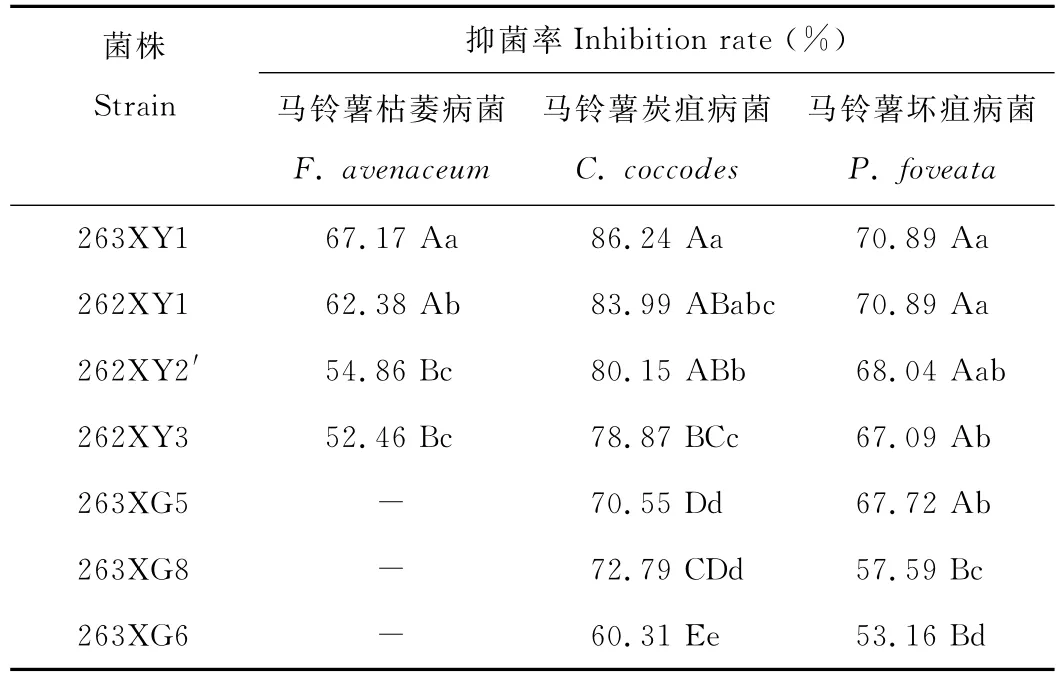
表1 内生细菌的抑菌能力测定Table 1 Inhibition rate of endophytic bacterium on pathogenic fungi
2.1.2 对病原菌菌丝生长的影响 病原菌菌落生长受抑制后,菌落边缘和抑菌带接触部位的菌丝生长缓慢。镜检发现,受抑制菌丝的生长端分支增多,菌丝顶端、中部膨大呈泡状,有明显的畸形,部分前端膨胀破裂,内含物外溢(图2),说明263XY1可使病原菌菌丝发生畸形变化从而影响菌丝正常生长。
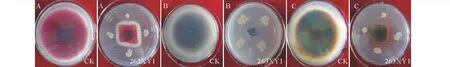
图1 263XY1对3种病原真菌的抑制效果Fig.1 Inhibitory effects of 263XY1 on 3 species of fungus pathogensA:枯萎病菌对照和处理Normal and inhibit of F.avenaceum;B:炭疽病菌对照和处理Normal and inhibit of C.coccodes;C:坏疽病菌对照和处理Normal and inhibit of P.foveata;下同The same below.

图2 263XY1对病原菌菌丝的影响Fig.2 The influence of 263XY1 against hyphoae of pathogenic fungi
2.2 263XY1菌株的鉴定
2.2.1 形态观察 263XY1革兰氏染色阳性(图3A),菌体大小为0.36~0.85μm×0.69~1.87μm。在NA平板培养基上菌落大小为3~4 mm,不规则形,边缘不整齐,呈波状,表面褶皱,较干燥,不透明,米白色(图3B)。
2.2.2 16S r DNA序列鉴定 提取的263XY1基因组经16S r DNA引物扩增,产物经琼脂糖凝胶电泳检测,在近1500 bp处有一清晰的PCR特异性条带 (图4),经上海生工测序得16S r DNA基因序列长度为1451 bp,使用BLAST程序对所得序列在Genebank中进行同源性比较,263XY1与已报道的Bacillus vallismortis(JQ765433.1),Bacillussubtilis(FJ763648.1),Bacillussubtilis(JF926531.1)和Bacillus amyloliquefaciens(JF899260.1)等多个基因序列的同源性在99%以上,应用Clustal 1.8和Mega 4.0软件进行多重序列比较后邻接法构建系统发育树,表明263XY1与B.vallismortis相似性最高(图5),因此将其鉴定为Bacillus vallismortis(KF818642)。
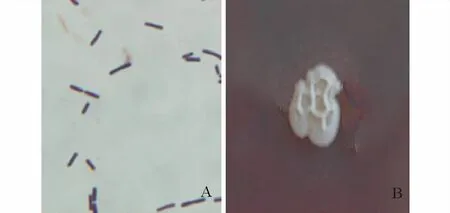
图3 263XY1革兰氏染色(A)与单菌落(B)Fig.3 Gram staining(A)and a single colony(B)of 263XY1
图4 263XY1的16S r DNA电泳图Fig.4 16S r DNA PCR electrophoresis map of 263XY1(1,2:263XY1;3:标记 Marker)
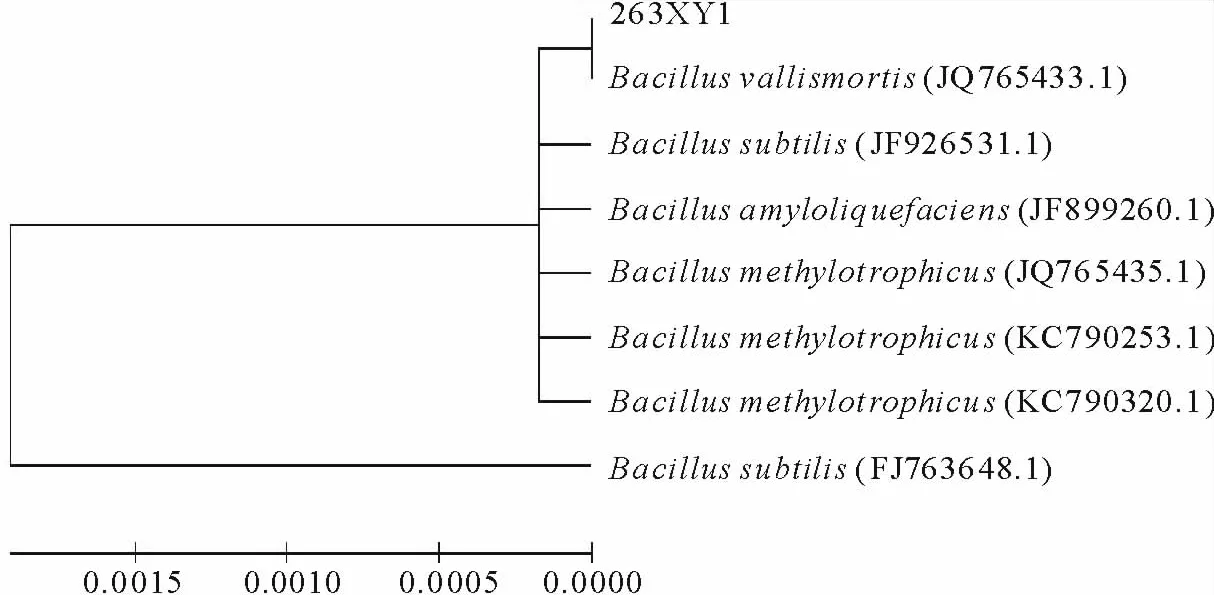
图5 263XY1的16S r DNA系统发育树Fig.5 16S r DNA phylogenetic tree of 263XY1

图6 263XY1比色反应Fig.6 263XY1 colorimetric reaction
2.3 生物学功能测定
2.3.1 产IAA能力的定性测定 与CK相比,加入不含色氨酸(Trp)的King菌悬液和含色氨酸的King菌悬液均有显色反应,呈淡粉色(图6),说明263XY1可以分泌IAA。
2.3.2 产IAA能力的定量测定 263XY1经连续培养12 d后,测定OD530值,结果表明,不含色氨酸时其分泌IAA的浓度为1.52 mg/L;含100 mg/L色氨酸的金氏培养液中其分泌IAA的浓度为3.31 mg/L,是前者的2倍,说明色氨酸的存在能增加263XY1合成IAA的量,即外源色氨酸可以作为263XY1合成IAA的前体物质。

图7 263XY1在蒙金娜(A)和PKO(B)平板培养基上形成的溶磷圈Fig.7 Halo of phosphate-solubilization microorganism 263XY1 Mongina(A)and PKO(B)solid medium
2.3.3 溶磷能力的定性测定 263XY1在蒙金娜培养基上溶磷圈不明显(图7A),D/d值为1.10;但在PKO培养基上溶磷圈明显(图7B),D/d值为2.10,说明对无机磷有明显溶磷能力,而对有机磷的溶解能力较差。
2.3.4 溶磷能力的定量测定 263XY1在PKO和蒙金娜液体培养基培养10 d后,有效磷增量分别为38.94和0.11 mg/L,说明263XY1对无机磷有较强的溶磷能力,但对有机磷溶磷能力差。
2.3.5 固氮能力的定性测定 263XY1点接于阿须贝平板培养基后,在第3天时形成菌落;接种于阿须贝液体培养基,7 d后培养液变浑浊,说明262XY1有固氮能力。
3 结论与讨论
近年来,草地退化问题严重,在草地的生产中,应及时采取措施,才可逆转草地的退化进程,实现草地的可持续利用。恢复退化的草地已成为亟待解决的问题,而养分供给能力是成功恢复退化草地主要依赖的因素之一[28-30]。开发具有拮抗作用等多功能的牧草内生细菌应用于草地,一方面可以补充草地自身养分,协调草地资源利用中生产功能与生态功能的冲突;另一方面也可以应用于农作物病虫害的生物防治中。本研究以东祁连山高寒草地线叶嵩草中分离的内生细菌263XY1为对象,经16S r DNA序列鉴定为芽孢杆菌属的细菌。目前,在国内外内生细菌多样性研究的报道中,认为芽孢杆菌作为优势菌种[31-32],具有开发成为生物农药和生物肥料的潜力,且效果显著[33-34],有进一步开发利用的价值。
内生细菌通过释放土壤中不溶性的磷元素,促进植物生长和次级代谢物积累已有报道[15,16]。263XY1在PKO含无机磷培养基中的有效磷增量为38.94 mg/L,说明263XY1有较好溶解无机磷的能力,即具有较好促生作用,但是其溶磷机制有待进一步研究。周佳宁等[35]从茅苍术(Rhizoma areactylodis)叶片中分离得到45株内生细菌研究其促生潜力,其中43株能够分泌IAA,其浓度在22~268 mg/L,说明内生细菌可以分泌IAA促进宿主生长和抗逆;张英等[36]研究4株牧草根际促生细菌互作效应中发现,其分泌IAA量为0.212~9.33 mg/L,低于单株263XY1分泌的IAA量,263XY1与其他菌株复配时产生IAA的能力可能更强,但还有待进一步研究。263XY1分离自高寒草地线叶嵩草,其生存的极端环境可能有利于内生细菌在逆境中适应力的提高,如拮抗或增加IAA的分泌量等,发挥更好的促生作用[37]。另外,高寒的生存环境与马铃薯在贮藏期所需要的低温条件正好吻合,更加适合于开发为防治马铃薯贮藏期病害的生物农药。
目前报道的具生物学功能的内生细菌较多,但同时具备多种功能于一体的内生细菌并不多。263XY1为G+,经16S r DNA序列分析将其鉴定为死谷芽孢杆菌,对马铃薯枯萎病菌、马铃薯炭疽病菌和马铃薯坏疽病菌均具有较强拮抗作用,抑菌率分别达到67.17%,86.17%和70.89%,且还具有较强溶磷、产生IAA和固氮能力,是一株多功能拮抗内生细菌。因此,该菌株有进一步开发为防治马铃薯贮藏期病害的微生物产品的巨大潜力。

