干旱胁迫对鸭茅根、叶保护酶活性、渗透物质含量及膜质过氧化作用的影响
季杨,张新全,彭燕,梁小玉,黄琳凯,马啸,马迎梅
(1.四川农业大学动物科技学院草业科学系,四川 雅安625014;2.四川省畜牧科学研究院,四川 成都610066)
鸭茅(Dactylis glomerata)是世界著名优良的多年生冷季型禾本科牧草,具有产量高、品质优良、适应性强、再生速度快、耐阴性好、须根发达等习性被大量应用于草山草坡改良及喀斯特地区石漠化治理等,是一种优良的多用途草类资源,具有较高的应用价值和开发前景。然而,干旱作为一个世界性问题,是影响植物在形态、生理及基因表达水平上发生变化,限制植物生长发育和产量提高的主要逆境因子之一[1-2]。因此,在淡水资源严重匮乏的环境压力下,开展鸭茅抗旱性研究具有重要的应用价值。
植物的抗旱性主要表现在渗透调节物质的积累、膜脂成分的变化、自由基的清除作用以及蛋白的诱导形成激素调节等综合因素作用的结果[3]。干旱胁迫引起植物体内活性氧的产生和清除系统之间失衡,生物自由基的累积引起膜伤害和膜脂过氧化等,而植物体内一系列的抗氧化酶类和渗透调节物质(包括可溶性糖、可溶性蛋白、游离脯氨酸等)组成的抗氧化防御系统以清除这些活性氧自由基[4-5],同时起到保护细胞内生物大分子结构的作用[6]。目前,关于研究干旱胁迫对鸭茅生理特性影响的研究较少,且主要集中在鸭茅叶片中渗透调节和抗氧化酶活性变化对水分胁迫的响应[7-9]。干旱胁迫同时对鸭茅根系、叶片的渗透调节作用和抗氧化系统的保护作用进行的研究尚未见报道。本研究以2种不同鸭茅基因型为试验材料,即耐旱型鸭茅材料“宝兴”和敏感型鸭茅材料“01998”[8],比较鸭茅根、叶抗氧化酶活性和渗透调节物质对干旱胁迫的响应,进一步完善鸭茅的抗旱机理,为鸭茅的抗旱品种选育和节水高产栽培提供理论依据。
1 材料与方法
1.1 试验材料
供试鸭茅材料为2个不同抗旱性的基因型材料(耐旱型 “宝兴”和敏感型“01998”)。从四川农业大学草业科学系农场的资源圃采集已种植2年的供试材料,将采集的2个单株群体再各分成36株植株,为促使其再次分蘖和长出新根,保留约4 cm株高和2 cm的根系,培育3个月后再次分株定植于花盆,每盆定植3株(口径16 cm,地径12 cm,高13 cm)。土壤的沙和粘土为1∶1(v/v),装土量为4 kg,土壤持水量为31%,土壤类型为沙壤土,其基本理化性质为:土壤田间持水量31%,有机质11.4 g/kg,速效氮70.21 mg/kg,速效磷21.68 mg/kg,速效钾61.58 mg/kg。移栽后5 d浇灌5.0 mmol/L Hoagland营养液,室外培养2个月。待根系建成后移入光照培养箱培养,温度设置为22℃/15℃(昼/夜),相对含水量70%,光照300μmol/(m2·s),光周期14 h/10 h(昼/夜)。
1.2 试验设计
试验于2011年3-10月在四川农业大学温江校区草学系温棚实施。共设2个处理,分别是干旱处理和浇水对照处理,每个处理设3个重复,其中根系的干旱处理和浇水对照在每个时间点上均有3个重复。实验处理前保持7 cm冠层高度,保持土壤相对含水量在50%左右,开始干旱处理后停止浇水。对供试材料进行干旱处理24 d,分别于干旱处理的第0,9,18,21,24天上午10:00时采集根系及叶片样品并测定各项生理指标。
1.3 测定指标与方法
在干旱处理的第0,9,18,21,24天分别取顶部第1片展开叶,并用纱布擦干。根部利用水冲法洗净,取用根尖部位样品分别测定各项生理指标。
根系活力(root vitality)采用四氮唑法(TTC还原法)测定[10]。相对含水量(relative water content)采用烘干法测定[11],相对含水量(RWC)(%)=[(鲜重-干重)/(饱和鲜重-干重)]×100%。丙二醛(malondialdehyde,MDA)采用硫代巴比妥酸法测定[12]。电导率(electrolyte leakage,EL)采用电导仪测定[13]。超氧化物歧化酶(superoxide dismutase,SOD)活性采用核黄素-NBT法测定[14]。过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性采用紫外吸收法测定[15]。过氧化物酶(guaiacol peroxidase,POD)活性采用愈创木酚法[16]测定。游离脯氨酸(free proline)含量采用茚三酮比色法测定[17]。可溶性糖(soluble sugar)含量采用蒽酮乙酸乙酯比色法测定[17]。可溶性蛋白(soluble protein)含量采用考马斯亮蓝G-250法测定[18]。
1.4 数据分析
采用Excel 2003进行数据统计及绘图;SAS 8.1软件进行数据分析,用最小差异检验方法进行显著性分析。
2 结果与分析
2.1 不同胁迫时间下土壤含水量(SWC)的变化
干旱胁迫过程中土壤含水量的变化如图1,在试验过程中,随着干旱胁迫时间的延长,土壤含水量持续下降。在干旱处理9 d后,“宝兴”比“01998”表现出更高的土壤含水量优势(图1),从图中的LSD值可以看出,在整个胁迫处理期间,种植不同基因型鸭茅土壤含水量在P<0.05水平下差异不显著。
2.2 干旱胁迫对鸭茅叶片含水量及根系活力的影响
植物叶片相对含水量(RWC)是反映植物在逆境胁迫下的整体水分亏缺状况。由图2A可以看出,随着干旱时间的延长,2种基因型的鸭茅相对含水量都呈逐步递减的趋势。其中,耐旱型品种“宝兴”的相对含水量在整个试验期间均高于敏感型材料“01998”,并且在干旱第21天时显著高于“01998”。

图1 土壤质量含水量(SWC)在干旱胁迫处理下的变化Fig.1 Changes of soil water content under drought stress图中竖条表示最小显著差异,不同基因型间不同字母者表示差异显著(P<0.05)。下同。Vertical bars represent least significant difference,different genotypes of orchardgrass from leaf sizes followed by different small letters are significantly different at P<0.05.The same below.

图2 干旱胁迫下鸭茅叶片相对含水量和根系活力的变化Fig.2 Changes of leaf relative water content and root vitality of orchardgrass under drought stress
由图2B可知,不同耐旱型鸭茅根系活力均呈先增强后下降的趋势。干旱胁迫初期明显提高了2种不同耐旱型鸭茅的根系活力,但随着干旱时间的延长,干旱18 d后,2个基因型材料均出现明显下降趋势,其中 “宝兴”鸭茅的根系活力在整个试验期间均高于“01998”,但差异不显著。
2.3 干旱胁迫对根系及叶片细胞膜稳定性的影响
丙二醛(MDA)是植物细胞膜脂过氧化伤害的主要产物之一,MDA含量通常用于评价膜脂过氧化的程度。从图3A可以看出,随着干旱胁迫时间的延长,根系和叶片MDA含量均呈逐渐增加的趋势,其中根系MDA含量相对增加量小于叶片。在整个试验期间,耐旱型“宝兴”根系维持较低的MDA含量增加量,同时“宝兴”和“01998”的根系在不同胁迫时间处理下差异均不显著;而“宝兴”叶片MDA含量在干旱胁迫处理第18天开始就一直显著低于“01998”。
电导率是评价植物细胞膜稳定性的一个重要指标。由图3B可知,干旱处理条件下,不同基因型鸭茅电导率与丙二醛变化趋势类似,但根系电导率值在干旱初期明显高于叶片。在整个试验期间,“宝兴”的根系和叶片的电导率均低于“01998”,其中在干旱第18~21天期间,根系中“宝兴”电导率显著低于“01998”。
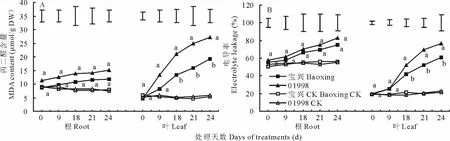
图3 干旱胁迫下根系及叶片对细胞膜稳定性的影响Fig.3 Effect of cell membrane stability in roots and leaves of orchardgrass under drought stress
2.4 干旱胁迫对根系及叶片中渗透调节物质的影响
游离脯氨酸和可溶性糖是植物体内较为重要的渗透调节物质。干旱胁迫初期,2个品种的根系和叶片中脯氨酸含量基本相同,都保持在相对较低的水平,而叶片中可溶性糖含量在胁迫初期显著高于根系(图4A,4B)。随着干旱胁迫时间的延长,根系及叶片中游离脯氨酸和可溶性糖含量均呈逐渐增加的趋势。在整个干旱处理期间,耐旱型品种“宝兴”的根系和叶片中游离脯氨酸和可溶性糖含量均高于“01998”,其中叶片脯氨酸含量在干旱18 d后显著高于敏感型材料“01998”。
可溶性蛋白作为另一种重要的有机渗透调节物质在缺水情况下起保水作用。随着干旱胁迫进程的推进,根系及叶片可溶性蛋白含量逐渐升高,叶片可溶性蛋白含量在胁迫后第9天达最大值,而根系则在第18天达最大值,之后皆开始降低,呈单峰曲线变化(图4C)。叶片与根系比较,根系可溶性蛋白含量相对变化量小于叶片。
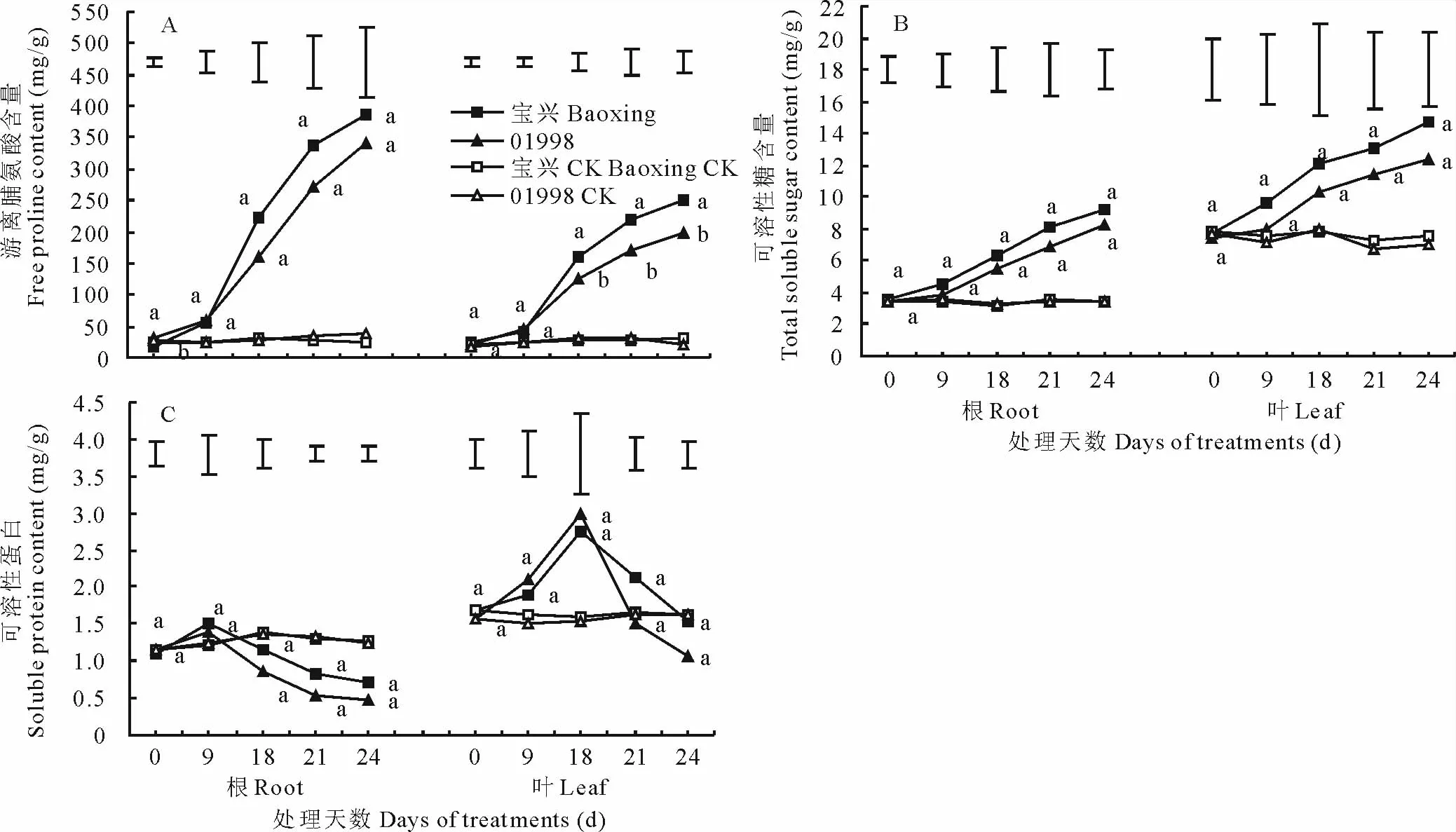
图4 不同干旱胁迫对鸭茅根系和叶片脯氨酸、可溶性糖、可溶性蛋白含量变化的影响Fig.4 Effect of free proline content,total soluble sugar content and soluble protein content in roots and leaves of orchardgrass under drought stress
2.5 干旱胁迫对根系及叶片保护酶活性变化的影响
2个鸭茅材料的根系及叶片SOD活性随着干旱时间的延长逐渐升高,并在干旱第18天达到最大值,干旱18 d后急剧下降。与“宝兴”SOD活性不同的是,干旱第24天的“01998”SOD活性低于0 d时的SOD活性(图5A)。与“01998”比较,“宝兴”的根系和叶片在整个干旱处理阶段均维持着较高的SOD活性水平。其中,根系SOD活性在干旱第9和18天显著高于“01998”,而叶片SOD活性在干旱第18和21天显著高于“01998”。
2种鸭茅根系和叶片CAT活性在干旱胁迫条件下变化趋势一致,即随着干旱胁迫时间的延长,CAT活性先上升后下降,只是根系CAT活性保持着较低的增长趋势,而叶片中CAT活性保持较高的增长趋势。2种鸭茅的根系及叶片CAT活性均在干旱第18天达到最大值,并在之后呈缓慢下降趋势(图5B)。“宝兴”根系和叶片的CAT活性在整个干旱处理期间均高于“01998”。其中,“宝兴”根系中CAT活性在干旱第9天到第18天期间显著高于“01998”;而叶片中CAT活性在干旱第9天到第21天期间显著高于“01998”。
2种鸭茅在干旱0天时,与叶片中POD活性比较,根系中POD活性维持着较高的水平。在干旱胁迫初期,2种鸭茅的根系及叶片POD活性保持较低的增长趋势,随着干旱时间的延长和程度的加重,二者的根系和叶片POD活性急剧上升,在干旱处理第18天时分别达到最大值;干旱处理18 d后,2种耐旱型鸭茅根系和叶片POD活性均急剧下降,但“宝兴”根系和叶片POD活性在干旱第18,21,24天均显著高于“01998”(图5C)。
2种鸭茅根系和叶片APX活性在干旱胁迫条件下变化趋势一致,即随着干旱胁迫时间的延长,APX活性先上升后下降,2种鸭茅的根系及叶片均在干旱第18天达到最大值,并在之后呈缓慢下降趋势(图5D)。“宝兴”根系和叶片的APX活性在整个干旱处理期间均高于“01998”,其中,在干旱第21天“宝兴”根系中APX活性显著高于“01998”。

图5 不同干旱处理对鸭茅保护酶系SOD、CAT、POD、APX活性变化的影响Fig.5 Dynamics of variation of SOD,CAT,POD and APX activity of orcardgrass under different drought treatments
3 讨论
干旱是限制植物生长和发育最主要的逆境因子之一,干旱胁迫往往会造成植物体内大量活性氧的积累,这些活性氧导致膜脂过氧化水平增高,生成具有强氧化性的脂质过氧化物,其中丙二醛(MDA)是膜质过氧化作用的产物之一,具有很强的细胞毒性,被广泛地用作氧化损伤的分析[19],许多研究都将MDA含量作为衡量植物耐旱性强弱的一个重要指标[20-22]。MDA含量高低和细胞质膜透性变化是反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[19]。本试验结果表明,干旱胁迫下2个基因型的根系和叶片MDA含量呈不断增加趋势,表明膜系统均受到一定损伤,随着干旱胁迫时间的延长而加剧;其中2个基因型的根系MDA含量在整个试验期间差异不显著,而2个基因型的叶片中MDA含量增幅较为明显,其中“宝兴”叶片MDA含量增幅较小,脂质过氧化程度相对较低,膜透性随干旱程度的增幅也较小,表现出较强的耐旱性。Sharma和Dubey[23]及Li等[24]在小麦(Triticum aestivum)和白三叶(Trifolium repens)的研究中得出同样结果,即干旱胁迫下根系中MDA含量增长幅度较小,膜质过氧化程度低于叶片。表明叶片脂膜过氧化产物MDA累积幅度大,在干旱过程中叶片所受伤害重于根系。
渗透调节物质(脯氨酸、可溶性糖和可溶性蛋白等)的积累是植物适应干旱胁迫的基本特征之一。这些物质的积累可以调节细胞内的渗透势,维持水分平衡,保护细胞内重要代谢活动所需的酶类活性,且一般认为抗旱性强的品种渗透调节能力较强[8-9,25]。本研究结果表明,随着干旱胁迫时间的延长,2种不同基因型鸭茅根系及叶片的脯氨酸含量和可溶性糖含量逐渐增加。相较于敏感型材料“01998”,耐旱型品种“宝兴”根系及叶片的脯氨酸含量和可溶性糖含量在整个干旱期间增幅更明显。表明“宝兴”根系及叶片内脯氨酸和可溶性糖响应干旱代谢系统更为敏感和快速,抗旱性更强。可溶性蛋白含量是植物体代谢过程中蛋白质损伤的重要指标,其变化可以反映细胞内蛋白质合成、变性及降解等多方面的信息[26]。康俊梅等[27]对苜蓿(Medicago sativa)叶片的研究表明,干旱强度直接影响可溶性蛋白含量变化,即随着胁迫强度的增加可溶性蛋白呈先增强后减弱的趋势。陈明涛等[28]对刺槐(Robinia pseudoacacia)、侧柏(Platycladus orientalis)根尖可溶性蛋白含量变化规律研究表明,轻度干旱胁迫导致可溶性蛋白含量上升,而中度或重度干旱胁迫导致可溶性蛋白含量下降,且胁迫程度越强,下降幅度越大。本试验中鸭茅根系及叶片的可溶性蛋白变化规律与上述研究一致。韩蕊莲等[29]研究结果指出,随着干旱时间的延长,胁迫程度的加重,植物体内的分解代谢大于合成代谢,导致可溶性蛋白大量降解。这可能就是解释中度和重度胁迫条件下可溶性蛋白含量减少现象。鸭茅根系渗透调节物质与叶片相比,叶片中可溶性糖和可溶性蛋白的含量高于根系,而根系中的游离氨基酸的相对增加量则大于叶片,这可能由于叶片是糖的主要产生部位,而根系则可以合成氨基酸有关。
干旱胁迫是影响植物生长和代谢的主要逆境因子之一,干旱诱导植物细胞内活性氧的产生,与生物大分子发生氧化反应,生成具有强氧化性的膜质过氧化物和各种小分子的降解物,导致膜质过氧化、破坏膜的完整性、降低保护酶的活性[30]。为了防御、减少氧化损害,植物需要合理调节体内抗氧化清除系统,SOD、CAT、POD、APX就属于这一系统中的关键酶[31]。SOD作为重要的自由基清除酶,能催化·O2发生歧化作用而转化为H2O2和O2,从而减轻超氧阴离子对植物体的毒害作用[32]。而产物H2O2可转化导致膜质过氧化的活性氧O2-。CAT、POD、APX主要清除不同细胞定位的H2O2,也就是SOD催化·O2的产物[33]。因此需要SOD、CAT、POD、APX的协同作用,共同防御活性氧大量积累造成的氧胁迫毒害。本研究结果表明,随着干旱胁迫时间的延长,2种鸭茅根系和叶片中SOD、CAT、POD、APX活性呈现出一致的反应,即先增强后下降的趋势。在干旱胁迫第0,9,18天,2种鸭茅的根系及叶片通过升高SOD、CAT、POD、APX活性来防止活性氧大量积累造成的氧胁迫毒害,其中“宝兴”的SOD、CAT、POD、APX活性明显高于“01998”,表现出较强的抗旱能力。干旱18 d后,2种鸭茅根系及叶片中4种酶活性都急剧下降,表明此时鸭茅体内活性氧的形成和清除系统之间的平衡被打破。但是,在干旱胁迫第24天,“宝兴”鸭茅根系及叶片的POD活性显著高于“01998”,表明重度干旱胁迫并没有减弱POD清除H2O2和单态氧的能力。说明“宝兴”鸭茅在干旱条件下抗氧化清除系统响应更积极、更持久,具有比“01998”更高的清除活性氧的能力。

