弓形虫慢性感染小鼠的系统性细胞免疫应答规律*
尹 青 赵新新 闫鑫磊 刘贤勇 索 勋
(中国农业大学动物医学院,北京 100193)
刚地弓形虫Toxoplasmagondii是一种人畜共患的专性细胞内寄生原虫,可引起世界范围内广泛流行的寄生虫病。据估计,全球约三分之一的人口受到该寄生虫的感染(Montoyaetal., 2004;Weissetal.,2009)。弓形虫是一种机会性致病寄生虫,主要危害孕妇及免疫系统低下的人群,免疫功能正常的人感染并不引起明显的临床症状(Tenteretal.,2000;Weissetal., 2009)。
系统性免疫应答又称全身性免疫应答,是与局部性免疫应答相对的一个概念。局部性黏膜免疫部位主要包括肠道、呼吸道、泌尿生殖道等反应部位(Chardesetal., 1993;Tuyishimeetal., 2014)。经口食入含有弓形虫包囊及卵囊的食物及饮水是动物及人感染弓形虫的两个最主要途径(Dubey, 1997)。缓殖子或子孢子到达肠道后,入侵宿主肠壁细胞并经血液或淋巴循环分布到全身各器官组织中寄生。在这个过程中,弓形虫激发宿主产生肠道黏膜免疫及系统性免疫应答(Denkersetal., 1998)。现在大部分研究都将抗弓形虫感染集中于肠道黏膜免疫反应,认为局部的免疫反应可以阻挡弓形虫入侵从而破坏其对宿主的感染(Chardesetal., 1993;Cruzetal., 2014)。但是越来越多的研究表明,在弓形虫感染中,系统性免疫应答也起着十分重要的作用(Gazzinellietal., 1991;Gigleyetal., 2009; Wangetal., 2014)。
本研究用BALB/c小鼠口服感染Pru株弓形虫包囊,然后对组织包囊进行观察以确认慢性感染,从而建立弓形虫慢性感染小鼠模型。通过检测该小鼠的系统性T细胞免疫应答规律,初步探讨机体慢性感染弓形虫后的系统性免疫应答抵抗机制。
1 材料与方法
1.1 虫株及实验动物
本研究所用的弓形虫虫株为Prugniaud(Pru)虫株,由中国农业科学院兰州兽医研究所朱兴全教授惠赠。在昆明鼠上完成该虫株的传代保种,在人包皮成纤维细胞 (HFF)细胞中完成该虫株的速殖子扩增。本研究使用的清洁级雌性BALB/c小鼠(体重18~24 g,6~8周龄)购自北京华阜康生物科技股份有限公司。
1.2 小鼠脑内包囊的检测
每只小鼠口服感染Pru株4个包囊,45 d后,无菌条件下取小鼠大脑,用预冷的PBS冲洗表面残留的血液,然后在无菌的匀浆器中对脑组织进行匀浆,显微镜下观察。
1.3 弓形虫包囊的纯化与染色
将小鼠脑匀浆液加适量PBS稀释。取一支无菌的15 mL离心管,先加入6 mL小鼠淋巴细胞分离液(天津灏洋生物制品科技有限责任公司),再将等体积的脑匀浆液轻轻地加到淋巴细胞分离液液面上。3 500 r/min,室温离心30 min。小心弃掉所有液体,只留下紧贴在管底的沉淀。用适量PBS重悬沉淀后,进行镜检。
离心并收集沉淀,4 ℃条件下,用预冷的500 μL多聚甲醛固定30 min,离心弃上清,将沉淀加入适量结晶紫染色液染色20 min,洗涤2次后镜检观察。
1.4 弓形虫超声抗原的制备及含量测定
收集在HFF细胞上的弓形虫速殖子,用PBS洗涤两遍,将收集到的速殖子用孔径5 μm的滤器进行过滤。室温下,3500 r/min将滤液离心30 min,收集虫体,用超声波细胞破碎仪(功率30%)将弓形虫裂解10 min。取上清,用蛋白定量检测试剂盒(北京康为世纪生物科技有限公司)对蛋白含量进行检测。
1.5 小鼠脾细胞胞内细胞因子染色
无菌取小鼠脾细胞,研磨成单个细胞,加入红细胞裂解液裂解红细胞。用预冷PBS将细胞洗涤两遍。每孔5×106细胞,加入12孔板中。将弓形虫全虫抗原加入细胞中(终浓度为24 μg/mL),置于37 ℃细胞培养箱中进行培养。16 h后,在阳性孔每孔加入5 ng/mL PMA和500 ng/mL离子霉素(Sigma);所有孔中加入0.75 μL 蛋白转运抑制剂(BD Biosciences)。6 h后进行胞内细胞因子染色。首先,在4 ℃条件下,用抗小鼠CD16/CD32抗体(Biolegend)封闭30 min。洗涤细胞,加入如下荧光标记的抗小鼠单抗FITC-CD3,PE-CD4,APC-CD8 (Biolegend),4 ℃避光反应30 min。洗涤细胞,加入250 μL 固定穿膜液(BD Biosciences),悬浮细胞,4 ℃避光反应20 min。然后,用Perm/Wash buffer(BD Biosciences)洗涤细胞,加入50 μL Perm/Wash buffer,悬浮细胞,向其中加入Percp/cy5.5-IFN-γ单抗(Biolegend),4 ℃避光反应30 min。洗涤细胞,流式细胞仪检测。
1.6 WST-8法检测T细胞增殖
将1.5中计数后获得的小鼠脾细胞以3×106/mL悬于完全RPMI-1640培养基中,培养于96孔细胞板中,每孔100 μL,每只小鼠9个孔:3孔为未刺激细胞,3孔为弓形虫抗原刺激细胞(终浓度为24 μg/mL),剩余的为ConA刺激孔(终浓度为5 μg/mL);同时设立培养基对照组。37 ℃,细胞培养箱中培养3~4 d,显微镜下观察并在每孔加入10 μL WST-8,轻轻振荡后置于细胞培养箱中培养2 h。然后用酶标仪测定450 nm下的OD值。最后进行计算,刺激指数(SI)=(各刺激孔的OD值-培养基OD值)/ (未刺激孔的OD值-培养基OD值)。
1.7 统计分析
实验数据采用SPSS 17.0的一般线性模型(GLM)过程的one-way ANOVA程序分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 弓形虫慢性感染BALB/c小鼠的鉴定
如图1所示,在未感染弓形虫的组内,3只小鼠(C1,C2,C3)脑内未发现包囊;而在感染弓形虫的小鼠(T1,T2,T3)脑内都能检出弓形虫包囊。
包囊经纯化后,镜下可以观察到包囊受盖玻片挤压破裂而释放出的弓形虫缓殖子,见图2-A,可见游离出的单个的缓殖子。将纯化后的包囊进行染色,整个包囊及缓殖子(图2-B)都被染成蓝紫色。
2.2 弓形虫慢性感染小鼠脾脏T细胞在抗原刺激下可以产生明显增殖
如图3-B、3-C所示,弓形虫慢性感染小鼠脾脏细胞受抗原及ConA刺激72 h后,淋巴细胞发生增殖,出现单克隆细胞群体;而未加抗原刺激组未发生细胞增殖(图3-A)。如图3-D所示,未感染小鼠脾脏抗原刺激指数为1.01~1.61;而慢性感染小鼠脾脏抗原刺激指数为5.14~9.40,两组之间有显著差异。

图1 弓形虫慢性感染BALB/c小鼠脑内包囊的观察Fig. 1 T. gondii cysts in the brain homogenate of chronically infected BALB/c miceC1、C2、C3:3只阴性对照小鼠的脑匀浆;T1、T2、T3:3只弓形虫慢性感染小鼠的脑匀浆。C1, C2 and C3 represent brain homogenate of negative control mice; while T1, T2 and T3 represent brain homogenate of chronically infected mice.
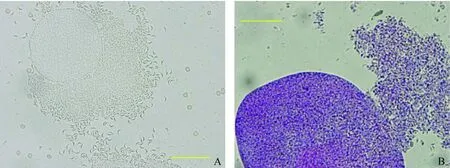
图2 慢性感染小鼠脑包囊及缓殖子的观察Fig. 2 Purified T. gondii cysts and bradyzoites from the chronically infected mice A. 脑内包囊经淋巴细胞分离液纯化后,包囊受外力挤压而发生破裂,大量缓殖子释放出来。B. 为纯化的包囊经固定及结晶紫染色后,可见整个包囊及受挤压而释放出的缓殖子都被染成蓝紫色。标尺代表50 μm。A. A brain cyst mechanically ruptured to release a large number of bradyzoites through a hole in cyst wall. B. A brain cyst and released bradyzoites were all stained with crystal violet solution. Bar represents 50 μm.
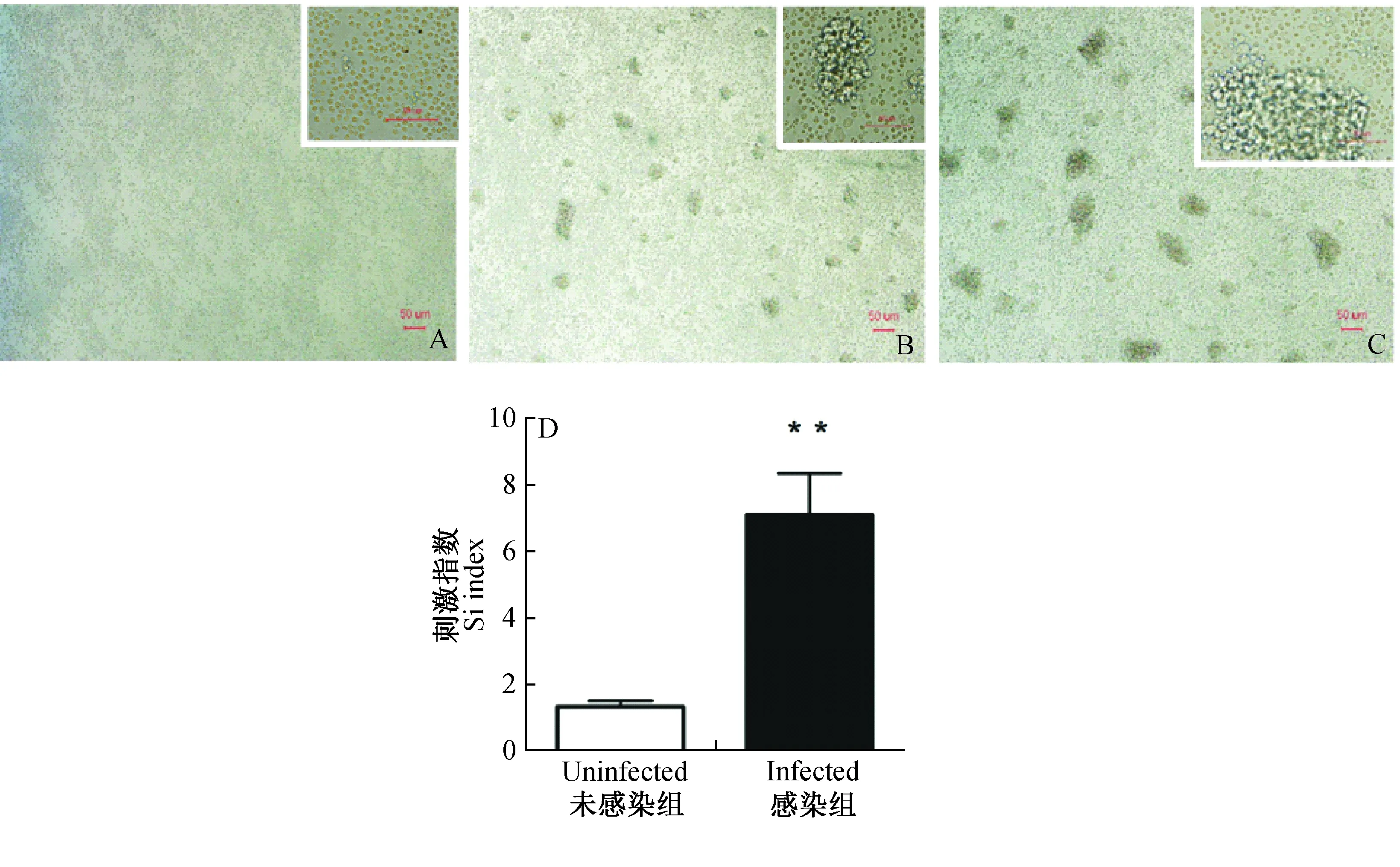
图3 弓形虫慢性感染小鼠的脾脏细胞受抗原刺激后的增殖反应Fig. 3 Lymphocytes proliferation post stimulation by T. gondii antigen弓形虫慢性感染小鼠的脾脏受抗原刺激72 h后,未加抗原组(A)、抗原刺激组(B)、以及阳性对照组(C)镜下观察的结果; D显示的是将未感染小鼠及感染小鼠脾脏细胞受抗原刺激96 h后增殖结果。** 表示P<0.01。Lymphocytes proliferation of the chronically infected mice stimulated for 72 h, Negative group (A), Antigen stimulated group (B) and Positive group (C); D represents the results of the lymphocytes proliferation from the control group and the infected group after stimulation for 96 h. ** P<0.01.
2.3 慢性感染小鼠T细胞体外抗原刺激后可以产生特异性IFN-γ
如图4-A、图4-C所示,受抗原刺激后,未感染小鼠脾脏IFN-γ+CD3+、IFN-γ+CD4+、IFN-γ+CD8+占CD3+、CD4+、CD8+的比例分别为0.63%、0.33%、0.23%;如图4-B、图4-D所示,感染小鼠脾脏IFN-γ+CD3+、IFN-γ+CD4+、IFN-γ+CD8+占CD3+、CD4+、CD8+的比例分别为2.03%、1.33%、0.93%。
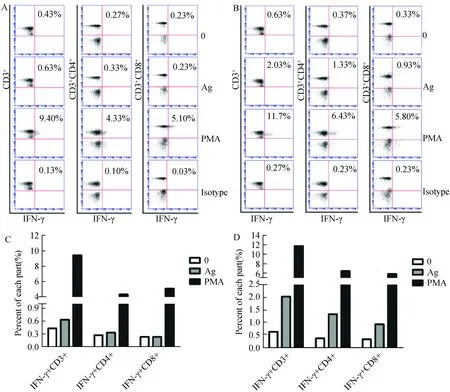
图4 特异性T细胞受抗原刺激产生IFN-γ的检测Fig. 4 IFN-γ released from the T. gondii-specific T cells after stimulation in vitroA、C显示的是阴性对照组小鼠脾脏细胞受弓形虫抗原刺激后,利用胞内细胞因子染色的方法对特异性T细胞分泌IFN-γ情况进行检测,A显示的是流式散点图,C显示的统计结果;B、D显示的是弓形虫慢性感染小鼠的脾脏细胞受弓形虫抗原刺激后,特异性T细胞分泌IFN-γ情况,B显示的是流式散点图,D显示的统计结果。0为未加抗原刺激组,Ag为加抗原刺激组,PMA为阳性对照组。图中所有数值为检测3只小鼠后所得的平均值。After stimulation with T. gondii antigen in vitro, IFN-γ was detected in CD3+, CD4+, CD8+T cells by flow cytometry. A and C represent results of control group; B and D represent results of infected group. A and B represent flow cytometry plots of IFN-γ+ CD3+T, IFN-γ+ CD4+T, IFN-γ+ CD8+T cells. C and D represent percent of IFN-γ+ cells in CD3+, CD4+, CD8+T cells respectively. 0 represent no stimulation group; Ag, T. gondii antigen stimulated group; PMA, positive group. Data were derived from 3 mice per group analyzed with their average value.
3 讨论
本研究将BALB/c小鼠口服感染弓形虫Pru株包囊,通过镜检,确认包囊的存在,表明成功建立了弓形虫慢性感染小鼠模型。通过对该小鼠的研究发现,弓形虫慢性感染小鼠脾细胞在体外弓形虫抗原条件下,产生特异性细胞增殖,且脾脏特异性T细胞可以产生IFN-γ。上述结果表明,弓形虫慢性感染的BALB/c小鼠可以产生显著的系统性T细胞免疫应答。
系统性免疫应答在抵抗弓形虫感染过程中起着越来越重要的作用。在弓形虫疫苗的研究过程中,发现弱毒虫株可以激发宿主产生很好的免疫保护反应,主要是因为弱毒疫苗可以在体内扩散,激发很好的系统性免疫应答(McLeodetal., 1984)。用对温度敏感的ts-4株弓形虫腹腔免疫小鼠,ELISPOT检测发现免疫后小鼠的脾细胞可以产生特异性IFN-γ,并可以有效保护小鼠抵抗RH强毒株的攻击(Gazzinellietal., 1991)。上述证据表明在弓形虫疫苗的研制过程中,系统性T细胞免疫应答对疫苗的保护效果具有至关重要的作用。
IFN-γ在抵抗弓形虫急性感染及慢性感染中都起到关键作用(Suzukietal., 1988;Gazzinellietal., 1991)。研究表明,在慢性感染中,IFN-γ的产生需要CD4+和CD8+T细胞协同作用才能完成,二者缺一不可(Gazzinellietal., 1992)。BALB/c小鼠腹腔免疫γ射线处理过的Pru速殖子,体外抗原刺激后发现,IFN-γ+CD4+及IFN-γ+CD8+所占CD4+及CD8+亚群比例与本研究基本一致(Blanchardetal., 2008),这表明,Pru株弓形虫是一株免疫原性很好的虫株,不同的免疫途径、虫体阶段都可以使小鼠产生相似的系统性免疫应答。感染28 d后的小鼠脾脏细胞才能出现明显增殖(Chardesetal., 1993)。本研究取感染45 d后的小鼠脾脏,发现细胞增殖与未感染组出现明显差异,这与前人的研究结论一致。但在感染两周左右时,细胞的增殖仍不明显(数据未显示),可能原因是,口服感染弓形虫包囊7~15 d后的小鼠脾脏中很少发现虫体,导致抗原在该时间段内不能有效激活系统性免疫应答,但随着虫体快速增殖,虫体散播至全身各组织器官,系统性免疫被有效激活,四周后(即28 d左右)记忆细胞大量形成后出现明显的细胞增殖(Chardesetal., 1993)。
本研究将Pru株弓形虫模拟弱毒疫苗株免疫(或感染)BALB/c小鼠。成功构建了弓形虫慢性感染小鼠模型。慢性感染小鼠可以产生针对弓形虫的特异性、系统性T细胞免疫应答,这将为弓形虫弱毒疫苗研制的效果评价提供参考依据。

