东祁连山高寒草地土壤产漆酶真菌的筛选、鉴定及产酶条件的初步研究
芦光新,王军邦, 陈秀蓉,杨成德,薛莉
(1.青海大学农牧学院草业科学系,青海 西宁 810016;2.中国科学院地理科学与资源研究所,北京 100094;3.甘肃农业大学草业学院 草业生态系统教育部重点实验室 中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
漆酶(Laccase EC 1.10.3.2),即对苯二酚,又名酚酶,多酚氧化酶等[1]。就结构而言,漆酶是一种含铜的糖蛋白氧化酶,也称为多铜氧化酶;就属性而言,它和植物中的抗坏血酸氧化酶、哺乳动物的血浆铜蓝蛋白同属蓝色多铜氧化酶(blue multi-copper oxidase)家族[2];就功能而言,漆酶是木质素降解酶之一,与木质素过氧化物酶(lignin peroxidase,LiP)和锰过氧化物酶(manganese dependent peroxidase,MnP)共同构成木质素降解酶系[3]。
漆酶作为生物代谢产物,在生物体内参与应激防御反应、细胞壁重建、形态发生、与宿主相互作用、腐殖质的代谢更新等生物学功能;在体外漆酶可催化多种酚类和芳香胺类化合物的氧化,降解多环芳烃[4]。漆酶氧化木质素中的酚型单元形成苯氧自由基,从而导致木质素相关结构的降解和转化,在合适的氧化还原介体存在时,漆酶还可催化氧化非酚型的木质素模型化合物[5-7]。可见,漆酶在木质素的生物降解有重要应用前景。除此之外,漆酶被广泛应用于工业氧化处理过程中,例如各类漂白、生物去污、乙醇生产、生物传感器、生物燃料电池等[8],在食品工业、制浆和造纸工业、纺织工业、土壤的生物修复等领域,备受研究者和生产加工者的关注[9]。但是,由于天然来源的生物漆酶产量低、价格昂贵,很难满足市场需求,漆酶的规模化和产业化相应受到限制,因此,寻求产漆酶的生物资源是摆在人们面前亟待解决的问题。
已有的研究证实,漆酶存在于植物、微生物、动物、昆虫的质体的各种器官或组织中。漆酶由Yoshi[10]首次在紫胶漆树(Rhusverniciflua)的渗出液中发现的, 随后人们发现微生物(真菌、细菌)、动物、昆虫也能分泌这种酶。植物来源漆酶主要出现在植物木质部,叶子、根中也有,植物漆酶主要参与愈伤组织形成、木质化等过程[11]。动物体中发现的漆酶很少,报道的有猪肾和麻蝇(Phormiacegina、Muscadomestica、Luciliasericata)、烟草天蛾(Manducasexta)、绿头苍蝇(Calliphoravicina)、蚊子和双翅目的迁移类蝗虫等[12-14]。相对于植物和动物来讲,微生物漆酶来源相对丰富,主要分为真菌来源和细菌来源,已知在多种真菌菌株分泌物中都检测到了漆酶的活性[15], 值得一提的是,真菌产漆酶具有以下几个优点:1)真菌分泌的漆酶都是胞外酶,使得漆酶的分离纯化相比胞内酶而言稍显容易,而且在胞外的稳定性也较好;2)产酶效率高, 产生漆酶酶系结构较合理, 相互间可发生强烈的协同作用; 3)可同时产生许多纤维素酶、半纤维素酶、果胶酶、淀粉酶等,这些酶的协同效应对降解木质素具有重要的意义。因此,真菌漆酶的研究备受瞩目,成为研究的热点[16]。
由于漆酶巨大的应用价值, 因此进行漆酶产生菌的分离筛选一直是漆酶研究的热点之一。到目前为止,已有从土壤中分离筛选产漆酶真菌的报道[17-20],但高寒草地土壤中产漆酶菌株的筛选鲜有报道。研究发现,东祁连山高寒草地土壤微生物多样性较为丰富[21],并且草地生态系统土壤微生物与其生态环境协同进化, 形成的一种适应性机制[22]。以高寒草地土壤分离出的56个真菌菌株为研究对象,选用与漆酶作用的几种底物为选择性培养基,并通过测定漆酶活力,筛选高寒草地土壤中的产漆酶菌株,并对筛选出的产漆酶菌株进行了产酶条件的研究,旨在为进一步工业化的开发和应用提供理论依据。
1 材料与方法
1.1 供试菌株
供试的56个真菌菌株由本课题组从东祁连山高寒草地土壤中分离筛选获得,保存于4℃冰箱。实验时间为2012年2-5月。
1.2 培养基
1.2.1菌株活化、保存培养基 PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1000 mL,pH自然,用于菌株的活化、复壮。
1.2.2产漆酶菌株筛选培养基 愈创木酚-PDA培养基:PDA 培养基灭菌后添加经无菌过滤器除菌的愈创木酚-乙醇溶液, 使愈创木酚的最终浓度为3 mmol/L。
α-萘酚-PDA培养基:以α-萘酚替代愈创木酚。
愈创木酚为底物的选择性培养基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,愈创木酚 10 g,琼脂 10 g,蒸馏水1000 mL。pH用稀盐酸调制6.0~7.0。
邻苯二酚为底物的选择性培养基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,邻苯二酚 10 g,琼脂 10 g,蒸馏水1000 mL。pH用稀盐酸调制6.0~7.0。
邻苯甲苯胺为底物的选择性培养基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,邻苯甲苯胺 10 g,琼脂 10 g,蒸馏水1000 mL。pH用稀盐酸调制6.0~7.0。
1.2.3液体产酶培养基 NaNO32.5 g,KH2PO41 g,CaCl2·6H2O 0.1 g,MgSO40.3 g,NaCl 0.1 g,FeCl30.01 g,油菜秸秆粉0.5 g,蒸馏水1000 mL,pH用稀盐酸调制6.0~7.0。
1.3 研究方法
1.3.1产漆酶真菌的初步筛选 将活化的菌株接种于愈创木酚-PDA培养基和α-萘酚-PDA培养基, 25℃培养,定时观察菌落生长和菌落周围颜色深浅变化情况。选出能在愈创木酚-PDA培养基和α-萘酚-PDA培养基产生褐色氧化带的阳性菌株,分别接种于以愈创木酚、邻苯二酚、邻苯甲苯胺为唯一碳源的选择性培养基,25℃培养,每天定时观察菌落形态的同时, 测量菌落直径、褐色氧化带变色圈的直径, 记录变色圈颜色深浅,以此作为定性指标,判断菌株产漆酶的情况。
1.3.2粗酶液的制备及漆酶活力测定 将筛选出的菌株接种于已灭菌的盛有50 mL发酵产酶培养基的150 mL锥形瓶中,以油菜秸秆粉为底物,不接菌为对照,于25℃,150 r/min震荡培养7~10 d,每个处理重复3次。培养结束后,在无菌操作的条件下,吸取5 mL上清液,于4℃,10000 r/min,离心10 min,取上清液制备粗酶液。
酶活力测定方法,以愈创木酚为漆酶底物,按照王剑锋等[23]的方法进行测定,1个酶活单位(IU)定义为1 min内氧化1 μmol 愈创木酚所需要的酶量。
1.3.3rDNA-ITS分子鉴定 真菌rDNA-ITS的分子鉴定方法参考相关文献[24]。
1.3.4产酶条件的研究 应用摇瓶液体发酵的方法,以油菜秸秆粉为底物,分别在不同培养条件下,测定漆酶酶活力。
1.4 数据处理及分析
所有数据均用Microsoft Excel 录入并作图,采用DPS 6.55进行数据分析。
2 结果与分析
2.1 产漆酶菌株的初步筛选结果
从56个供试菌株在α-萘酚-PDA培养基和愈创木酚-PDA培养基上的培养结果来看,菌株编号为1.9、2.1a、310b、301g、2.1c、3.7c、无孢、2.3a、2.4d、10a、H-待定、W-QLZ14等菌株能够在愈创木酚-PDA培养基上产生褐色的氧化带,菌株编号为1.9、2.1a、310b、301g、2.3a、2.4d、10a、H-待定、W-QLZ14等菌株能够在α-萘酚-PDA培养基上产生褐色的氧化带。
2.2 供试菌株在α-萘酚-PDA和愈创木酚-PDA筛选培养基上出现褐色氧化带的时序
由表1可以看出,在α-萘酚-PDA培养基上,接种后24 h,菌株1.9、2.1a、310b、W-QLZ14周围出现褐色氧化带,接种后48 h,菌株 H-待定周围出现褐色氧化带,接种72 h后,菌株301g、2.1c、2.3a、2.4d周围出现褐色氧化带。在愈创木酚-PDA培养基上,接种后24 h,菌株1.9、2.1a、310b、2.1c、2.3a、H-待定、W-QLZ14周围出现褐色氧化带,接种48 h后,菌株301g、2.4d、10a周围出现褐色氧化带,接种72 h后,菌株3.7c和无孢周围出现褐色氧化带。由此可见,不同菌株在不同底物作为诱导剂的培养基上出现褐色氧化带的时间不同,有的菌株产酶较早,有的菌株产酶较晚。另外,菌株3.7c、无孢和10a能在GUA+PDA培养基上产生褐色氧化带,而不在α-萘酚+PDA培养基上产生褐色氧化带。
2.3 供试菌株在3种筛选培养基上的生长情况及褐色氧化带
将筛选出的菌株,分别接种于以愈创木酚、邻苯二酚、邻苯甲苯胺为底物的选择性培养基上,由图1可以看出,11个菌株在3种底物的培养基上的菌落直径以及出现褐色氧化带直径不同,并且褐色氧化带颜色的深浅程度也不同。
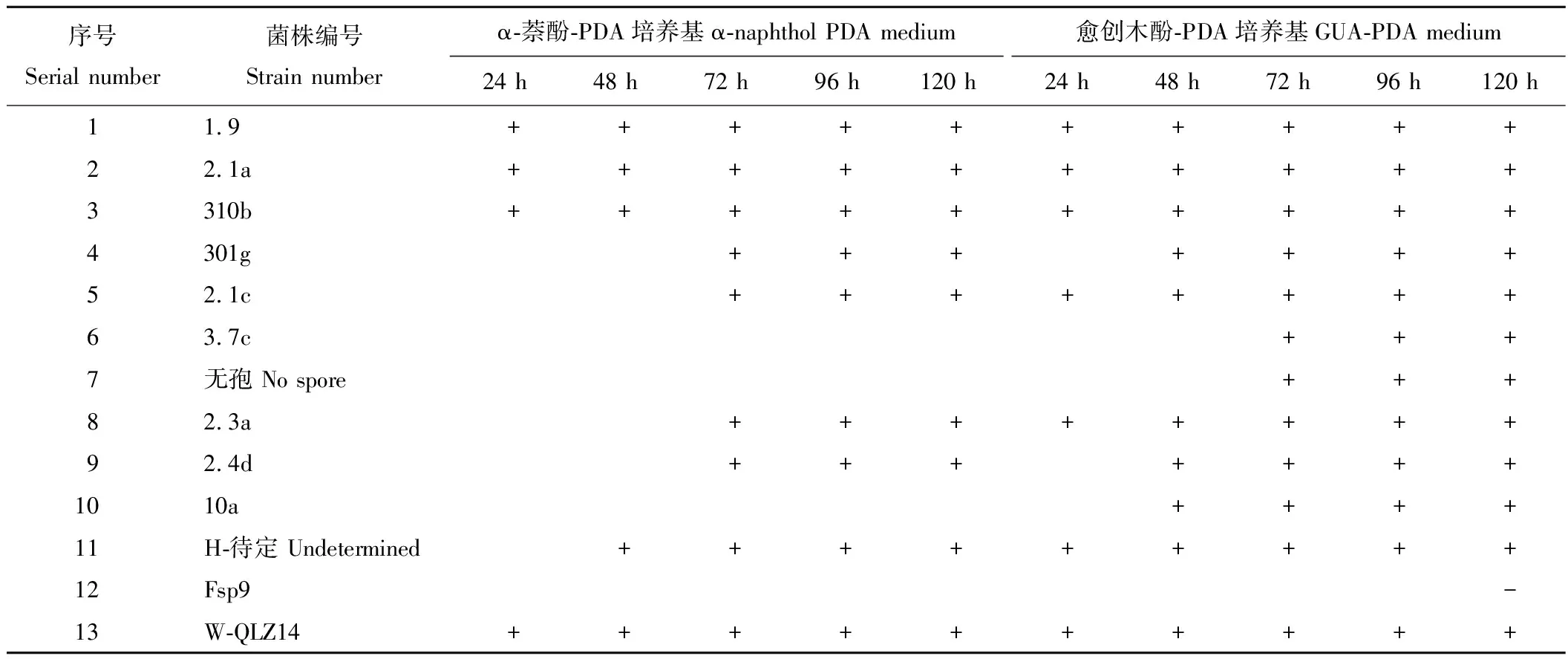
表1 供试菌株在α-萘酚PDA培养基和愈创木酚-PDA培养基出现褐色氧化带的时序Table 1 The appear timing of brown oxidation zone of strains on the α-naphthol PDA medium and GUA-PDA medium
注:+表示出现褐色氧化带。
Note:“+” indicates the emergence of brown oxidation zone.
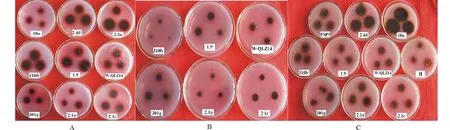
图1 供试菌株在3种选择性培养基上的生长情况及出现的氧化带Fig.1 The growth status and emergence brown oxidation zone of strains on three different selective mediumA:愈创木酚培养基Guaiacol selective medium;B:邻苯二酚培养基Catechol selective medium;C:邻甲苯胺培养基O-toluidine selective medium.

表2 供试菌株在选择性培养基上的菌落直径和氧化带直径Table 2 Colony diameter and oxidation zone diameter of strains on three different selective mediumcm
注:表中列出的氧化带直径一栏中,前面的数字表示氧化带直径, 括号中的“+” 表示颜色的深浅程度,“-”表示没有产生氧化带;菌落直径一栏中,括号中的“+”表示能生长,“-”表示不能生长,数字表示菌落直径大小。
Note:The table lists the oxidation zone and colony diameter,the previous number indicates oxidation zone diameter in the column of oxidation zone,“+” indicates color depth,“-” indicates there did not produce the oxidation zone in the brackets;In the column of colony diameter,“+” indicates strains can grow on the medium,“-” indicates strains did not grow,the previous number indicates colony diameter.
由表2可以看出,在愈创木酚培养基上,除Fsp9和H-待定2个菌株不能生长之外,其余9个菌株均能生长,并且产生褐色氧化带,1.9、310b、2.3a、2.4d 4个菌株的菌落直径较大,褐色氧化带直径较大,氧化带的颜色较深。在邻苯二酚培养基上,1.9、310b、301g、2.1c、2.1a、W-QLZ14 6个菌株能够生长,并且产生褐色氧化带,310b和2.1a的褐色氧化带直径较小,而1.9、301g、2.1c、W-QLZ14褐色氧化带直径较大。在邻苯甲苯胺培养基上,菌株2.3a不能生长外,其余10个菌株均能生长。310b、2.4d、10a 3个菌株产生褐色氧化带的直径大,颜色较深,菌株301g和H-待定产生的褐色氧化带的颜色较浅。
2.4 产漆酶酶活菌株的复选结果
测定漆酶酶活力的结果表明,以油菜秸秆为底物,液体摇瓶发酵后,只有菌株310b能够产生漆酶,其余菌株检测不到漆酶酶活。
2.5 产漆酶菌株的分子鉴定结果
将该序列在GenBank 中进行BLAST同源性比较,发现与GenBank中报道的1株Marasmiustricolor(登录号:JN943601)同源性达到99%以上。为了进一步确定目标菌株的分类地位,采用Neighbor-Joining 法(图2A)和UPGMA 法(图2B)分别构建系统发育树,结果显示,菌株310b在2种系统发育树中的结果一致,即与登录号为JN943601的菌株的亲缘关系最近,支持率高达99%~100%。通过rDNA-ITS 序列分析,菌株310b初步鉴定为Marasmiustricolor。
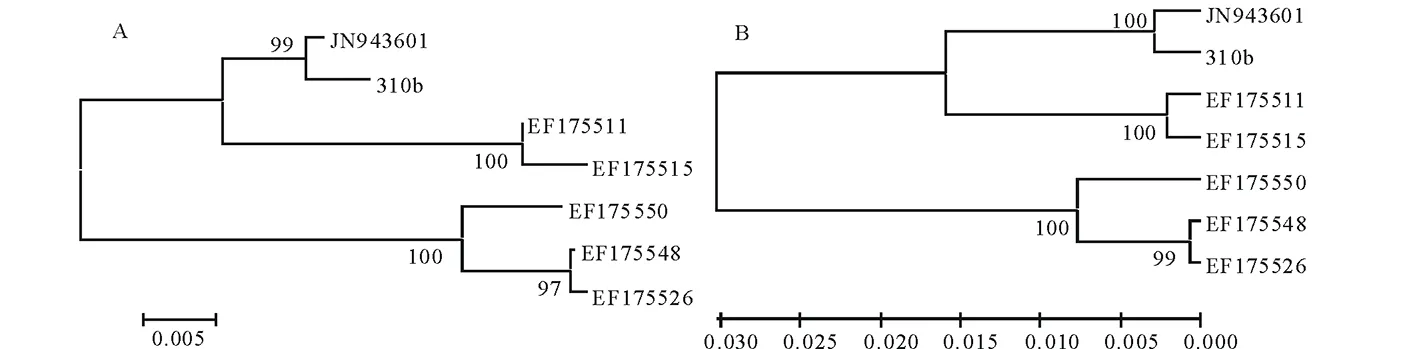
图2 菌株310b系统发育树的构建Fig.2 Construction of phylogenetic tree of strain 310b A、B分别为基于Neighbor-Joining法和UPGMA法的系统发育树。A, B is phylogenetic tree based on Neighbor-Joining method and the UPGMA method respectively.
2.6 产漆酶条件的研究结果
2.6.1温度对菌株310b产漆酶的影响 菌株310b在15~35℃范围内可以产漆酶,15~25℃随温度上升,漆酶活力增加,25℃时产漆酶活力最大,且差异极显著(P<0.01),25~35℃范围内,随温度上升,漆酶活力减少;在20~28℃范围内产酶活力达80%以上(图3)。
2.6.2初始pH值对菌株310b产漆酶的影响 初始pH值对菌株310b产漆酶活力有影响,较小的pH值有利于产酶,pH=4.0时漆酶活力最大,且差异极显著(P<0.01),之后随pH的增加,产漆酶活力呈下降趋势,但pH值在5.0~9.0范围内,漆酶活力下降幅度不大(图4)。我们推测,菌株310b分泌的漆酶有可能是一种偏酸性酶。
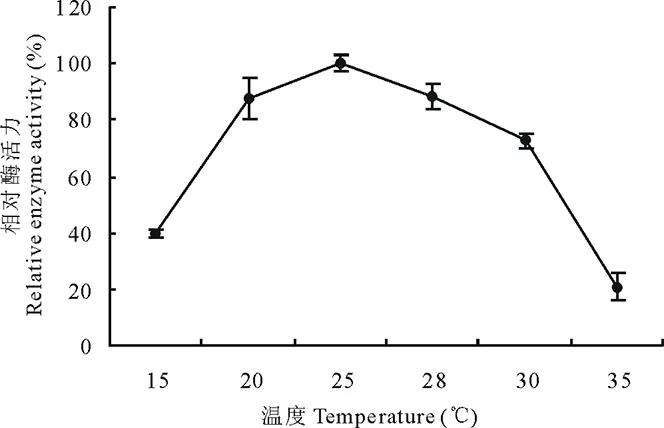
图3 温度对310b 产漆酶的影响Fig.3 The effect of temperature on laccase
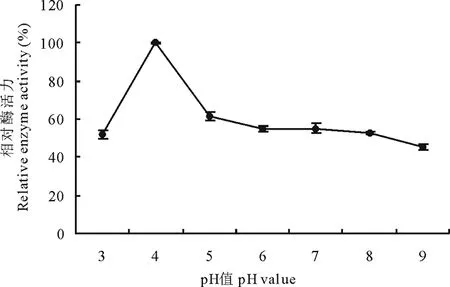
图4 pH对310b 产漆酶的影响Fig.4 The effect of pH value on laccase
2.6.3C源对菌株310b产漆酶的影响 以油菜秸秆粉作为唯一的碳源,分别添加葡萄糖、蔗糖、麦芽糖、可溶性淀粉、糊精、D-半乳糖、D-木糖、D-果糖、羧甲基纤维素钠(CMC-Na)进行摇瓶液体发酵, 由图5可以看出,不同碳源诱导菌株310b产漆酶活力不同,其中添加蔗糖可以促进菌株310b分泌漆酶,但差异不显著,而添加其他碳源会抑制菌株310b产漆酶的活力(图5)。
2.6.4N源对菌株310b产漆酶的影响 不同氮源对菌株310b产漆酶水平的影响结果如图6,可以看出分别以硫酸铵、酒石酸铵、硝酸钠、磷酸铵、蛋白胨、L-酪氨酸、DL-苯丙氨酸、L-赖氨酸、尿素作为不同氮源诱导菌株310b产漆酶活力不同,9种氮源中,蛋白胨最有利于菌株310b分泌漆酶,诱导漆酶活力最高,其次为L-酪氨酸和L-苯丙氨酸,尿素诱导产漆酶活力最低。
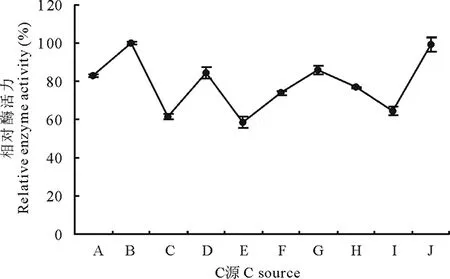
图5 C源对3.10b产漆酶的影响Fig.5 The effect of C-source on laccase
A:葡萄糖Glucose;B:蔗糖Saccharose;C:麦芽糖Maltose;D:可溶性淀粉Soluble starch;E:糊精Dextrin;F:D-半乳糖 D-galactose;G:D-木糖 D-xylose;H:D-果糖 D-fructose;I:羧甲基纤维素钠CMC-Na;J:油菜秸秆粉Rape straw powder.
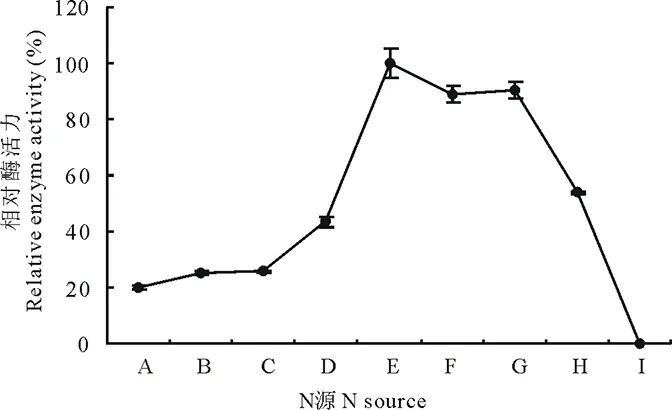
图6 N源对3.10b产漆酶的影响 Fig.6 The effect of N-source on laccase laccase
A:硫酸铵Ammonium sulfate;B:酒石酸铵Ammonium tartrate;C:硝酸钠Sodium nitrate;D:磷酸铵Ammonium phosphate;E:蛋白胨 Peptone;F:L-酪氨酸 L-tyrosine;G:DL-苯丙氨酸DL-phenylalanine;H:L-赖氨酸 L-lysine;I:尿素Urea.

图7 非营养有机物对310b产漆酶的影响Fig.7 The effect of non nutrient organic on laccase A:吲哚乙酸 Indoleacetic acid;B:邻甲苯胺 O-Tolidine;C:邻苯二酚 Catechol;D:α-萘酚α-naphthol;E:单宁酸 Tannin;F:愈创木酚 Guaiacol;G:吐温-80 Tween 80;H:对照CK.
2.6.5非营养有机物对菌株3.10b产漆酶的影响 分别在产酶培养基中添加1%的吲哚乙酸(In-doleacetic acid)、愈创木酚(Guaiacol)、邻甲苯胺(O-Tolidine)、邻苯二酚(Catechol)、α-萘酚(α-naphthol)、单宁酸(Tannin)、吐温-80(Tween 80),考察它们对菌株310b漆酶合成的影响,结果表明,邻甲苯胺、α-萘酚和吐温-80促进菌株310b漆酶的合成;愈创木酚、邻苯二酚、单宁酸、吲哚乙酸抑制菌株产酶,其中吲哚乙酸抑制作用最强烈(P<0.01)(图7)。
2.6.6Cu2+对菌株310b产漆酶的影响 在产酶培养基中添加一定量的CuSO4·5H2O,均有利于菌株产酶。结果显示,培养基中添加CuSO4·5H2O,在0.001~0.025 g/L范围内,随Cu2+增加,产漆酶活力增加,0.025 g/L时产酶活力最大(图8)。
2.6.7接种量对菌株310b产漆酶的影响 不同接种量对菌株310b产漆酶活力不同,随着接种量的增加,诱导漆酶活力增加(图9)。图9中,S1~S5分别表示不同的接种量,以在PDA平板上将培养7~10 d的供试菌用6 mm直径的打孔器切取1个菌饼(6 mm)为标准,按1,2,3,4,5个菌饼分别接种处理。
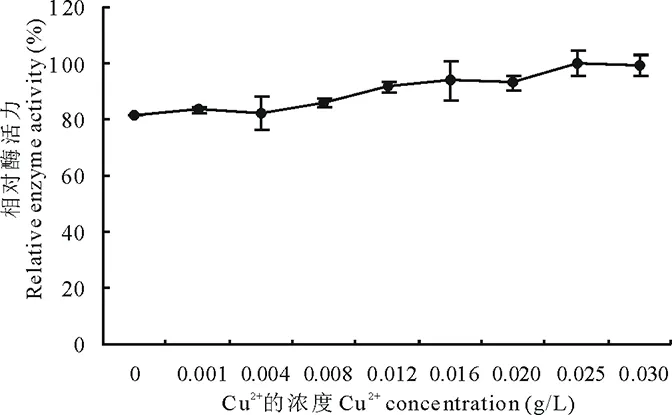
图8 Cu2+对310b产漆酶的影响Fig.8 The effect of Cu2+ on laccase
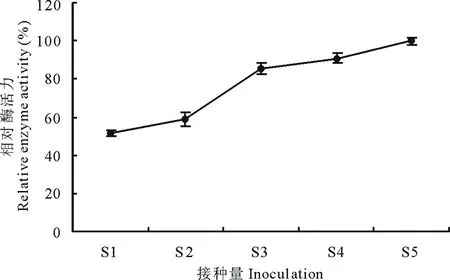
图9 接种量对310b产漆酶的影响Fig.9 The effect of incolum size on laccase
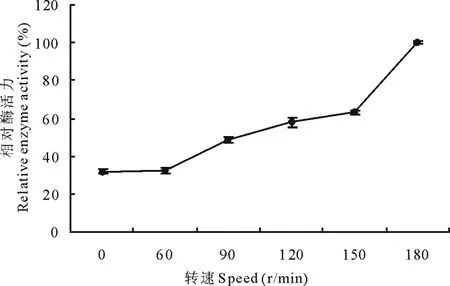
图10 转速对310b产漆酶的影响Fig.10 The effect of rotation speed on laccase
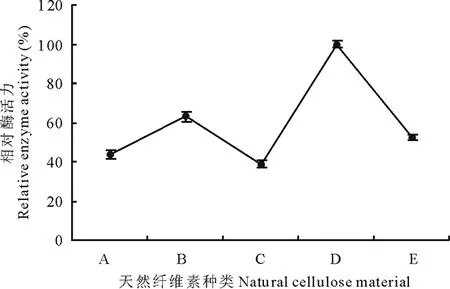
图11 天然碳源对310b产漆酶的影响Fig.11 The effect of natural C-source on laccase A:燕麦秸秆Oat straw;B:油菜秸秆Rape straw;C:玉米秸秆Maize straw;D:天然草地枯落物Litter of natural grassland;E:芨芨草秸秆Achnatherum splendens straw.
2.6.8转速对菌株310b产漆酶的影响 分别在0,60,90,120,150,180 r/min不同转速条件下考察对菌株310b产漆酶活力,由图10可以看出,从60~180 r/min随着转速的增加,漆酶活力增加,在转速为180 r/min的条件下,菌株310b产漆酶活力达到最大(图10)。
2.6.9天然碳源对菌株310b产漆酶的影响 天然草地枯落物最适于菌株310b产漆酶,其次为油菜秸秆、燕麦秸秆和芨芨草秸秆产酶量较低。玉米秸秆诱导菌株产漆酶活力最低(图11)。
2.6.10底物添加量对菌株310b产漆酶的影响 不同秸秆添加量对菌株310b产漆酶活力不同,从0~1 g随着秸秆添加量的增加,漆酶活力增加;1~2 g范围内,随着秸秆添加量的增加,漆酶活力减小(图12)。
3 讨论
3.1 产漆酶真菌的筛选
愈创木酚既是漆酶的氧化底物又是漆酶生物合成的诱导剂,α-萘酚对于漆酶的产生具有一定促进作用,以愈创木酚-PDA培养基和α-萘酚-PDA培养基结合使用可以保证所选出的产酶菌株是漆酶生产菌种, 而非愈创木酚氧化酶的生产菌株[18]。本研究根据漆酶本身的性质、催化底物以及微生物生产漆酶的特性,设计初步筛选产漆酶菌株的选择性培养基平板, 根据菌体生长及菌落大小、漆酶催化氧化还原反应产生的变色圈直径平均值及其变色圈颜色深浅程度,进行产漆酶菌株的筛选。实验中发现, 不同菌株在愈创木酚-PDA培养基和α-萘酚-PDA培养基2种平板上的显色反应有差别,这可能是在培养过程中这2种底物对不同菌株漆酶生物合成的诱导作用不同,这种现象的产生除了与菌株所合成漆酶的产量、活力和类型有关外, 可能还与不同菌株所产的漆酶对于愈创木酚和α-萘酚的催化专一性差别有关。另外,不同菌株在两种平板培养基上的生长速度不同,因此漆酶催化氧化还原反应产生的变色圈直径与菌落大小没有必然的相关性。同一菌株在不同底物的平板培养基上的显色圈相对大小不完全相同, 但大多数菌株呈现出了较好的一致性,在变色圈所显色泽和强度方面, 所有显色菌株在同种选择培养基的不同平行平板中都能显示出几乎一致的色泽与直径大小, 说明选择平板的稳定性和高度可重复性。
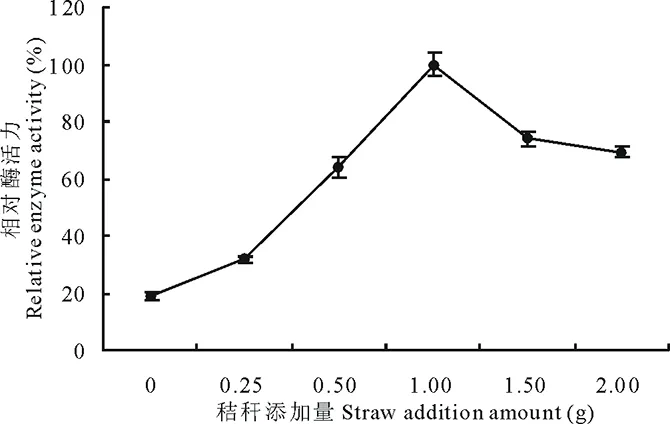
图12 秸秆添加量对310b产漆酶的影响Fig.12 The effect of straw amount on laccase
3.2 发酵条件对产酶活力的影响
环境因素诸如温度、pH值、碳源、氮源等显著影响真菌漆酶的产生,影响效果因菌株而异[25]。在本实验中,菌株310b在25℃时产漆酶活力最大,pH 4.0时漆酶活力最大,蔗糖和蛋白胨分别为最有利于漆酶合成的碳、氮源,邻甲苯胺、α-萘酚和吐温-80促进菌株310b漆酶的合成;愈创木酚、邻苯二酚、单宁酸、吲哚乙酸抑制菌株产酶,其中吲哚乙酸抑制作用最强烈α-萘酚和吐温-80对菌株产酶没有明显影响;愈创木酚、单宁酸、吲哚乙酸抑制菌株产酶,其中吲哚乙酸抑制作用最强烈。随Cu2+增加,产漆酶活力增加,0.025 g/L时产酶活力最大。随着接种量的增加,诱导漆酶活力增加。从60~180 r/min随着转速的增加,漆酶活力增加。从0~1 g随着秸秆添加量的增加,漆酶活力增加;1~2 g范围内,随着秸秆添加量的增加,漆酶活力减小。不同来源漆酶的最适温度、最适pH 值有差异, 无机离子对其影响也不完全相同, 这说明不同来源漆酶的化学组成可能不同; 所以在分离和筛选高酶活菌株时应考虑这些因素的影响。
3.3 产漆酶真菌的种类
据报道,产漆酶真菌不下于1000 种,而且超过100 种真菌漆酶,已经从相应的培养物中被纯化,并对其理化特性做了深入研究[15]。有许多报道称子囊菌纲(Ascomycetes)的许多真菌产漆酶,例如Gaeumannomycesgraminis、Magnaporthegrisea、Ophiostomanovoulmi、Melanocarpusalbomyces、Monocilliumindicum、Neurosporacrassa、Podosporaanserina等,但是没有做系统研究,很难确定具体有多少种子囊菌产漆酶。此外,漆酶在担子菌纲(Basidiomycetes)和半知菌纲(Deuteromycetes)中也分布广泛,例如研究较多的白腐菌、革菌属、栓菌属、蜜环菌属、多孔菌属、鬼伞属等,而漆酶产量普遍较高的主要是彩绒革盖菌[26]。近年来关于真菌产漆酶的报道较多,如:血红密孔菌(Pycnoporussanguineus)[27]、Paecilomycesmajor[28]、Penicilliumsimplicissimum[29]、烟管菌(Bjerkanderaadstar)[30]、Trichodermasp. LaTr01[31]、Sopharajaponica[32]、Geotrichumcandidum[33]、Trichodermaviride[34]、Trichodermasp. Z-3[35]、Trichodermasp.[36]、Curvularialunata[37]、PolyporusarculariusA08[23]、TrichodermaasperellumW03[38]等。研究内容集中在产酶菌株的筛选和发酵条件的优化,从东祁连山高寒草地土壤中筛选到了1株产漆酶菌株,经rDNA-ITS 序列分析结果,初步鉴定为:小皮伞属(Marasmiustricolor)。小皮伞属真菌(MarasmiusFr.)在分类学上隶属于担子菌门(Basidiomycota)、担子菌纲(Basidiomycetes)、伞菌亚纲(Agaricomycetidae)、伞菌目(Agaricales)、小皮伞科(Marasmiaceae)[39],其地生、木生或生于林中的枯枝落叶上,在我国29个省区有分布[40]。目前为止尚未见到小皮伞属真菌产漆酶的相关报道。
尽管漆酶的应用价值广,但是植物、动物、昆虫等天然来源的漆酶产量低、价格昂贵,而真菌大多在恶劣环境下才会启动漆酶的表达系统。依赖野生天然来源的漆酶生产,难以满足工业需求,漆酶的产业化受到限制。随着分子生物学的发展,漆酶的异源表达系统的构建和利用为漆酶工业化大规模生产提供了一条新的可发展途径,但是,为实现这一目标,必须明确产漆酶真菌的资源。因此,从不同环境中分离和筛选产漆酶真菌,挖掘产漆酶真菌资源,仍然是人们继续努力的方向和目标。

