紫花苜蓿EMS突变体库的构建和形态学性状鉴定
夏曾润,杜凤凤,李偲,张吉宇,刘勇,霍雅馨,孔令芳
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院 ,甘肃 兰州 730020)
植物突变体库的构建是研究功能基因组学的重要基础[1]。拟南芥(Arabidopsisthaliana)[2]、水稻(Oryzasativa)[3]等模式植物和小麦(Triticumaestivum)[4]、玉米(Zeamays)[5]、大豆(Glycinemax)[6]等粮食经济作物突变体库的建立在研究其功能基因和阐明基因功能方面起了重要作用。采用物理、化学等诱变方法构建饱和基因突变群体,进而通过突变体分析鉴定基因功能,是功能基因组学研究最直接、最有效的方法[7]。EMS (甲基磺酸乙酯)是最常用且有效的化学诱变剂之一,它使鸟嘌呤烷基化产生O-6-烷基鸟嘌呤,直接与胸腺嘧啶错配,可导致点突变[8-9],生物学上广泛运用EMS诱变来创建突变体库和育种[10]。韩锁义等[11]利用EMS对“南农86-4”大豆种子进行诱变,构建了大豆品种的突变体库,并在M3代获得了蛋白质和含油量变化明显的优质材料。汪念[12]2009年利用甘蓝型油菜(Brassicanapus)半冬性品种宁油7号的一个DH系作为野生型亲本材料,通过EMS诱变剂诱变后获得了大型突变体库,0.6%和0.3%的突变体库包含M2单株分别为7110和3926,共发现表型变异突变体11036株。Chiu等[13]利用EMS构建的拟南芥突变体库,筛选到TORNAD02基因的不同变异类型,确定了该基因在花的心皮发育过程中起到的重要作用。Kuraparthy等[14]利用二倍体小麦构建的EMS突变体库,筛选到单蘖突变体并且成功地定位了控制分蘖的tin_3基因在染色体的位置,开辟了提高谷类作物产量的新方向。
苜蓿属植物生态类型丰富[15-16],但功能基因组学研究仍处于起步阶段,目前仅在模式植物截形苜蓿(Medicagotruncatula)建立了EMS突变体库[17-18]。紫花苜蓿(Medicagosativa)素有“牧草之王”和“饲料皇后”的美誉[19-20],是产业化发展前景良好的优质豆科牧草,然而目前,国际上尚未见报道创建的紫花苜蓿突变体库。因此,本研究以甘农3号紫花苜蓿种子为材料,构建了其EMS突变体库,并对其变异形态学性状进行了初步鉴定,为深入研究紫花苜蓿品种改良、功能基因组等方面提供基础材料。
1 材料与方法
1.1 供试材料
试验用甘农3号紫花苜蓿种子由甘肃农业大学曹致中教授提供。试验于2010年10月-2011年12月在兰州大学草地农业科技学院智能温室进行,EMS购自Sigma-Aldrich公司(M0880-10G)。
1.2 EMS诱变处理
精选5000粒甘农3号种子,浓硫酸处理5 min以打破硬实,蒸馏水冲洗5次。种子于4℃冰箱磷酸缓冲液(100 mmol/L,pH 7.0)预浸12 h。用磷酸缓冲液配置浓度分别为0,0.2%,0.4%,0.6%,0.8%,1.0%,1.2%,1.6%,2.0%(v/v)的EMS(甲基磺酸乙酯)溶液,使用不同浓度EMS溶液室温黑暗条件下分别处理500粒种子18 h,期间翻转轻摇,蒸馏水冲洗EMS处理种子3次,每次30 min,以去除残留的EMS。每个浓度5次重复,每个重复处理100粒种子。
1.3 发芽试验
分别对9个浓度处理种子采用纸上发芽,每皿100粒,每个处理4次重复。20℃培养箱中培养,期间每天统计发芽数,共统计10 d。第4天各处理随机取10个幼苗测定胚根长、胚芽长。根据发芽数和致死率,分析半致死剂量。
最终发芽率(%)=供试种子的发芽数/供试种子总数×100发芽指数(GI)=∑Gt/Dt
式中,Gt为在t日的发芽数,Dt为发芽天数。
1.4 植株突变性状鉴定
半致死剂量处理后的种子播种于花盆,盆栽土壤为耕种多年的熟成灰钙土,pH为8.7,肥力中等,温室适宜条件培养,并统计成活总株数。植株生长期间,以野生型为对照观察突变形态学性状,分类统计鉴定,挂标牌标记并拍照。
突变株频率(%)=突变株数/成活总株数×100
1.5 数据分析
实验数据采用Excel 2010进行均值和标准差的计算及制图,SPSS 13.0软件进行单因素方差分析(One-Way ANOVA)与多重比较数据分析。
2 结果与分析

图1 不同EMS浓度处理对甘农3号紫花苜蓿种子发芽率的影响Fig.1 Effect of different concentrations of EMS on seed germination of M. sativa var. Gannong No. 3
2.1 EMS对M1代萌发和生长的影响
不同浓度EMS诱变处理的M1代种子进行发芽试验,分别统计发芽率、胚根长和胚芽长。结果表明,EMS对甘农3号紫花苜蓿种子的萌发有抑制作用,随着EMS浓度的增大,对种子萌发和幼苗生长的抑制作用愈发显著。分析得甘农3号紫花苜蓿EMS诱变导致突变的半致死剂量浓度为1.2%,此时种子的最终发芽率为48%。
2.1.1EMS对种子发芽过程的影响 不同浓度EMS处理后,种子萌发均延缓,且延缓效应随剂量的增大而增大。未处理对照种子的萌发率高峰出现在第2天,达89%;低浓度(0.2%~0.8%)的EMS处理,萌发率高峰出现在第3天;中浓度(1.0%和1.2%)的EMS处理,萌发率高峰分别出现在第4和5天;而高浓度(1.6%和2.0%)EMS处理则严重抑制了种子萌发,最终发芽率仅为9%(图1)。
2.1.2EMS对种子最终发芽率、发芽指数的影响 各处理的最终发芽率和发芽指数均显著低于对照(P<0.05),最终发芽率和发芽指数随EMS浓度递增而逐步减小(图2)。低浓度(0.2%~0.8%)的EMS处理后最终发芽率均高于80%;而高浓度(1.6%和2.0%)EMS处理后最终发芽率仅为9%,发芽指数分别为8.27和10.13;浓度为1.2%的EMS处理后,甘农3号紫花苜蓿种子的最终发芽率为48%,发芽指数为26.98;可将此剂量作为甘农3号紫花苜蓿种子EMS处理的半致死剂量。
2.1.3EMS处理甘农3号种子对幼苗生长的影响 EMS处理显著抑制了甘农3号紫花苜蓿幼苗胚根胚芽的生长(图3),表现为随着EMS浓度的不断增大抑制作用越强烈。胚芽长在EMS浓度大于1.0%的处理间不显著,但抑制作用极为明显,当浓度为2.0%时,幼苗胚芽长仅为0.1 cm。浓度为1.2% EMS处理种子后幼苗胚根、胚芽的平均长度分别为对照的19.35%和8.00%。
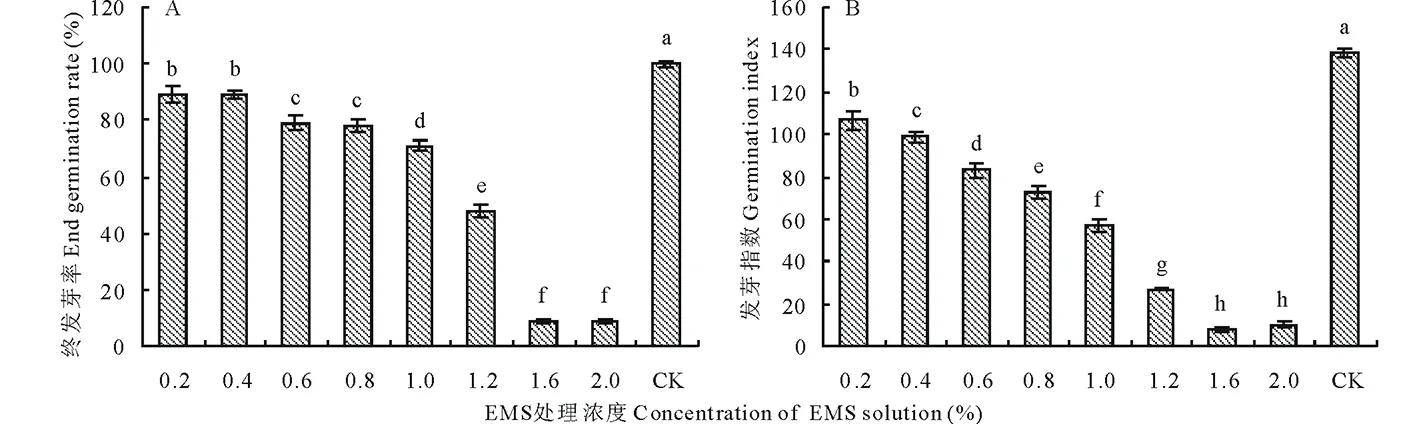
图2 EMS对甘农3号种子发芽率(A)、发芽指数(B)的影响Fig.2 Effects of EMS on germination rate (A) and germination index (B) of M. sativa var. Gannong No. 3 图中不同小写字母表示P<0.05水平差异显著。下同。Different letters indicated significantly difference at 0.05 level. The same below.
2.2 M1代植株突变性状鉴定分析

图3 不同浓度EMS处理对幼苗胚根和胚芽的影响Fig.3 Effect of EMS treatment on seedlings radicle and germ
对EMS诱变后甘农3号紫花苜蓿群体M1代1039个单株的叶片、分枝数、株高以及开花时间等生物学、形态学性状进行调查,结果表明, M1代的诸多性状均发现了突变株。M1代1039个单株中有378株(不含叶形突变)出现了一到多个性状的突变,发生突变性状的植株达36.38%(表1)。
2.2.1M1代植株性状突变 统计结果表明,突变群体中共观察到215株M1代的叶片颜色发生了变异,突变频率达20.69%(表1)。共包括9种类型,分别表现为黄白斑杂叶(图4 a)、黑褐色叶片、叶红紫(图4 b)、黄斑块(图4 c)、叶深绿色(图4 d)、灰绿色叶(图4 e)、黄化苗(图4 f)、白化苗(图4 g)以及矮化并叶黄植株。其中叶片黄斑块(点)变异株数最多为73株,突变率达7.03%。4株白化苗在幼苗期表型明显,不到成熟期就已经死亡,可能是白化苗缺乏叶绿素无法进行光合作用补充营养的缘故。随着植株的不断生长,叶片颜色的部分突变性状逐渐消失,表型不再明显。除了叶片颜色的突变之外,叶片还发生了形状的突变。共有6种突变类型,分别表现为卷曲皱缩叶(图4 h)、心形叶、圆形叶、针形叶、叶缘锯齿和叶尖平缘(图4 i)。还观察到小叶数的突变性状,同一叶柄上出现4,5,6或7个小叶(图4 j)。
在突变群体中共观察到135株甘农3号紫花苜蓿的株型、分枝数发生了突变(表1),突变频率为12.99%。单株分枝数包括2种典型,分别为多分枝和单枝。32株多分枝紫花苜蓿植株占总成活植株的3.08%,它们的平均分枝数为13。共有8个单株枝条未发生分枝。相同栽培条件下的对照组植株一般分6枝。紫花苜蓿植株的枝条呈现类似三叶草(Trifoliumpratense)的匍匐茎(图4 k)、半匍匐(图4 l)突变性状,不表现为对照组正常的直立型,突变率分别为0.58%和0.87%,这样的突变单株为研究优良放牧型紫花苜蓿品种提供了可能基因。矮化苗(图4 m)突变率为6.64%,极度矮化(抑制生长)的植株(图4 n)有11株。抑制生长植株、半矮化和正常株同期内在相同环境条件下的自然生长高度呈现明显的变化梯度(图4 n)。
2.2.2株高、节间长突变性状 M1代紫花苜蓿中度矮化株和极度矮化植株(抑制生长)的平均株高分别为正常株高的51.9%和12.4%(表2),极度矮化苗的株高仅为6.7 cm。单株第5节间长随正常植株、半矮化植株和抑制生长植株依次递减,并且表现为差异显著,变化趋势跟株高一致。
2.2.3其他性状突变 突变群体中观察到28株早开花植株,突变频率为2.69%。部分花的颜色不表现为正常的紫色,呈现出蓝色外缘花瓣(图4 o),浅蓝浅紫镶嵌(图4 p),并且外层花瓣泛白色(图4 q)。
3 讨论
丰富的种质资源是作物育种和功能基因组学研究的重要基础,突变体库为其提供了丰富的原始材料[21]。化学诱变剂诱发突变具有操作简便、突变频率高等特点[9,22]。目前,通过化学因素诱发构建突变体库的方法已成为创建新型种质资源的一种有效手段[21]。在拟南芥[13,23]、油菜[14]、大豆[24]、小麦[14,25-26]、水稻[27]等植物中利用EMS诱变技术构建了多个突变体库,并在育种和功能基因组学研究中发挥了极其重要的作用。该技术还主要集中运用在对农作物的突变体库构建,并且技术已经相对比较成熟,但运用于牧草及饲料作物构建突变体库的发展还处于起步阶段。本研究以甘农3号紫花苜蓿为试验材料,采用EMS化学诱变的方法,探究了诱变剂对M1代种子萌发的影响以及突变植株性状的形态学表现,初步构建了紫花苜蓿EMS诱变突变体库。
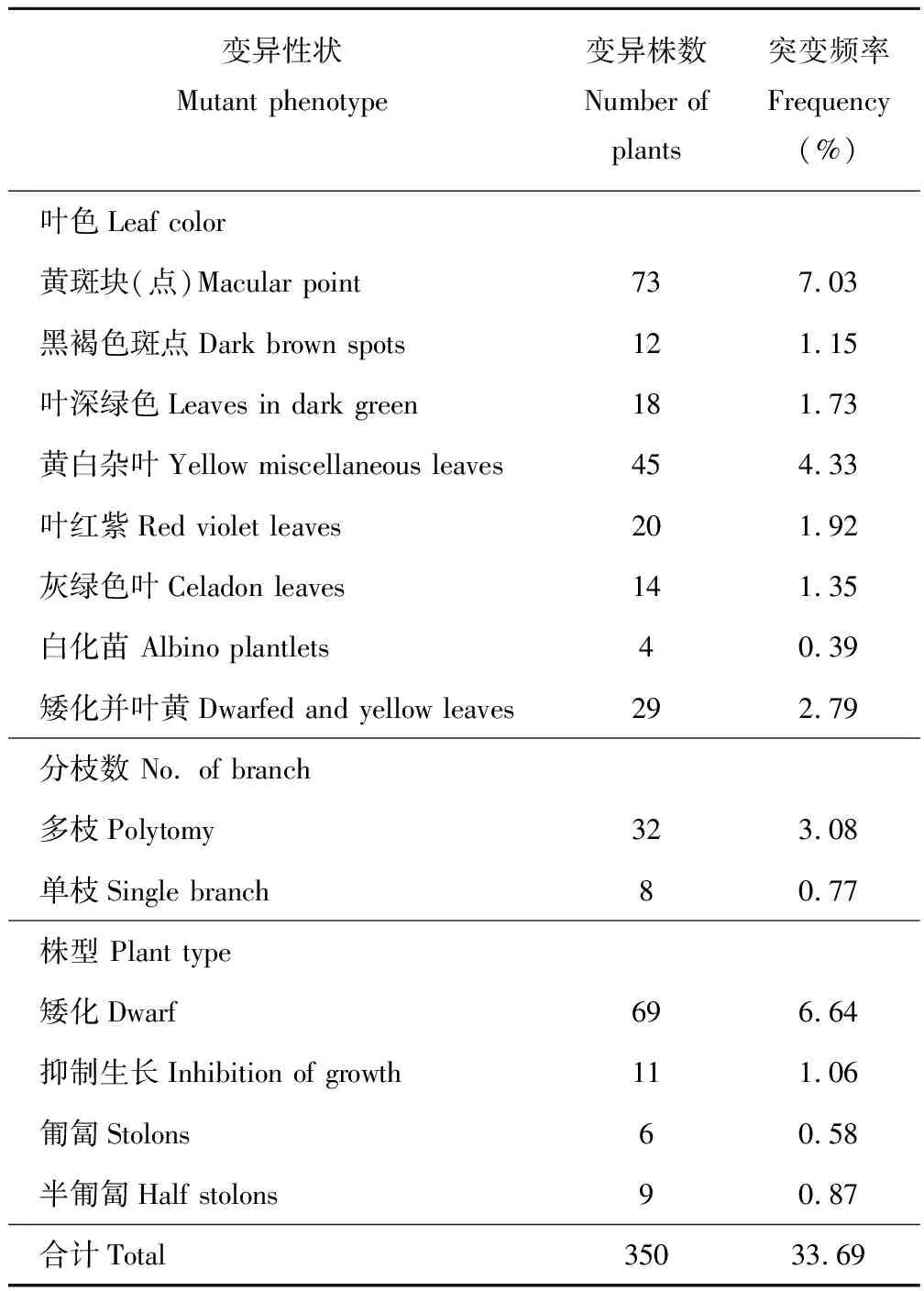
表1 M1代植株突变表型性状统计Table 1 Summary of visible phenotypic classes observed in the preliminary screening of M1 generation

图4 观察到的M1代植株代表性突变表型 Fig.4 Visible phenotype of representative M1 generation plant mutation a:黄白斑点杂叶;b:叶红紫;c:黄斑块;d:叶色深绿;e:灰绿色叶;f:黄化苗;g:白化苗;h: 卷曲皱缩叶;i:从左至右依次表现为叶缘锯齿、叶尖平缘、针形叶、圆形叶、心形叶;j:小叶数突变;k:匍匐枝;l:半匍匐;m:矮化苗;n:从左至右依次为抑制生长、半矮化、正常株;o:蓝色外缘花瓣;p:浅蓝浅紫花;q:花瓣外层泛白色。a: Yellow miscellaneous leaves; b: Red violet leaves; c: Macular point; d: Leaf in dark green; e: Celadon leaf; f: Etiolated seedlings; g: Albino plantlets; h: Curly crimped leaf; i: From left to right, serrated, blade tip flat margin, needle leaf, orbiculate leaf, heart-shaped leaf; j:The leaflet mutants; k: Stolons; l: Half stolons; m: Dwarf; n: From left to right, inhibition of growth, dwarf, normal plant; o: Blue rim petals; p: Pale blue light purple flower; q: Outer the white petals.

测量项 Measurement index株型Plant type均值Average (cm)标准差Standard deviation最大值Max (cm)最小值Min (cm)株高Plant height正常株Normal plant 53.94±6.7 a6.7167.045.0矮化Dwarf28.06±2.8 b2.8332.023.0抑制生长Inhibition of growth 6.71±1.4 c1.378.64.5节间长Internode length正常株Normal plant4.83±0.9 a0.906.63.6矮化Dwarf2.39±0.5 b0.553.31.6抑制生长Inhibition of growth1.53±0.3 c0.312.11.1
注:同列不同小写字母表示差异显著(P<0.05)。
Note:Different small letters in the same column indicate significant difference atP<0.05 level.
本试验利用9个浓度EMS诱变处理甘农3号紫花苜蓿种子,诱变后的效应表明,随着诱变剂量的增加诱变效果明显,但浓度过高其萌芽率较低甚至致死。说明EMS改变了甘农3号紫花苜蓿种子自身的发芽潜力,大大降低了其活力。王幼平等[28]研究表明,高浓度的EMS使甘蓝(Brassicaoleracea)种子细胞受到较严重的生理损伤,这种损伤在短期内尚不能完全修复,因此种子萌发过程中的幼苗生长和呼吸代谢降低,植株生长受抑制,从而导致发芽率、发芽势和平均株高下降。经诱变处理的种子,在发芽时生长停滞或死亡,其原因是发芽时糖分相对地比未处理的少[29-30]。采用EMS浸泡种子进行诱变处理时,处理浓度和时间不同则诱变效果不同,浓度过高、处理时间越长,会产生严重损伤,失去选择机会;浓度较低,则不会产生明显的变异[31-32]。因此,根据不同的实验条件,选择最适宜的浓度和处理时间尤为重要[33-34]。本试验最终确定紫花苜蓿的EMS诱变半致死剂量为1.2%(v/v),此时种子的最终发芽率为48%。Wang等[35]利用TILLING技术确定甘南型油菜的EMS诱变最适浓度在0.3%~0.6%之间,与本研究所得结果存在差异,这可能跟处理材料和方式有关。
使用半致死剂量处理甘农3号紫花苜蓿种子,共获得M1代植株1039株。经筛选鉴定,获得了一批具有叶片颜色、分枝数、株型、叶形、株高以及早开花等一个至多个形态学突变性状的突变群体。由于EMS处理方法的差异或不同材料对EMS的敏感程度不同,EMS处理的诱变频率也不尽相同。徐艳花等[26]利用EMS诱变处理普通小麦豫农201种子,突变频率达11.44%。叶俊等[36]、孙加焱[21]利用60Co γ射线和0.4%的EMS溶液分别处理水稻“9311”种子和甘蓝型油菜高油605种子,表型突变率分别为5.62%和30.58%。本试验获得突变株共378株(不含叶形突变),表型变异率达36.38%。EMS诱变处理紫花苜蓿的变异频率远远高于小麦、水稻、油菜、大豆等其他植物,这意味着EMS诱变技术有可能在紫花苜蓿中创造更多的等位变异。其中,叶片颜色突变最为显著,包括叶片黄斑块(点)、黑褐色叶片、叶深绿色、黄白杂叶、叶红紫、黄化苗、灰绿色叶、白化苗以及矮化并叶黄植株等9种性状类型,占总突变率的56.87%。不同性状的突变频率差异很大,可能与EMS作用位点或控制各性状基因数目的差异有关[37]。出现多种叶斑突变体,这可能是由于植物某些关键基因的突变引起细胞程序化自发死亡而形成类病斑状的突变体[28]。9种叶色变异类型在苗期均有表达,其中部分叶色突变株与Jarvis等[38]利用T-DNA标签法研究拟南芥时得到的黄化转绿型突变体ppil相似,其黄化性状不能在整个生育期内持续表达,在叶片成熟时转为正常绿色或者深绿色,还有类似病斑的叶片后期逐渐萎黄、死亡。孙加焱[21]在研究甘蓝型油菜叶部突变体时曾发现类似的黄化幼叶成熟期转绿的现象,关于花斑叶片的后期变化情况尚未见报道。这些叶片变异材料的深入研究将对叶色相关功能基因的分离提供一定条件,紫叶突变性状受环境影响小,在整个生育期稳定表达,可作为明显而可靠的标记应用于杂交育种和突变体选择,简化良种繁育过程,提高育种效率[37,39-40]。理想的株型、叶形有利于提高植株的光合作用效率,加速光合产物从源向库的积累,从而增加单位面积的经济产量[41-42],试验发现卷皱、狭长、锯齿、多叶等叶形突变。整个生长期内,对照组植株叶片长势良好,野生型叶片为羽状三出复叶;托叶大,卵状披针形,先端锐尖,基部全缘,脉络清晰;叶柄比小叶短;小叶长卵形、倒长卵形至线状卵形,等大,或顶生小叶稍大,先端钝圆;顶生小叶柄比侧生小叶柄略长[42]。突变群体中还发现类似于三叶草匍匐、半匍匐枝型植株,对该突变基因研究为培育放牧型紫花苜蓿品种提供了可能,从而改变直立型苜蓿不耐牧只适合刈割的缺陷性。这些优质种质资源是人工诱变得到的,因而有可能获得控制这些优良性状新基因或新的等位变异[43]。因此,对这些突变体进行深入的遗传学研究具有深远的实际意义。
本试验采用EMS化学诱变甘农3号紫花苜蓿种子,经M1代种子萌发和突变形态学性状鉴定,明确了EMS对紫花苜蓿种子萌发和幼苗生长的影响关系,已经获得一批产生明显变异的甘农3号突变群体,建立了紫花苜蓿EMS诱变突变体库。对突变群体M2、M3代的田间表型调查和重复鉴定、TILLING技术平台构建以及反向遗传学技术评估突变体库[44],转录组学研究突变性状在发育过程中基因表达谱等工作将是下一步研究的主要内容。

