外源植物激素对NaCl胁迫下苦马豆苗期脯氨酸代谢的影响
王若梦,董宽虎,李钰莹,李晨,杨静芳
(山西农业大学动物科技学院, 山西 太谷 030801)
植物激素对植物的抗逆性有着重要的作用。植物处于逆境条件下,自身生理调节物质以及次生代谢产物会发生显著变化,外源施加植物激素可有效提高植物对外界不利环境的抵抗能力[1-3]。有研究表明,外源ABA可有效提高植物对盐分的适应性,并且可以促进某些抗逆性蛋白和酶的生成,提高自身的抗逆性[4-5];细胞分裂素类物质促进盐胁迫下种子的萌发,提高了植物自身的激素含量[6]。可见,不同的植物激素,对植物生理生化都有重要的调节作用[7-8],而且对逆境环境有显著抵抗作用[9-13]。但是就目前的研究状况来看,对于植物激素的研究和应用主要集中在园艺、园林等具有观赏性的植物[6,14],而对牧草抗逆性提高和适应逆境环境的研究并不多,因此还有待进一步的探讨。
苦马豆(Swainsoniasalsula)系豆科苦马豆属(Sphaerophysa)多年生草本植物。为耐盐碱的中旱生植物,主要分布于我国中西部地区的盐碱草地、河岸低湿地,是防止草地退化和保持水土的重要植物[15]。目前苦马豆的研究主要集中在药理方面[16-17]。在苦马豆耐盐生长方面,已有研究表明,盐胁迫抑制苦马豆细胞膜修复,造成苦马豆种子萌发推迟和发芽势下降[18]。本试验通过对苦马豆进行不同浓度的NaCl胁迫,同时施以外源植物激素(6-BA和ABA),对其生长速率、根冠比、脯氨酸 (Pro) 含量及脯氨酸代谢酶活性进行测定,通过其变化探讨盐胁迫下,外源植物激素对苦马豆抗盐性和脯氨酸代谢的影响,为进一步研究外源植物激素对苦马豆耐盐性的影响和培育耐盐苦马豆品种提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验用苦马豆种子于2010年秋采自山西省原平市大营村滹沱河畔的盐碱化草地,东经112°47′32.8″,北纬38°56′21.3″,海拔820 m。
1.2 试验方法
试验在山西农业大学草业科学系日光能温室进行,温室内温度16~32℃,湿度60%~85%,栽培基质采用蛭石和珍珠岩1∶1(v/v)比例混合,装入育苗盆内,插入PVC管,便于Hoagland完全营养液浇灌。试验采用完全随机区组设计,播种量为100粒/盆,播种72盆,出苗1周后,3 d使用1次营养液,于下午6:00-7:00进行。采用称重法以蒸馏水补充每日失水。出苗30 d后,选取长势相对均匀的植株进行定株,每盆定苗20株。定苗2周后进行盐胁迫,试验以NaCl进行胁迫,浓度为0,80,160,240,320,400,480,560 mmol/L 8个盐分浓度梯度,3次重复,每次胁迫以含相应浓度的营养液为处理液,按照各个处理的不同盐分浓度,平均7次加入,最终达到各自相应的NaCl处理浓度。对照只进行营养液的浇灌。盐胁迫期间,每日下午6:00-7:00分别对不同处理的苦马豆地上部分均匀喷施脱落酸(ABA, Sigma公司)和6-苄氨基嘌呤(6-BA, Sigma公司),浓度均为50 mg/L。胁迫2周后,分别对叶片和根系进行采样,放于-80℃冰箱中,进行各项指标分析。
1.3 测定指标和方法
1.3.1生长速率和根冠比测定 在苦马豆生长期间,测定不同时间段的生长高度,以计算其平均生长速率。取样后,将苦马豆地上部分和地下部分分开,分别称取鲜重。根冠比=地上部分/地下部分。
1.3.2Pro含量的测定 按照邹琦[19]的方法进行。采用磺基水杨酸-酸性茚三酮法进行提取和测定。
1.3.3P5CS活性的测定 P5CS抽提按照Kishor等[20]的方法进行。蛋白含量测定按照Bradford[21]的方法进行,以牛血清蛋白为标准蛋白。P5CS活性测定按照Garcia-Rios等[22]的方法进行。
1.3.4δ-OAT活性的测定 δ-OAT粗酶提取按照Roosens等[23]的方法进行。蛋白含量测定按照Bradford[21]的方法进行,以牛血清蛋白为标准蛋白。δ-OAT活性的测定按照Kim等[24]的方法进行。反应液体系为:50 mmol/L的磷酸缓冲液、35 mmol/L L-鸟氨酸、5 mmol/L α-酮戊二酸和0.05 mmol/L磷酸吡哆醛混合液,总体积为0.9 mL,加入酶液0.1 mL,在25℃条件下反应20 min后加入0.3 mL 3 mol/L 的高氯酸终止反应,然后再加入0.2 mL 2%茚三酮,沸水浴中加热20 min进行染色,冷却后10000 r/min离心去上清液。用无水乙醇溶解红色沉淀物,离心后取上清液于510 nm测定吸光值。产物P5C与茚三酮生成红色物质的摩尔消光系数为16.5 mmol/(L·cm)。以每分钟生成0.001 μmol P5C的量为1个δ-OAT活性单位(U)。
1.3.5ProDH活性的测定 参照Lutts等[25]方法提取,略做改动。样品加入四倍体积提取缓冲液 (w/v)于冰浴中研磨,提取缓冲液为0.1 mol/L Na2HPO4-KH2PO4(pH 7.8),内含1 mmol/L EDTA,10 mmol/L β-巯基乙醇。匀浆液经3层纱布过滤后4000 r/min离心15 min。上清液加TritonX-100至其终浓度为0.15%,漩涡混匀后冰浴30 min,然后20000 r/min离心20 min,上清液测定酶活。
活性测定反应混合液体积为2.5 mL,内含0.15 mol/L Na2CO3-NaHCO3(pH 10.3)缓冲液1.6 mL,0.2 mL 0.1 mol/L L-Pro,0.2 mL 0.9 mmol/L 2,6-二氯酚靛酚。30℃水浴保温15 min,加入0.5 mL (0.8 mg蛋白/mL)酶提取液,混合均匀后加入0.2 mL 0.9 mg/mL PMS试剂(临时现配),摇匀后立即于600 nm下检测光密度变化。以每分钟A600减少0.001为1个ProDH酶活性单位(U)。
1.4 统计分析
试验测定各项数据通过Excel 2007进行分析整理。
2 结果与分析
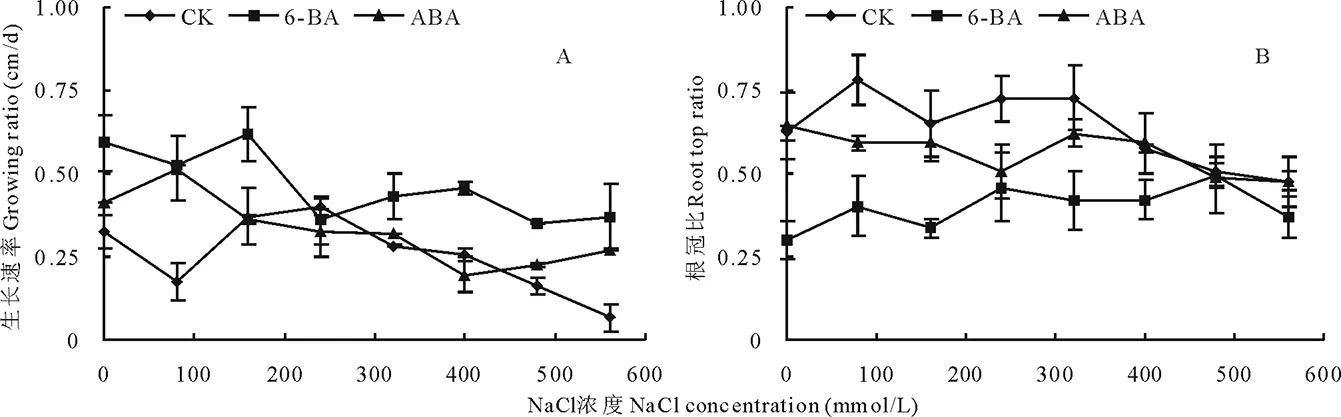
2.1 植物激素和NaCl对苦马豆生长状态的影响
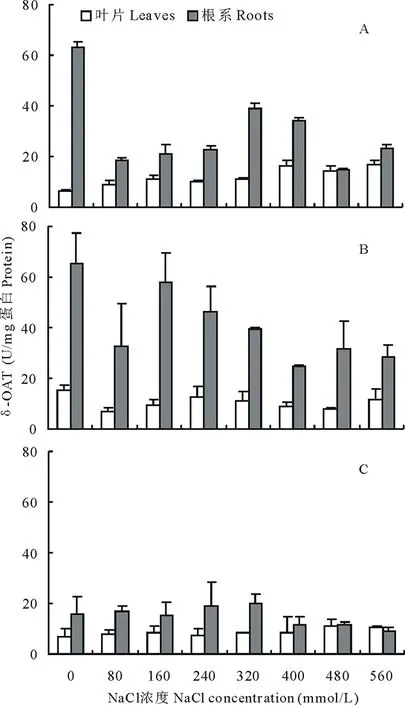
随着NaCl浓度的增大,苦马豆生长速率逐渐下降(图1 A)。0 mmol/L盐处理下,生长速率从小到大分别是CK<6-BA 未经植物激素处理的苦马豆幼苗,根冠比随盐浓度升高呈先升高后降低的趋势(图1 B),在560 mmol/L NaCl出现最小值0.48 。经6-BA和ABA处理后,在盐胁迫期间根冠比显著低于未喷施经植物激素的处理,且在各盐浓度下,ABA处理后的根冠比均高于6-BA,分别是其2.1,1.4,1.8,1.1,1.5,1.4,1.0和1.3倍。 随着盐浓度升高,苦马豆叶片和根系中的脯氨酸含量显著升高(图2A),且根系中脯氨酸含量高于叶片,在NaCl浓度为560 mmol/L时达到最大值682.69 μg/g FW,此浓度下叶片中脯氨酸含量显著降低,只有259.13 μg/g FW。经6-BA处理过的苦马豆幼苗,脯氨酸含量呈先降后升的现象(图2B),在160 mmol/L NaCl浓度下,叶片和根系中含量达到最低值,分别是51.21和23.70 μg/g FW,仅是同浓度下未经激素处理的60%和23%。经ABA处理后的苦马豆幼苗,脯氨酸含量随盐浓度升高出现先升高后降低的趋势(图2C),在NaCl浓度为400 mmol/L时,叶片和根系中脯氨酸含量达到最高,分别为175.78 和283.36 μg/g FW。在3种处理中,虽然总量上存在很大差异,但是根系中的脯氨酸含量都高于叶片,且NaCl浓度为560 mmol/L时,叶片中脯氨酸含量显著降低。 图1 苦马豆苗期生长速率(A)和根冠比(B)Fig.1 The growing ratio (A) and root top ratio (B) of S. salsula seedlings 未经植物激素处理的苦马豆幼苗,P5CS含量呈先升高后降低趋势(图3A),在NaCl浓度为400 mmol/L时,根系中P5CS含量出现最大值为2.44 U/mg 蛋白,CK (0 mmol/L NaCl)中叶片P5CS含量最高,分别是其他浓度下的3.5,2.6,5.5,4.3,1.1,3.3,3.8倍。经6-BA处理后的苦马豆幼苗中P5CS在叶片和根系中含量显著高于未用激素处理的(图3B),除0 mmol/L NaCl+6-BA外,P5CS含量呈先升后降的状态,NaCl浓度为400 mmol/L 时,叶片和根系中出现最大值分别为2.74和2.98 U/mg蛋白。而经ABA处理后的幼苗中P5CS含量趋于稳定(图3C),处于1.00~1.80 U/mg蛋白之间,且叶片含量普遍高于根系。 在3种实验处理中,苦马豆幼苗根系中δ-OAT活性显著高于叶片,以CK最为显著(图4A),达63.35 U/mg蛋白,是叶片的9.7倍。除CK和 0 mmol/L NaCl+6-BA外,随着NaCl浓度的增大,苦马豆幼苗中叶片和根系中δ-OAT活性均是先升高再降低,出现最大值的NaCl浓度依次是320,160和240 mmol/L。图4可明显看出经ABA处理后的苦马豆幼苗δ-OAT活性显著低于6-BA处理后的,而0 mmol/L NaCl+ABA根系中δ-OAT活性只占到前两种处理的25%和24% 。 如图5所示,苦马豆幼苗经3种处理后ProDH活性均出现先升后降状态,且叶片高于根系,叶片中最大值分别为78.67,62.01和56.80 U/g FW,出现的NaCl浓度分别是400,240和240 mmol/L;根系中最大值分别为67.47,45.53和44.20 U/g FW,出现的NaCl浓度分别是320,320和160 mmol/L。但是经过激素处理后的苦马豆幼苗中ProDH活性低于未经激素处理的。 植物激素是植物生长必需的物质,在植物整个生活史中占有重要地位。植物激素量的调控对植物生长有着重要的影响[26-27]。实验结果表明,经过6-BA和ABA处理过的苦马豆幼苗具有较高的生长速率,随着盐浓度的增加,下降也相对缓慢,在高盐情况下仍能保持基本正常的生长。细胞分裂素类物质和脱落酸是植物生长过程中的重要激素[28],在植物处于逆境条件时,外源添加,可以有效促进抗氧化酶活性,提高植物的抗逆性[29-30]。 图2 不同NaCl浓度下脯氨酸含量Fig.2 Pro under different treatments of NaClA:NaCl; B: NaCl+6-BA; C: NaCl+ABA。下同 The same below. 根冠比是衡量植物生长状况以及对环境的适应程度的又一重要指标。是指某时期内植物地下和地上部分干重或鲜重的比值[31]。研究表明,在低浓度盐胁迫时,根冠比有上升趋势,随着盐浓度不断增大,出现下降。因为叶片相对于根系对盐胁迫更为敏感[32-33],因而在低盐浓度时,已经受到影响,高盐时,叶片和根系均受到损伤,所以出现了先升高后降低的现象[34-35]。与生长速率相反,经外源植物激素处理过的苦马豆幼苗的根冠比均小于未经激素处理的,原因可能是由于植物激素是在叶片喷施的,6-BA和ABA都可不同程度地促进植物细胞的分裂和增殖[31],因此地上部分累积干物质和水分含量大于未经激素处理的。 植物处于环境胁迫时,如旱、涝、冷、冻、盐渍等,体内会产生大量游离脯氨酸,通过调节渗透压,提高自身抗性[31,36-37]。而植物体中脯氨酸含量的多少,直接影响植物的抗逆性,并且与抗旱、抗盐性具有正相关关系[38]。实验结果表明,无论是否经植物激素处理,苦马豆幼苗中脯氨酸含量都随NaCl浓度的增大而升高,但是从脯氨酸累积量上来说,喷施2种植物激素的处理中,脯氨酸含量远远低于直接处于盐胁迫状态下的苦马豆幼苗,二者相差3倍之多。6-BA和ABA虽然可以提高植物的抗逆性,但是本实验结果说明,外源植物激素的加入对于脯氨酸累积有抑制作用,但较低的脯氨酸含量并不影响苦马豆的正常生长。有实验证明,6-BA可有效增加植物体内抗氧化酶活性,防止植物受到外界环境的干扰[29]。 图4 不同NaCl浓度下δ-OAT酶活性Fig.4 Ornithineoxo-acid transaminase (δ-OAT) under different treatments of NaCl 图5 不同NaCl浓度下ProDH酶活性Fig.5 Proline dehydragenase (ProDH) under different treatments of NaCl 植物体内游离脯氨酸的积累主要受合成和分解两个过程的影响。目前研究表明,脯氨酸合成有两条途径,分别是谷氨酸途径和鸟氨酸途径,二者主要区别是合成脯氨酸的初始底物和关键酶不同。吡咯啉-5-羧酸合成酶(P5CS)和鸟氨酸δ-氨基转移酶(δ-OAT)分别是这两种合成途径的关键酶。脯氨酸脱氢酶(ProDH)是脯氨酸降解过程中关键的限速酶,其活性的强弱对于脯氨酸的积累有着至关重要的作用,在植物处于逆境胁迫时,ProDH活性受到抑制,减少对脯氨酸的分解,促进脯氨酸的大量积累[38]。实验结果表明,苦马豆处于盐胁迫时,体内的两种脯氨酸合成酶P5CS和δ-OAT活性升高,对脯氨酸的积累有重要作用。6-BA处理后的苦马豆幼苗,P5CS和δ-OAT活性均高于ABA处理的和未经激素处理的苦马豆幼苗,而且根部的酶活性大于叶片的酶活性,说明,植物根系的酶活性对植物激素更为敏感。而直接接触植物激素的叶片的两种酶的活性却相对受到抑制,尤其是δ-OAT的活性。原因可能是过多的植物激素,造成了植物叶片生理调节出现紊乱,造成酶系统的失调[2,31],而根部是由植物通过疏导组织将激素自上而下运送而来,从量上来说已经达到相对平稳的水平,因而在根系中能够起到促进的作用。ProDH活性在不同盐分浓度中呈现先升高后降低的状态,体内过多的脯氨酸通过反馈机制调节ProDH活性,使其活性增强,随着盐浓度增大,脯氨酸不断累积,增大细胞渗透能力,抑制ProDH活性。外源植物激素的介入,与未经激素处理相比,整体降低了ProDH活性,更有利于脯氨酸的累积,但从脯氨酸量来看,结果恰恰相反,喷施两种植物激素处理的脯氨酸含量远远低于直接处于盐胁迫状态下的苦马豆幼苗。原因可能是植物激素大大促进了两种脯氨酸合成酶的活性,使其远远高出正常水平,由于酶活性过高而形成的负反馈调节,反而抑制脯氨酸的合成,造成脯氨酸量上的差异[39]。植物激素的作用是多方面的,由于本实验只进行了脯氨酸及其代谢酶的相关测定,对于其他抗逆性指标并不了解其变化,所以需进行更加深入的研究才能对植物激素对植物抗盐性的机制进行准确的判定。 外源植物激素可以提高盐胁迫下苦马豆的抗逆性,在较高盐浓度下仍能较为正常地生长,根系中酶活性对植物激素的敏感程度大于叶片。且6-BA比ABA的作用更为显著。通过植物激素的调节,使苦马豆幼苗中脯氨酸不再是主要的抗逆性来源。2.2 脯氨酸的影响
2.3 P5CS活性的影响
2.4 δ-OAT活性的影响
2.5 ProDH活性的影响
3 讨论
3.1 外源植物激素对苦马豆幼苗生长的影响
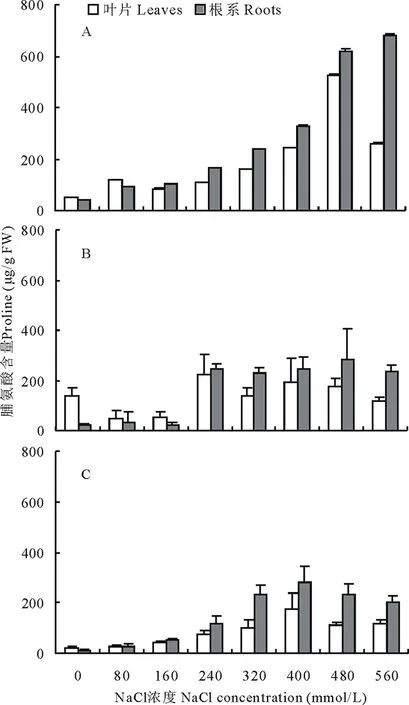
3.2 外源植物激素对苦马豆幼苗脯氨酸代谢的影响

4 结论

