一种Guyenotia放射孢子虫的形态和分子序列特征
孙海伟 习丙文 谢 骏,
(1. 南京农业大学无锡渔业学院, 无锡 210095; 2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业与种质资源利用重点实验室, 无锡 214081)
放射孢子虫(Actinospore)是黏体动物(Myxozoan)生活史中寄生在环节动物(Anneild)宿主体内的重要阶段。自Stolc[1]在颤蚓(寡毛类)中首次发现和报道放射孢子虫以来, 在很长一段时间内放射孢子虫一直被认为是与黏孢子虫 (Myxospore) 亲缘关系很近的独立生物类群, 并隶属于黏体动物门(Myxozoa)放射孢子虫纲(Actinosporea);同时, 由于该类群未曾发现严重的经济或社会影响, 相关的报道和研究非常稀少。然而, 1984年, Wolf 和Markiw[2]对有关虹鳟“旋转病”(Whirling disease, WD)病原脑黏体虫(Myxobolus cerebralis)生活史的开创性研究, 发现了脑黏体虫生活史存在鱼和寡毛类(Tubifex tubifex)两个替换宿主(Alternative host), 放射孢子虫只是黏体动物在寡毛类宿主体内的一个生活阶段。此后, 有关放射孢子虫的研究日益增多和受到广泛关注。在系统分类上, Kent等[3]建议将此前的射孢子虫纲和黏孢子虫纲合并, 放射孢子虫纲作为黏孢子虫纲的同物异名而禁制使用, 但建议保留了原放射孢子虫纲 17个属的名称, 将其看作集合类群(Collective group)用以描述和划分具有相似形态特征的放射孢子虫。在鱼类寄生虫病害方面, 对发病水体放射孢子虫的调查和鉴定成为掌握黏孢子虫病感染、传播的重要研究内容[4]。目前, 来自匈牙利、美国、日本等国家的学者已开展了大量有关黏孢子虫病发生地区放射孢子虫区系调查, 报道了约 200余种类型的放射孢子虫[4—6], 通过传统的实验室感染方法鉴定出40余种鱼体寄生黏孢子虫所对应的寡毛类寄生放射孢子虫[6]。
黏孢子虫是我国养殖鱼类和野生鱼类资源重要的寄生虫病原, 已报道种类约600余种[7]。其中一些种类对我国鱼类养殖造成非常严重的危害, 如引起鲤鱼肠道巨囊病的吉陶单极虫(Thelohanellus kitauei), 大量寄生在锦鲤鳃丝引起死亡的野鲤碘泡虫(Myxobolus koi), 引起草鱼肠道糜烂的饼形碘泡虫(Myxobolus artus), 寄生在鲫鱼咽部和肝脏引起大量死亡的洪湖碘泡虫(Myxobolus honghuensis)和吴李碘泡虫(Myxobolus wulii)等。然而, 我国黏孢子虫病的研究大多致力于种类分类、组织病理和流行病学和药物防治[8—10]。有关黏孢子虫的感染、传播、个体发生、生活史等缺乏详细的研究, 特别是在黏孢子虫的放射孢子阶段的研究报道屈指可数。在2000年, 王桂堂和姚卫建[11]在国内首次报道了一种三突放射孢子虫(Triactinomyxon)。此后, 翟艳花等[12,13]分别报道了2种放射孢子虫(Triactinomyxon和Raabeia); Xi等[14]报道了在池塘黏孢子虫调查过程中发现的3种放射孢子虫(Raabeia, Aurantiactinomyxon和Guyenotia)。
在江苏地区黏孢子虫病高发池塘放射孢子虫的区系调查过程中, 作者发现了多种放射孢子虫。本文描述一种Guyenotia 类型放射孢子虫形态特征, 并通过 18S rDNA序列克隆和比对发现该Guyenotia放射孢子虫可能为一种鱼体寄生楚克拉虫在苏氏尾鳃蚓寄生发育阶段所对应的放射孢子虫。
1 材料与方法
1.1 实验材料
2013年 5月中旬, 在江苏常州地区一多年鲫鱼养殖塘口, 用采泥器取塘底淤泥, 40目钢筛筛除淤泥, 收集水蚯蚓。
1.2 实验方法
水蚯蚓的培养 将收集到的水蚯蚓带回实验室, 将水蚯蚓分别转移到称量瓶中, 每个称量瓶(50 mm×30 mm)中3—5条, 并加入约4 mL曝气自来水, 室温培养。
水蚯蚓 18S rDNA PCR扩增 实验所用的提取DNA试剂盒为QIAamp DNA Micro Kit (QIAGEN)。切取水蚯蚓尾部一小段放入灭过菌的1.5 mL的离心管中, 按照说明书的步骤依次进行提取基因组 DNA。水蚯蚓 18S rDNA PCR扩增所用引物为ERIB1 (ACCTGGTTGATCCT GCCAG)和 ERIB10 (CCTCCGCAGGTTCACCTACGG)[15]。PCR反应条件为: 94℃ 预变性5min, 94℃变性30s, 52℃退火30s, 72℃延伸60s, 循环30次, 最后72℃末端加尾7min。
放射孢子虫的收集 每天在显微镜下观察水体中是否有水蚯蚓释放的放射孢子虫, 一旦检测到有放射孢子虫, 将该组水蚯蚓进一步单个培养在称量瓶中, 以确定释放放射孢子虫的蚯蚓个体。在显微镜下观察和记录,并开始收集有放射孢子虫的水样, 直到蚯蚓不再释放放射孢子虫为止, 每次收集到的水样装入 50 mL的离心管中, 放到–80℃的冰箱中保存起来。
放射孢子虫形态特征测量 在光学显微镜下观察该放射孢子虫的形态, 并用图森TAC-9.0C显微摄像进行拍照; 用显微镜测微尺对放射孢子虫进行测量。
放射孢子虫18S rDNA PCR扩增 将保存在–80℃的样品取出融化后, 5000 r/min离心10min富集放射孢子虫。基因组提取同样严格按QIAamp DNA Micro Kit 试剂盒说明, 在加 Buffer AL 的时候提前加入 carrier RNA 1 ng。提取的基因组除一部分用于18S rDNA PCR 扩增,其余部分放–20℃冰箱保存。放射孢子虫18S rDNA采用巢氏PCR 方法扩增。实验所用外引物为ERIB1和ERIB10;内引物为 Myxosp-F(TTCTGCCCTATCAACTW GTTG)和Myxosp-R(GGTTTCNCDGRGGGMCCAAC)[16]。PCR 反应条件: 第一轮扩增94℃ 预变性5min; 94℃变性30s, 48℃退火45s, 72℃延伸90s, 循环30次; 72℃末端加尾7min;第二轮扩增 94℃ 预变性 5min; 94℃变性 30s, 52℃退火30s, 72℃延伸60s, 循环30次; 72℃末端加尾7min。第一轮PCR时, 所加的模板量为10 μL, 第二轮PCR时所加模板量为 3 μL。
PCR 反应液的配制 10×PCR buffer (Mg2+) 5 μL;dNTP Mixture 4 μL; 正向引物(20 μm) 2 μL; 反向引物(20 μm)2 μL; Takara Ex Taq (5 U/μL) 0.5 μL; 补灭菌水至 50 μL。
序列比对和系统发育分析 PCR 扩增产物经 1%琼脂糖凝胶电泳回收, 送上海生物工程有限公司测序。获得的18S rDNA 的序列在NCBI数据库中BLAST检索同源性序列。序列多重比对使用Clustal X软件[17], 序列间的一致性分析使用MEGA 4.0 软件[18]。为了分析放射孢子集合类群与黏孢子虫类群间是否存在对应关系, 通过检索GenBank中登录的放射孢子虫序列, 并Blast比对和下载相似性最高的黏孢子虫序列进行系统发育分析。系统发育分析在 MEGA4.0[18]软件中采用最小进化法(Minimum Evolution)、最大似然法(Maximum Likelihood),分支置信度用Bootstrap自展检验1000次。
2 结果
2.1 水蚯蚓的鉴定
在调查中采集到的水蚯蚓在虫体后部具有丝状的鳃。这一形态特征是环节动物寡毛类尾鳃蚓典型特征。PCR扩增获得水蚯蚓18S rDNA 序列片段长度为1803 bp。序列比对分析表明该水蚯蚓与 GenBank 中的苏氏尾鳃蚓(Branchiura sowerbyi)(DQ459985)的序列一致性最高(99.8%)。因此可以鉴定该水蚯蚓为苏氏尾鳃蚓。
2.2 放射孢子虫鉴定
放射孢子虫的检测 通过连续 2周的显微镜检查, 在采集到的400条水蚯蚓中仅检查到1条释放出本文报道的放射孢子虫, 感染率为0.25%。苏氏尾鳃蚓每天释放放射孢子虫的高峰出现在下午。
放射孢子虫的形态特征 检查到的放射孢子虫呈Guyenotia集合类群的典型特征。孢体呈球形, 无孢柄, 极囊呈三个点状紧簇的位于胞体顶部, 三个尾柄呈指状且末端较钝, 尾柄核近尾柄末端。孢体长 10.7 μm (10.0—12.1); 极囊 1.8 μm (1.7—2.0); 尾柄长 20.5 μm (17.4—23.8), 宽5.8 μm (4.8—6.3)。为了便于区别该类群其他放射孢子虫, 作者根据目前惯例将其命名为 Guyenotia type CZ (图 1、图 2)。

表1 本文描述放射孢子虫与文献报道中相似放射孢子虫的形态学比较Tab. 1 Comparison of measurements of the newly identified and the known Guyenotia types reported in scientific literatures
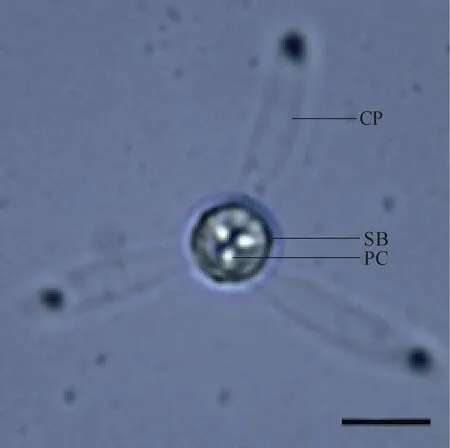
图1 Guyenotia type CZ放射孢子虫的整体形态(标尺=10 μm)Fig. 1 Morphology of the Guyenotia type (Scale bar = 10 μm)
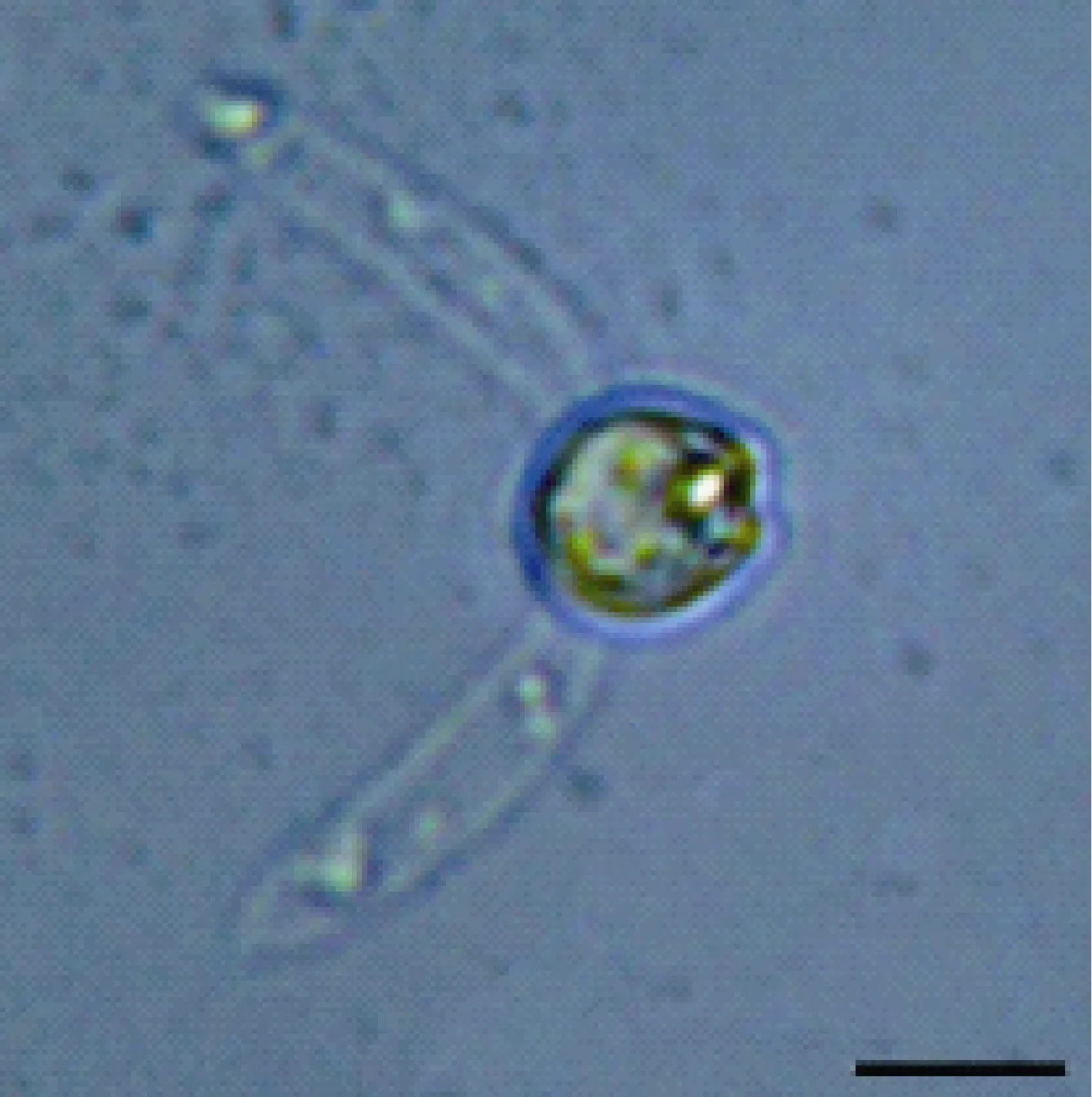
图2 Guyenotia type CZ放射孢子虫的侧面观(标尺=10 μm)Fig. 2 Lateral view of the Guyenotia type (Scale bar = 10 μm)
18S rDNA 序列比对和系统发育分析 PCR扩增获得的放射孢子虫18S rDNA 序列为935 bp(GenBank 登录号为 KF912153)。NCBI中 BLAST比对分析显示本报道的 Guyenotia放射孢子虫 18S rDNA 序列与两极科(Myxidiidae)的楚克拉属(Zschokkella)和两极虫属(Myxidium)的孢子虫, 以及球孢科(Sphaerosporidae)的Sphaerospora sp.(AY735411)具有较高遗传相似性。其中,Guyenotia type CZ2013与GenBank中的Zschokkella sp.(DQ118776)、Sphaerospora sp. (Eszterbauer, et al.[22]AY735411)和放射孢子虫 Guyenotia (Eszterbauer, et al.[21]AY779063)的序列一致性最高, 分别为 98.2%、98.1%、97.7%。在构建的系统发育树中(图 3), 本文报道的 Guyenotia type CZ 与 Zschokkella sp. (DQ118776)、Guyenotia (AY779063)稳定的聚为一个分支。
3 讨论
自 Wolf 和 Markiw[2]首次证实放射孢子虫是黏孢子虫一个早期形态阶段后, 这个发现已经被大家所认可,并陆续被研究者报道; 到目前为止报道的放射孢子虫有200多种(17个组合群)。在放射孢子虫类群的鉴定中, 孢体的形状、孢柄的有无、尾柄在胞体后发生位置和尾柄形状都是非常重要的鉴定特征。本文描述的放射孢子虫(图1、图 2)孢子体呈球形, 极囊呈三个点状紧簇的位于胞体顶部, 尾柄呈三个指状且末端较钝, 尾柄核近尾柄末端,这些形态特征为Guyenotia类群的典型特征, 因此将该放射孢子虫划归为该集合类群。通过形态特征比较, 本文报道的放射孢子虫与文献中已报道Guyenotia类群的放射孢子虫同时存在以下形态差异: (1)寄生宿主不同, 表1中所报道的放射孢子虫的宿主多为正颤蚓、夹杂带丝蚓这 2种寡毛类动物, 而本文报道的放射孢子虫的宿主为苏氏尾鳃蚓。(2)形态大小有差异, 如表1中 Eszterbauer等[20]所报道的 Guyenotia 类型放射孢子虫的尾突长度为15—21 μm, 宽度为 3.5—5.5 μm, 孢子体长度为 9.5—12 μm,极囊为1.3—2 μm; Xiao等[19]所报道的Guyenotia 类型放射孢子虫的尾突长度为21 μm宽度为4.5—6.4 μm, 孢子体长度为9.5 μm, 极囊为3 μm。从这些数据上可以看出与本文所描述的放射孢子虫有差别。(3)本文报道的放射孢子虫的极囊占孢子体的比例与 Eszterbauer等[21]报道的Guyenotia类型的放射孢子虫的差异明显, 后者的极囊/孢子体要小于本文报道的, 虽然整体形状都归为同一类群,但是极囊占孢子体的位置也有很大的区别, 比如后者极囊排列紧密。本文报道的放射孢子虫与 Xi等[14]报道的Guyenotia放射孢子虫在形态、个体大小和宿主非常相似,可能为同一种放射孢子虫。然而, 由于放射孢子虫的形态特征非常简单, 仅仅依据形态很难做出准确的鉴定[20]。此外, Xi等[14]报道的 Guyenotia放射孢子虫由于没有提供DNA序列, 本文也无法通过分子序列对其进行比较分析。
作者在比较GenBank中Sphaerospora sp. (AY735411)(采集自鲫鱼肾小管), 和 Zschokkela sp. (DQ118776)(采集自鲫鱼胆管)的序列时发现这2个来自不同黏孢虫科的孢子虫18S rDNA序列完全一致。在Fiala[23]构建的黏孢子虫 18S rDNA 系统发育树中(见文章中 Fig. 5),Sphaerospora sp. (AY735411)单个聚类在整个两极科大分支中。因此, 作者倾向于认为 Eszterbauer 和 Szekely[22]在GenBank中登录的Sphaerospora sp. 序列(AY735411)可能由于采样过程样品污染, 或组织同时感染有 2种黏孢子虫导致出现的错误; Zschokkella sp. (DQ118776)的鉴定和DNA测序结果应该是正确的。Eszterbauer等[21]在运用18S rDNA 序列鉴定放射孢子虫Guyenotia (AY779063)时也注意到该放射孢子虫与Sphaerospora sp. (AY735411)和Zschokkella sp. (DQ118776)的序列一致性分别为100%和99.9%。
在黏孢子虫种类鉴定中, 不同种的种内18S rDNA序列差异没有统一界限, 种内差异通常在1%—3%[24—26]。本文报道的Guyenotia type CZ 与楚克拉(Zschokkella sp.DQ118776)的序列一致性为98.2%, 系统发育分析中其与两极科楚克拉属聚为一支, 因此, 作者认为Guyenotia type CZ应属于楚克拉属(Zschokkella )的黏孢子虫在苏氏尾鳃蚓寄生阶段所对应的放射孢子虫。
自 Kent等[3]废止射孢子虫纲类群有效后, 放射孢子虫纲下原有的属名被以集合类群(Collective group)形式保留, 用于描述和划分具有相似形态特征的放射孢子虫。目前, 发现不同水体中的放射孢子和鉴定其所对应的鱼体寄生黏孢子虫种类引起寄生虫学和鱼病学研究人员广泛关注。然而, 根据本文构建的放射孢子虫和黏孢子虫系统发育树, 放射孢子虫的集合类群和黏孢子虫各属间没有呈现清晰的对应关系。如与碘泡属(Myxobolus)的黏孢子虫存在对应关系的放射孢子虫类群有 Triactinomyxon、Aurantiactinomyxon、Raabeia、Hexactinomyxon等。因此,从放射孢子虫形态特征去推断其归属于某个黏孢子虫属种类没有规律可循。放射孢子虫的鉴定需要通过传统的实验室感染或DNA分子序列分析。实验室感染通常耗时较长, 而分子鉴定较为快速、便捷和准确。

