宫颈不典型腺细胞18例液基细胞学观察
杨川林,胡佐鸿
(1.四川省邛崃市医疗中心医院病理科,四川 邛崃 611530;2.成都市第一人民医院病理科,四川 成都610041)
宫颈腺癌的发病率及其在宫颈癌中所占的比例逐年上升,且有年轻化趋势。与宫颈鳞癌相比,腺癌的预后较差[1]。近年来,由于液基细胞学的普及与宫颈刷采样器的使用,更多的宫颈管及子宫下端的腺体细胞出现在了液基涂片中[2,3]。但宫颈腺上皮病变的筛查并非宫颈细胞学的优势,发现腺上皮病变的敏感度受到取样和判读双重因素的制约[4],尤其是其中的不典型腺细胞(atypical glandular cells,AGC)是对宫颈癌筛查细胞学工作者的挑战,因为AGC较意义不明确的不典型鳞状上皮细胞(atypical squamous cells of undetermined significance,ASC-US)少见,且正确识别难度较大,但其中恰恰又存在比ASC-US更多的高级别的癌前病变与癌。宫颈细胞学鳞状上皮病变国内文献报道很多,而宫颈腺上皮病变国内文献报道较少,本研究应用2001年子宫颈细胞学 Bethesda报告系统(the Bethesda system,TBS)[5]对成都市第一人民医院病理科判读为AGC的液基涂片进行回顾观察并与组织学对照,分析其诊断要点、鉴别诊断及诊断中的陷阱。
1 资料与方法
1.1 一般资料 回顾成都市第一人民医院病理科2013年1月至2014年1月参照2001-TBS判读为AGC并有组织学诊断的病例18例,其中3例为外院送检标本。18例中,年龄26~71岁,平均年龄43岁。其中<40岁6例,占33%;≥40岁12例,占67%。
1.2 临床症状 6例无明显临床症状,为体检病例;12例有临床症状,主要为下腹疼痛、白带增多、同房出血、功血、绝经后出血。妇科检查多为宫颈炎、宫颈糜烂、宫颈息肉、宫颈赘生物、老年萎缩、卵巢包块等。
1.3 方法 所有涂片均由两位病理科医生重新阅片分析。液基标本采用北京华叶液基细胞保存液,按说明书操作,巴氏染色,光镜观察;组织学标本来源包括宫颈活检、宫颈管搔刮、利普刀、诊刮、子宫全切、输卵管卵巢切除。标本甲醛固定,石蜡包埋,切片,HE染色,光镜观察。1例液基标本作了免疫细胞化学检查,选用P16,CEA,所用抗体购自Dako公司,EnVison法染色。方法用剩余液基标本重新涂白片,风干后95%酒精固定30分钟,操作与免疫组化脱蜡至水后的步骤相同。
2 结果
2.1 宫颈AGC与组织学检查结果对照 如表1所示,18例中AGC,非特异(atypical glandular cells,not otherwise specified,AGC-NOS)检出9 例(50%);AGC,子宫内膜腺起源(atypical glandular cells,endometrial origin,AGC-EM)检出 2 例(11%);AGC,倾向 瘤 变 (atypical glandular cells,favor neoplastic,AGC-FN)检出7例(39%)。其中,组织学良性8例(44%);癌前病变及癌10例(56%)。
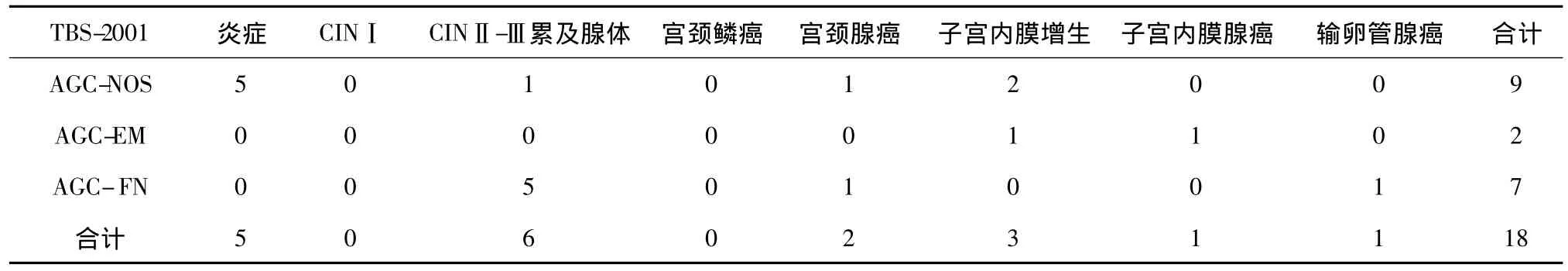
表1 宫颈AGC与组织学检查结果对照 (n)
2.2 镜检 9例AGC-NOS主要表现为成簇的细胞团,细胞拥挤,染色质轻度增加,中心细胞看不清,边缘细胞核较深染,大小较一致(图1a)。2例AGC-EM中1例表现较大细胞团,三维立体感较强,细胞拥挤,数量少;另一例为细胞小团,数量少,核增大,泡状核,染色质较粗糙,可见核仁,宫内膜活检示子宫内膜腺癌(图1b)。7例AGC-FN可见细胞聚集成团,数量较多,部分呈现三维结构,边缘圆钝,局部可见羽毛状边缘(图1c),部分核深染,部分泡状核,可见核仁,其中1例伴有不典型鳞状上皮细胞(图1d)。
2.3 免疫表型 1例液基标本诊断AGC-FN,羽毛状边缘显著,背景干净(如图1c),怀疑腺原位癌,用剩余标本做了免疫细胞化学检查,涂片中非典型腺细胞团 p16(+)、CEA(-)。
3 讨论
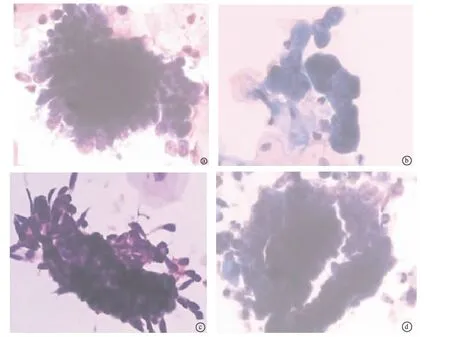
图1 宫颈AGC镜检结果 a:AGC-NOS;b:AGC-EM;c:AGC-FN;d:AGC-FN
3.1 TBS不典型腺细胞演变 1988-TBS[6]提出了“意义不明确的不典型腺上皮细胞”(atypical glandular cells of undetermined significance,AGUS)这一术语作为异常腺上皮的一个亚型,并要求进一步区分是源于宫颈腺或是子宫内膜腺,如果不能区分则归为非特异。1991-TBS[7]对此作了部分修订,即AGC的起源不确定,就使用AGUS;如果能够区分是源于宫颈腺的,要求区分进一步是倾向于反应性还是肿瘤性;而不典型的子宫内膜腺不再区分。2001-TBS[5]对此又作了加大修订,由于考虑AGC不认为是肿瘤的前期病变,只是危险性升高,故取消了AGUS这一术语,以免与ASC-US这一术语混淆,而后者是倾向于肿瘤的前期病变的。取而代之的是AGC。AGC要求尽可能区分来源,如果不能区分,使用广义的AGC。不能区分来源,却要尽可能区分是否AGC-FN,如果不能区分,则使用AGC-NOS。AGC如果能够区分是源于宫颈腺,则尽可能区分是否倾向肿瘤,不能区分,使用“非特异”术语。不典型子宫内膜腺细胞,不再区分是否倾向肿瘤。1991-TBS中“不典型腺,倾向反应性”术语在 2001-TBS中取消。2001-TBS在异常腺上皮细胞分类中把腺原位癌独立出来作为一个判读术语;在1991-TBS中,腺原位癌包括在中AGUS中。
3.2 宫颈AGC的病理特点与临床 与鳞状上皮病变ASC-US不同,腺上皮病变AGC的检出低,这是AGC的一个特点。本组病例 AGC的检出率为0.18%,与国内陆晓青报道的0.14%相符[8]。AGC的另一个特点是其中包含更多的癌前病变及癌[9],本组病例CIN及腺癌占56%,也证实了这一点。
从本组的资料来看,AGC的判读主要是通过细胞核有异型的三维腺样细胞团做出的,我们没有过多的区分其起源是宫颈腺还是子宫内膜,而使用广义的AGC-NOS。这一方面是由于这种区分的不确定性,另一方面也有利于临床妇科医生作更广泛的组织学活检,以免漏诊。但AGC我们尽量判读是否倾向肿瘤AGC-FN,AGC-NOS与AGC-FN主要细胞形态学差异在于后者细胞核的异型性更加明显及数量更多,这提示临床应该更加警惕,因为在AGC的亚型中,文献报道AGC-FN较AGC-NOS预示更高的潜在恶性风险[10],本组病例AGC-FN与AGC-NOS各检出宫颈腺癌1例,但前者检出另外5例高级别的CIN及一例输卵管腺癌。2例 AGC作出了倾向子宫内膜起源AGC-EM,其依据主要是AGC团的数量少及结合其临床伴有的功血。
根据meta-analysis,在判读为AGC的病例中,子宫内膜癌仍是最常见的恶性肿瘤,紧随其后的是宫颈腺癌、宫颈鳞癌、卵巢癌、输卵管癌[10]。本组资料较少,发现子宫内膜癌1例,宫颈腺癌2例,输卵管癌1例,与其结论基本一致。可见,值得注意的是从AGC中继而发现了癌的妇女中,其原发灶并不局限于女性下生殖道,甚至包括盆腔及远处器官的恶性肿瘤如膀胱、直肠、乳腺都可能与宫颈细胞学的AGC相关[10]。因此,临床妇科医生面对一个AGC的细胞学报告,尤其是当宫颈、子宫内膜活检阴性时,思维应该更广泛。
3.3 宫颈AGC的鉴别诊断 AGC的鉴别诊断包括良性、癌前及恶性病变。与AGC相关的良性病变有慢性宫颈炎、子宫内膜异位、鳞状化生、输卵管化生、微腺体增生、子宫下端取材、妊娠、锥切术后、宫颈息肉等;与AGC相关的癌前及恶性病变有CIN、CIN累腺、宫颈腺原位癌、子宫内膜复杂性增生、宫颈癌、子宫内膜癌,输卵管癌、卵巢癌及转移癌。
从本组的资料来分析,在鉴别诊断中应该注意的也正是是良性的子宫内膜及CIN累腺。在液基标本中,子宫内膜细胞的细节(如核仁、染色质等)较传统涂片更明显,脱落的良性或增生子宫内膜呈现较大的三维结构,中心细胞拥挤看不清,边缘可以呈现羽毛状,核可能稍大,核染色质清楚,这些都可能令人担忧而判读为AGC-NOS[11];但与活检证实的子宫内膜腺癌的AGC相比,后者细胞数量少,多为小细胞团,核膜增厚,核增大更明显,核仁更大更清楚(如图1b)。鳞状上皮病变是AGC判读中另一个值得重视的问题,在AGC随访的活检中,CIN及CIN累及腺体占了相当的比例,如国内石慧[12]的50例AGC结果分析,活检阳性病例中鳞状上皮病变几乎占了全部。从术语上理解,AGC提示的是宫颈腺上皮的问题,但随诊的活检中却发现不少其实是鳞状上皮的问题,这是由于组织学上明显的鳞状上皮病变在细胞学上却具有貌似腺上皮病变的特征。但并不能因此就否定AGC判读的价值,因为它毕竟在随后的活检中发现了更多的癌前病变或癌。鳞状上皮病变细胞成团可以表现为三维结构,尤其是当累及宫颈腺体时,边缘圆钝,也可以见到羽毛状边缘,呈现腺原位癌的特征(如图1c),这时容易被判读为腺上皮的问题。但CIN累及腺体的中心结构的排列方式凌乱,缺乏腺上皮病变有序的极向特征[13],另外,核的特点也有助于鉴别[4],因为鳞状上皮细胞的染色质较深染(如图1c),而不像腺上皮病变那样呈颗粒状,核仁清晰(如图1d)。值得一提的是AGC中伴随不典型鳞状上皮细胞并不能提示AGC可能是起源于鳞状上皮内病变,因为宫颈腺原位癌及腺癌常伴随鳞状上皮内病变,并且总是高级别的[4],如图四病例。
综上所述,宫颈AGC少见,识别难度较大,且宫颈AGC含有较多的高级别的癌前病变及癌,来自鳞状上皮内病变及良性病变的如增生子宫内膜细胞等可以呈现非典型腺细胞的特征。
[1]吴蓉宜,刘莉,赵剑萍.宫颈腺癌22例临床病理分析[J].实用医院临床杂志,2012,9(3):95-97.
[2]Babkowski RC,Wilbur DC,Rutkowski M,et al.The effects of endocervical canal topography,tubal metaplasia,and high canal sampling on the cytologic presentation of nonneoplastic endocervical cells[J].Am J Clin Pathol,1996,105:403-410.
[3]De Peralta-Venturino MN,Purslow MJ,Kini SR.Endometrial Cells of the“lower uterine segment”(LUS)in cervical smears obtained by endocervical brushings:A source of potential diagnostic pitfall[J].Diagnostic Cytopathology,1995,12(2):263-271.
[4]Solomon D,Nayar R.子宫颈细胞学Bethesda报告系统.黄受芳,张长淮,余小蒙译[M].第2版.北京:人民军医出版社,2009:120-151.
[5]Solomon D,Davey D,Kurman R,et al.The 2001 Bethesda System:Terminology for reporting results of cervical cytology[J].JAMA,2002,287(16):2114-2119.
[6]National Cancer Institute Workshop:The 1988 Bethesda System for reporting cervical/vaginal cytological diagnoses[J].JAMA,1989,262(7):931-934.
[7]National Cancer Institute Workshop:The 1991 Bethesda System for reporting cervical/vaginal cytologic diagnoses[J].Diagnostic Cytopathology,1993,9(2):235-246.
[8]陆小青,余新春,陈洁瑛,等.52例宫颈腺上皮病变细胞病理学分析[J].肿瘤学杂志,2010,16(5):416-417.
[9]Kim SS,Suh DS,Kim KH,et al.Clinicopathological significance of atypical glandular cells on Pap smearcolpos[J].Obstet Gynecol Sci,2013,56(2):76-83.
[10]Frey MK,Gupta D.Evaluation of Women With Atypical Glandular Cells on Cervical Cytology[J].The Female Patient,2011,36(9):23-29.
[11]Risse EKJ,Ouwerkerk-Noordam E,Boon ME.Endometrial cells in liquid-based cervical cytology:a diagnostic pitfall solved by preparing cytohistology from the residual thin layer sample[J].Acta Cytologica,2011:55(7):327-333.
[12]石慧,吴玉璘,林宁,等.50例非典型腺细胞病理结果分析[J].现代生物学进展,2011,11(24):5093-5094.
[13]Selvaggi SM.Cytologic features of high-grade squamous intraepithelial lesions involving endocervical glands on ThinPrep cytology[J].Diagnostic Cytopathology,2002,26(3):181-185.

