辣根过氧化物酶酶学特性及应用进展
张丽华,蒋俊峰
(山西大同大学化学与环境工程学院,山西大同037009)
辣根过氧化物酶酶学特性及应用进展
张丽华,蒋俊峰
(山西大同大学化学与环境工程学院,山西大同037009)
辣根过氧化物酶(HRP)是一种以亚铁血红素为氧化还原中心的过氧化物酶,从植物辣根的根部提取,目前被广泛地应用在污水处理、食品工业、有机合成和分析检测等领域。本文综述了辣根过氧化物酶的结构、固定化及辣根过氧化物酶在各个领域的应用,并对其工业应用前景及未来研究方向进行了探讨。
辣根过氧化物酶;固定化;辣根
辣根(十字花科)是一种耐寒的常年生草本植物,主要分布在世界温带地区,它的根具有很好的烹饪价值。辣根的根部也是过氧化物酶的丰富来源,至少含有30多种HRP同功酶形式,其中HRP同功酶C(HRP-C)含量最丰富,因此统称为辣根过氧化物酶(horseradish peroxidase,HRP)。辣根过氧化物酶也是一种利用过氧化氢可以氧化大多数有机物和无机物的血红素酶。由于其比活性高、耐热性高、酸碱稳定性好,对污染物浓度和盐度都有较高的耐受性,与抗原或抗体偶联后,活性损失很少,因此被广泛用于污水处理、食品工业、有机合成和分析检测等领域。本文介绍了HRP的结构、固定化及其在各个领域中的应用,并对其应用前景进行展望。
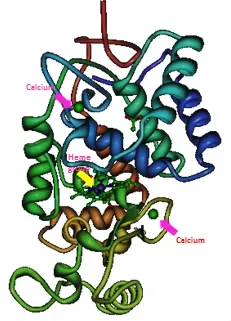
图1 HRP C的结构
1 辣根过氧化物酶的结构
1976年,Welinder等[1]人首次确定了HRP-C是一组单亚基糖蛋白,包含308个氨基酸残基和8个糖链,每分子HRP-C中有2分子Ca2+、1分子血红素辅基和4对二硫键,相对分子质量约为44 000。根据其等电点至少可将HRP分为5类[2-3]:酸性(HRPA)含糖量较高,pI值约为4;中性或微碱性(HRPB,-C)含糖量低,pI值在5.75~9.63范围内;强碱性(HRP-D,-E)含糖量较低,pI值在10.6~>12范围内。1990年Smith等[4]最早成功研制出重组酶,而且对HRP-C的结构和功能研究有了重大的进展。1997年,Gajhede等[5]人通过X射线晶体学解出了HRP的三维结构,2002年贝里隆德等[6]人描述出酶催化循环的高分辨率中间体。HRP-C含有2种不同类型的金属中心,铁(III)原卟啉IX(通常被称为“血红素”)和2个钙原子(图1,2)。
对于酶的结构和功能完整性这两者都是非常必要的。血红素基通过组氨酸侧链Na原子和血红素铁原子之间的配位键连接到酶His170(近端组氨酸残基)上。第二轴向配体位置(在所谓的血红素平面前端)没被酶的静息状态占据而是被酶转化期间的过氧化氢占据(图3)。小分子如一氧化碳、氰化物、氟化物、叠氮化物结合到远端六配体过氧化物酶复合物的血红素铁原子上。只有在质子化的形式下,一些键才是稳定的,这是通过氢键与远端血红素Arg38(远端精氨酸)和His42(远端组氨酸)的氨基酸侧链之间的相互作用。2个钙原子的结合位点分别位于血红素平面的远端和近端,并且通过氢键被连接到血红素结合区。每个钙原子结合位点都是七配位的,去和氧供体配体配位,氧供体配体是由氨基酸侧链的羧酸盐(ASP)、羟基(丝氨酸,苏氨酸)、羰基和结构水分子(只有远端)的结合点提供的。1978年,Haschke和Friedhoff[7]发现了钙的失去直接导致了酶活性的减少和酶热稳定性的降低,2001年,豪斯等[8]人并进一步发现了血红素环境光谱发生了微妙的变化。
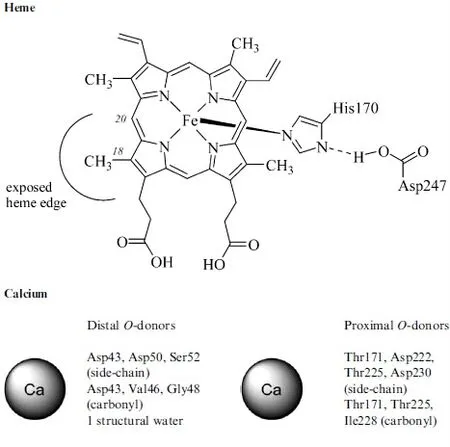
图2 HRP C的重要结构特征
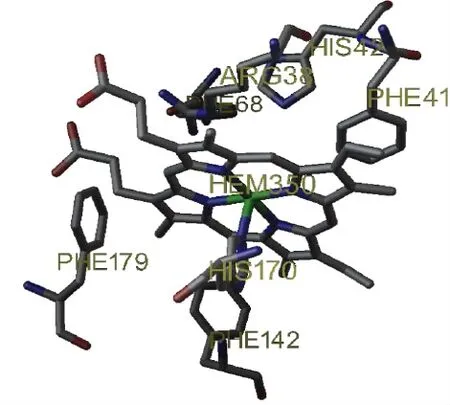
图3 HRP C活性中心的重要氨基酸残基
2 辣根过氧化物酶的固定化
与游离酶相比,固定化酶既保持了高度催化性和严格的专一性,反应条件温和,又克服了游离酶的许多不足,同时呈现出稳定性好、易分离回收、可重复利用、操作可控、工艺简化、成本降低等一系列优点。近年来,固定化HRP被广泛应用于环境水污染的治理与净化,可有效除去水介质中的多种有机污染物。为寻求稳定性好、比活性高的HRP固定化载体及方法,各国学者作出许多努力[9-11]。
2012年雷青娟等[12]研究小组利用接枝聚合技术,制得了阴离子型双功能复合载体SHBS-PGMA∕SiO2,并通过静电相互作用将HRP共价固定在载体SHBS-PGMA∕SiO2上,研究了固定过程的作用机理。结果表明,在pH值较大范围内,复合载体SH⁃BS-PGMA∕SiO2表面呈现出高密度负电荷,pH为6.0时,HRP带正电荷,与载体间会产生强烈的静电作用,明显促进了HRP的固定化;当载体表面SHBS的键合率约为18%时,促进作用最强,且固化酶的偶联率和比活力最高。离子强度对酶的固定化也有一定的影响,如加入NaCl会对载体与固酶蛋白间的静电作用产生一定的屏蔽作用,且增大NaCl浓度可降低固定化HRP的偶联率和比活力。
2011年雷青娟等[13]研究小组利用接枝聚合法和环氧基团的开环反应,制备了双功能型复合载体EDA-PGMA∕SiO2,又通过共价偶联法与HRP进行固定。研究显示,在水介质中,复合载体表面胺基的质子化,使载体微粒的ζ电位在较大的pH范围内保持正值;当介质pH=8.5,大于HRP的pI值时,强静电作用会大大促进HRP的固定;EDA的键合率为30%时,静电作用最强,固酶的偶联率与比活力都达到最高值。疏水作用也会影响化学法固定HRP,当以接枝微粒PGMA∕SiO2为载体时,增大NaCl浓度,一方面可促进酶蛋白与载体间的疏水作用,另一方面使固定化酶的偶联率与比活力有所提高。
2010年,Qiu等[14]研究小组利用氮气吸附技术,制备了纳米级多孔铜(NPC),通过扫描电子显微镜表征出孔径在100~200 nm之间,HRP通过吸附法固定在纳米级多孔铜上。与游离酶相比,固定化酶的热稳定性有了很大的提高,是由于酶分子和纳米级多孔铜表面之间存在多个吸附点。结果表明,经过2 h 50℃温育,固定化HRP保留约90%的初始活性,而游离酶只有约10%的初始活性。HRP和多孔铜表面间的相互作用使得固定化酶的Km从0.43增加到0.80 mmol∕L,同时也使得固定化酶的Kcat从8.1×103min-1下降到2.2×103min-1。基于NPC电极良好的导电性和电催化性,也制成了邻苯二胺(OPD)的电化学生物传感器。生物传感器的校准曲线是0.5~14.5 μmol∕L的OPD范围内,灵敏度为0.37 A∕mol·L。实验测得生物传感器的稳定性和重现性也是非常好的。当工作电压为-0.45 V,时间为200 s时,对10 μmol∕LOPD的电流响应仍有其初始值的80%。用5个HRP固载多孔铜电极,对10 μmol∕L OPD电流响应的相对标准偏差(RSD)约为4.5%。所有结果表明,用纳米级多孔铜作为HRP的固定化载体,由于其价格低廉的特点非常有助于其大规模应用。
3 辣根过氧化物酶的应用
3.1 污水处理
大部分疏水性芳香族化合物对人类都是有害的[15],而含酚废水又是当今世界危害最大的工业废水之一,因此,废水的处理与净化将是全世界学者面临的难题与挑战。Klibanov等人最早采用过氧化物酶去除废水中的酚类和芳香胺类化合物,并将其用于含酚废水的脱色[16]。2006年Einollahi等人用HRP作解毒剂除去了废水中的苯酚[17]。在过氧化氢存在下,HRP催化羟基酚,使其成为不稳定的状态,并产生苯氧自由基。这些自由基通过氧化自偶联促进酚类化合物的聚合[18]。而聚合苯酚(聚酚)不再是一种有毒化合物,成为不溶解的沉淀或是一种无毒的天然有机物[19]。
2012年,鲍腾等[20]研究小组采用凹凸棒石粘土、可溶性淀粉和工业水玻璃等基本材料,制备了改性后的凹凸棒石基多孔材料。将此多孔材料进一步固定辣根过氧化物酶,应用于含酚废水的处理研究,并取得了良好的效果。结果表明,辣根过氧化物酶的最佳固定化条件为pH=5、固定化时间为15 h、单位酶载量为1 mg。固定化酶循环使用6次后,苯酚去除率仍能达到62.3%。
2011年,Li等[21]对辣根过氧化物酶氧化降解废水中的双酚A进行了研究。降解最佳条件:pH= 9.0,T=25°C。理论上要使双酚A完全转化[H2O2]∕[BPA]物质的量比为0.5,但实际数据显示[H2O2]∕[BPA]物质的量比为1.5。一种可能的解释是,这是该降解产物,双酚A在氧化过程中所形成的,如4-异丙烯基苯酚,它进一步被过氧化氢氧化,使得总的过氧化氢的消耗量增大。而反应刚开始过氧化氢会使HRP失活,这会降低双酚A的氧化速度。刚开始3 h,反应速度非常快,几乎80%的双酚A被降解,反应 5 h后 HRP的活性仅剩初始活性的13.1%。
3.2 食品工业
酶制剂属于食品添加剂的一种,由于酶本身无毒、无嗅、且反应所需温度和pH温和,所以添加酶不会影响食品的安全性和食品质量;由于酶具有高效性和严格的专一性,少量酶也能使反应快速进行,也可避免复杂反应中的一些化学变化;加热可使酶失活,反应终点非常易控制;因此近年来酶制剂已应用于食品的解毒、保鲜、检测和代替溴酸钾等领域。
2011年,温研等[22]人利用HRP和阿魏酸处理牛乳,并制得了凝固型酸奶。结果表明,添加HRP、阿魏酸和明胶不影响酸奶的主要成分,但明显改善凝固型酸奶的品质。与对照样相比,加入明胶、HRP和阿魏酸后,酸奶硬度和黏度都有所提高,而乳清析出率都有所降低。同时,酸奶的表观黏度、触变性和粘弹性也都有所增加,添加明胶效果最明显。
2011年,马超越等[23]人以电子媒介体聚中性红为载体,将其固定HRP制成了生物传感器,并采用循环伏安法对其性能进行了研究。结果表明,HRP在该电极上会进行稳定的直接电子转移反应,H2O2浓度在3.18×10-8~3.18×10-3mol∕L的范围内,传感器具有良好的线性相关性,检出限达到6.36×10-9mol∕L。将该生物传感器用于啤酒中H2O2的测定,效果很好,回收率达到88.5%~98.6%。
2011年,展海军等[24]研究小组利用循环伏安法,在玻碳电极表面聚合一层均匀的聚苯胺膜,制备了纳米TiO2固定化HRP的生物传感器。结果表明,该传感器对H2O2和NaNO2都具有很好的电催化还原性。且成功地应用于火腿肠中NaNO2的测定,回收率为94%~103%。结果证明该生物传感器灵敏度高,有良好的抗干扰性和稳定性,也有良好的线性相关性,其相关系数为0.994 6,检出限为0.001 mg∕L。
3.3 有机合成
利用酶催化聚合取代传统的化学催化或物理反应,可以简化工艺、节省设备、降低危险和减少污染等。酶催化的显著特点是高效、专一、温和,聚合过程绿色环保、副产物较少、产物易分离、聚合物分子量大,所以酶催化在有机合成中受到各国学者的广泛关注[25]。HRP在氧化剂过氧化氢存在下,能催化酚及芳香胺类物质聚合[26-27]。由于这些聚合物存在大TT共轭体系,因此可作为复合型导电聚合物材料、非线性光学特性材料、可制作发光二极管等,并用于大屏幕全色显示等领域[28-30]。
2010年曾家豫等[31]研究小组以H2O2为氧化剂,采用HRP催化对苯二胺并与对氨基苯磺酸共聚,合成了聚对苯二胺一对氨基苯磺酸(PAn-I)。结果表明,合成的PAn—I具有电活性、热稳定性和良好的水溶性等优点。聚合过程中以水为介质,避免了有机溶剂的使用,使得反应条件温和,从而减少了酶的用量。
2012年,Zhang等[32]以十二烷基苯磺酸钠(SD⁃ BS)为表面活性剂,在水相胶束体系中利用HRP催化聚合酚。研究显示,加入SDBS会大幅度提高聚合物的产率。随着SDBS用量的增加,由GPC测定的THF可溶部分的分子量由1 100增大至2 000。在较宽的pH值(4~10)范围内,酚在水相胶束体系中聚合都维持了较高的收率。由于HRP在缓冲液SDBS中的活性是非常高,所以酚在水相胶束体系中聚合只在2 h内就能以很高的收率完成。所得到的聚合物是一种粉末材料,它可以部分溶解于DMF,DMSO和THF中。IR分析表明,该聚合物结构含有亚苯基和含氧亚苯基(oxyphenylene)单元的混合物。用TG分析时,发现聚合物具有较高的热稳定性。
3.4 分析检测
生物传感器最早源于20世纪60年代,到80年代生物传感器研究领域已基本形成,而研究最早应用最多的生物传感器是酶电极,因其具有设备简单、成本低廉、灵敏度高等特点。辣根过氧化物酶是一种研究广泛的过氧化物酶,将其固定在电极表面,在电子受体过氧化氢的作用下氧化反应物,被氧化的反应物在电极上电化学还原,其还原电流与反应物的浓度成正比。因此,HRP修饰电极被广泛用于H2O2、酚类、有机过氧化物、芳香胺化合物以及一些环境污染物的分析检测中。
2010年,韩莉等[33]利用循环伏安法和电流时间法,在玻碳电极表面聚合一层均匀的聚乙烯醇缩丁醛∕碳纳米管膜,制备了固定化HRP的生物传感器。结果表明该传感器对H2O2具有良好的电催化性能。当pH=7.0,工作电位为-250 mV,对苯二酚浓度为4.2 mmol∕L,H2O2浓度在1.67×10-7~1.29 ×10-5mol∕L和1.58×10-5~1.17×10-3mol∕L范围时,与生物传感器的电流响应呈良好的线性关系,检出限(S/N=3)为5.554×10-8mol∕L。因此该传感器具有制作简单、成本低廉、稳定性好等优点,且对HO有快速灵敏的响应。
2014年,Koposova等[34]研究小组首次以H2O2为氧化剂,将合成的油胺(OA)与HRP自组装形成的极薄金纳米线(NWS)和纳米颗粒(纳米颗粒)生物电化学传感。用OANWs和OANPs改性的薄膜金电极具有良好的催化性,当H2O2工作浓度范围从20 μmol∕L到500μmol∕L时,具有0.031 AM−1cm−2(RSD 0.046)和0.027 AM−1cm−2(RSD 0.045)的敏感性,5μmol∕L和8μmol∕L的检出限,(RSD附近的检出限为9%~12%)。研究显示,本研究小组制备基于酶的生物电化学传感器,对于金属蛋白生物电子学和能源研究具有重大的意义。
4 前景与展望
近年来,随着生物技术领域的迅猛发展,酶工程在工业应用中起着愈来愈重要的作用。对于辣根过氧化物酶的研究与应用约有100多年的历史,特别是现代仪器和检测手段的应用极大地推动了我们对HRP的结构与催化机制的了解,进而对HRP在许多领域的应用具有重大指导意义。由于HRP价格低廉、来源丰富、提纯工艺简单和结构熟知,该酶一直为工具酶研究的热点之一。关于HRP的理论应用报道非常多,但真正应用到实际工业中却少之又少,那么现阶段对于HRP的研究主要集中在:第一,通过先进的仪器和检测手段大规模的提取更高纯度的HRP;第二,通过不断优化实验条件,将小型实验室的理论条件扩大规模应用于实际工业中;第三,尝试更多的新型载体固定HRP,减少酶活损失的同时能最大限度保持原酶的活性,以更大程度适应工业环境。
[1]Welinder K G.Covalent structure of the glycoprotein horseradish peroxidase[J].FEBS Lett,1976,72:19-23.
[2]Everse J.Peroxidase in Chemistry and Biology[J].Boca Raton:CRC Press Inc,1991,1-2:2-24.
[3]Bartonek-Roxa E,Eriksson H.Expression of a neutral horseradish peroxidase in Escherichia coli[J].J B iotechnol,1994,37:133-142.
[4]Smith A T,Santama N,Dacey S,et al.Expression of a synthetic gene for horseradish peroxidase C in Escherichia coli and folding and activation of the recombinant enzyme with Ca2+and heme[J].J Biol Chem,1990,265:13335-13343.
[5]M Gajhede,D J Schuller,A Henriksen,et al.Crystal structure of horseradish peroxidase C at 2.15angstrom resolution[J].Nature Struct Biol,1997,4:1032-1038.
[6]Berglund G I,Carlsson G H,Smith A T,et al.The catalytic pathway of horseradish peroxidase at high resolution[J].Nature,2002, 417:463-468.
[7]Haschke R H,Friedhoff J M.Calcium-related properties of horseradish peroxidase[J].Biochem Biophys Res Commun,1978,80: 1039-1042.
[8]Howes B D,Feis A,Raimondi L,et al.The critical role of the proximal calcium ion in the structural properties of horseradish peroxi⁃dase[J].J Bio Chem,2001,276,40704-40711.
[9]Zhang F,Zheng B,Zhang J L,et al.Horseradish Peroxidase Immobilized on Graphene Oxide:Physical Properties and Applications in Phenolic Compound Removal[J].J Phys Chem C,2010,114:8469-8473.
[10]Bayramo G,Arıca M Y.Enzymatic Removal of Phenol and p-Chlorophenol in Enzyme Reactor:Horseradish Peroxidase Immobi⁃lized on Magnetic Beads[J].J Hazard Mater,2008,156(1∕3):148-155.
[11]Dalal S,Gupta M N.Treatment of Phenolic Wastewater by Horseradish Peroxidase Immobilized by Bioaffinity Layering[J].Chemo⁃sphere,2007,67(4):741−747.
[12]雷青娟,高保娇,张正国.阴离子型双功能含环氧基团酶固定化载体的制备及其固定辣根过氧化酶[J].2012,12(5):828-833.
[13]雷青娟,高保娇,张正国.次价键力在化学键合法固定辣根过氧化酶过程中的作用机理[J].物理化学学报,2011,27(11), 2697-2704.
[14]Qiu H J,Lu L,Huang X R,et al.Immobilization of Horseradish Peroxidase on Nanoporous Copper and Its Potential Applications [J].Bioresour Technol,2010,101(24):9415−9420.
[15]Wagner M,Nicell J A.Detoxification of phenolic solutions with horseradish peroxidase and hydrogen peroxide[J].Water Res, 2002,36:4041-4052.
[16]Klibanov A M.Enzymatic removal of toxic phenols and anilines form wastewaters[J].J Applied Biochemistry,1980,2:414-421.
[17]Einollahi N,Abbasi S,Dashti N,et al.Effect of mercuric chloride on kinetic properties of horseradish peroxidase[J].J Publ Health Iran,2006,35:49-56.
[18]Gomez J L,Bodalo A,Gomez E,et al.Immobilization of peroxidases on glass beads:An improved alternative for phenol removal [J].Enzyme Microb Tech,2006,39:1016-1022.
[19]Zhang H X,Taylor K E.Products of oxidative coupling of phenol by horseradich peroxidase[J].Chemosphere,1994,28:1807-1817.
[20]鲍腾,彭书传,陈冬,等.凹凸棒石粘土固定辣根过氧化物酶处理含酚废水[J].环境工程学报,2012,6(9):3179-3185.
[21]Li H M,Nicell J A.Optimal conditions for oxidative degradation of bisphenol A by Horseradish Peroxidase in aqueous phase [J].Multimedia Technology,2011,26-28:5442-5446.
[22]温研,赵新淮.牛乳的过氧化物酶处理与凝固型酸奶品质的变化[J].食品与发酵工业,2011,2:41-45.
[23]马超越,展海军,赵亚.聚中性红辣根过氧化物酶传感器测定啤酒中的过氧化氢[J].食品科技,2011,4:266-268.
[24]展海军,马超越,白静.固定化辣根过氧化物酶生物传感器测定火腿肠中亚硝酸盐[J].食品研究与开发,2011,32(2):123-125.
[25]许海燕,徐梁华.聚对苯二胺的酶促合成及其结构性能初探[J].高分子材料科学与工程,1995,4:127-129.
[26]刘晓辉,刘伟.酚类聚合物在水相胶束中的酶促合成[J].功能高分子学报,1995,3:308-314.
[27]许海燕,徐梁华.过氧化物酶催化酚聚合的研究[J].功能高分子学报,1995,3:355-359.
[28]胡龙兴.固定化酶催化氧化去除水溶液中酚的研究[J].环境科学,1996,3:57-60.
[29]邱龙辉,黄开勋,李良智,等.微乳液中酶催化木素—酚共聚物的性能研究[J].青岛化工学院学报,2001,22(2):101-103.
[30]张彤,赵庆祥.辣根过氧化物酶处理酚和氯酚的催化特性研究[J].环境科学,1998,3(19):25-29.
[31]曾家豫,周思彤,廖世奇,等.梁琼辣根过氧化物酶催化水溶性聚对苯二胺-对氨基苯磺酸的合成及表征[J].化学通报,2010,1:44-50.
[32]Zhang L,Zhao W S,Ma Z L,et al.Enzymatic polymerization of phenol catalyzed by horseradish peroxidase in aqueous micelle sys⁃tem[J].European Polymer J,2012,48(3):580-585.
[33]韩莉,陶菡,张义明.辣根过氧化物酶∕聚乙烯醇缩丁醛∕碳纳米管修饰玻碳电极检测过氧化氢[J].中国食品添加剂,2010, 2:225-228.
[34]Koposova E,Liu X,Kisner A,et al.Bioelectrochemical systems with oleylamine-stabilized gold nanostructures and horseradish peroxidase for hydrogen peroxide sensor[J].Biosensors and Bioelectronics,2014,57:54-58.
Applications Advance and Characterization of Horseradish Peroxidase(HRP)
ZHANG Li-hua,JIANG Jun-feng
(School of Chemistry and Chemical Engineering,Shanxi Datong University,Datong Shanxi,037009)
Horseradish peroxidase(HRP)is a peroxidase with heme-containing enzyme for redox-center,which isolated from horseradish roots.In recent years,HRP could be applied for wastewater treatment and food industry,organic synthesis as well as chemi⁃luminescent assays.The structure,immobilization and application of horseradish peroxidase were introduced significantly.The present problems and the future advance in the industry of HRP were reviewed.
horseradish peroxidase;immobilization;horseradish root
Q554+.6,X703
A
1674-0874(2014)04-0030-05
2014-02-15
张丽华(1981-),女,山西大同人,在读硕士,实验师,研究方向:生物无机酶化学,酶的固定化及其应用。
〔责任编辑 杨德兵〕

