外源GSH对NaCl胁迫下番茄幼苗生长及AsA-GSH循环的影响
刘会芳,何晓玲,马展,徐巍,刘苗苗,刘慧英
(石河子大学农学院园艺系,石河子 832003)
目前,土壤次生盐渍化是当前设施农业生产面临的严峻问题,盐胁迫已成为限制作物生长和产量最严重的环境因子之一[1]。而番茄作为设施栽培的主要蔬菜种类之一,市场需求量大,却面临着盐胁迫导致的产量下降和品质衰减等诸多问题[2]。因此,开展盐胁迫对番茄的影响和耐盐机理的研究具有十分重要的科学和现实意义。
GSH是植物中含量丰富的低分子肽,是机体内非常重要的水溶性抗氧化物质,在抗氧化和对氧化还原(redox)敏感的信号传导的调节中起着关键性作用[3]。GSH水平的高低和存在的氧化或还原形式对各种生物和非生物环境胁迫的忍耐密切相关[4]。许多研究已证明外源GSH参与了植物对逆境的应答。GSH能够缓解自毒作用下辣椒的生长抑制[5],缓解盐胁迫下水稻叶片叶绿体的膜脂过氧化水平[6],提高盐胁迫下二色补血草的活性氧清除能力[7],并能够通过改善低温胁迫下枇杷幼果叶绿体中AsAGSH循环提高自由基的清除能力[8]。AsA-GSH循环是植物清除ROS的酶促催化系统,在植物抵抗氧化胁迫、清除逆境ROS积累方面具有重要作用[9]。
目前,对于NaCl胁迫下番茄幼苗的AsA-GSH循环研究还未见报道,因此本试验以番茄为材料,拟通过NaCl胁迫下番茄幼苗叶片喷施GSH和GSSG和BSO,以探讨外源GSH对NaCl胁迫下番茄生长和AsA-GSH循环代谢的影响,旨在为GSH提高植物耐盐性提供理论依据。
1 材料与方法
1.1 材料
以番茄品种‘白果强丰’为试材。
1.2 方法
1.2.1试验设计
试验于2013年3月-6月在石河子大学农学院试验站进行。
种子催芽后播种于草炭:蛭石=1∶1(V/V)的基质中。待四叶一心,挑选形态长势整齐一致的番茄幼苗移入带泡沫盖板的12 L水桶中,装入10 L用去离子水配制的Hoagland营养液(pH=6.2)。待幼苗长至六叶一心时进行不同处理,其中氯化钠(100 mmol/L)于处理时直接加入营养液中,GSH、GSSG和BSO以叶片喷施的方式于每日9:00喷施。试验期间,每3 d调1次pH值至6.2,6 d更换1次营养液并全天通气。
试验处理分组。T1:CK,不喷施谷胱甘肽不加氯化钠和叶片喷施蒸馏水;T2:NaCl,100 mmol/L 氯化钠和叶面喷施蒸馏水;T3:NaCl+GSH,100 mmol/L氯 化 钠 和 叶 片 喷 施 5 mmol/L GSH;T4:NaCl+GSSG,100 mmol/L氯化钠和叶片喷施5 mmol/L GSSG;T5:NaCl+BSO,100 mmol/L 氯化钠和叶片喷施1 mmol/L BSO。
试验采取随机区组设计,每个处理重复3次,每个重复4株。取样时间为处理的第10天的同一时间。
1.2.2测定项目与方法
干重(DW)、鲜重(FW)测定:鲜样先用自来水冲洗2~3次,再用蒸馏水冲洗2次,用吸水纸吸干后称量鲜重,105℃杀青15 min,75℃烘干至恒重,称其干重(g)。
株高测定:用软尺测定茎基部到生长点的距离(cm)。
MDA含量测定:参照文献[10]中的方法。
H2O2含量测定:参照文献[11]中的方法。
SOD活性测定:参照文献[12]中的方法。
APX活性测定:参照文献[13]中的方法,并加以改进。
MDHAR活性的测定:参照文献[14]中的方法。
DHAR活力的测定:参照文献[15]中的方法。
GR活性的测定:参照文献[16]中的方法。
GSH、GSSG和GSH+GSSG的测定:参照文献[17]中的方法。
AsA和总AsA+DHA的测定:参照文献[18]中的方法。
1.2.3数据处理
采用Microsoft Excel和SPSS16.0对所得数据进行处理和差异显著性检验(Duncan′s法),显著性水平设定为α=0.05。
2 结果与分析
2.1 外源GSH对NaCl胁迫下番茄幼苗生长的影响
由表1可见:与对照(T1)相比,NaCl胁迫下番茄幼苗的干、鲜重和株高显著下降,说明NaCl处理显著抑制了番茄幼苗的生长。叶片喷施GSH后,NaCl胁迫下番茄幼苗的鲜、干重和株高较NaCl处理(T2)显著提高。喷施GSSG后,NaCl胁迫下番茄幼苗的株高较NaCl处理显著提高,但鲜、干重无显著变化。喷施BSO后,NaCl胁迫下番茄幼苗的鲜、干重和株高较NaCl处理都显著下降。这说明外源喷施GSH能够有效缓解了NaCl胁迫对番茄幼苗生长的抑制;外源喷施GSSG也在一定程度上缓解了NaCl胁迫对番茄幼苗生长抑制,但缓解效果不如喷施GSH处理的;而喷施BSO则进一步抑制了NaCl胁迫下番茄幼苗的生长。
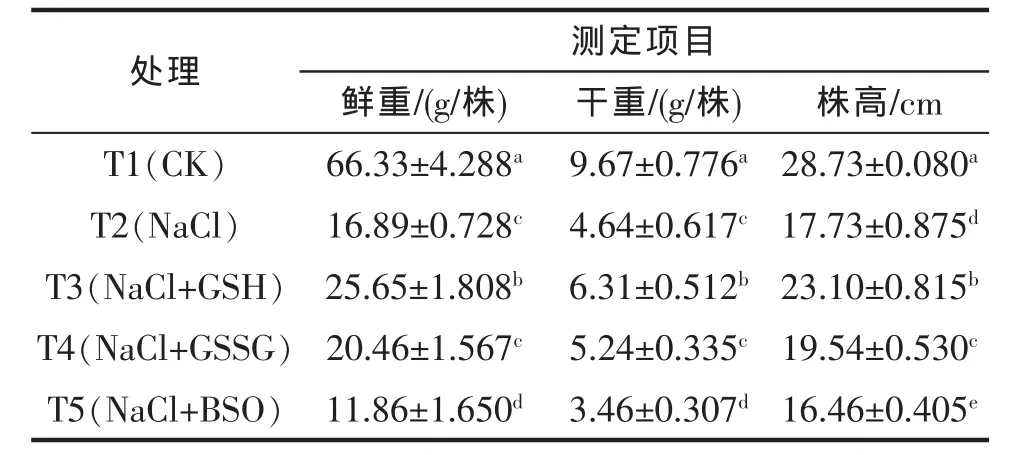
表1 外源GSH对NaCl胁迫下番茄幼苗FW、DW和株高的影响Tab.1 Effect of exogenous GSH on the FW,DW and plant height of tomato seedlings under salt stress
2.2 外源GSH对NaCl胁迫下番茄幼苗叶片H2O2和MDA含量的影响
结果如图1所示,由图1可见:与对照相比,NaCl胁迫下番茄幼苗叶片的H2O2和MDA含量显著提高。
NaCl胁迫下分别喷施GSH和GSSG后,番茄幼苗叶片的H2O2和MDA含量均不同程度的显著降低,其中NaCl+GSH处理的H2O2和MDA含量降幅最大,降至与对照无显著差异,但NaCl+GSSG处理的H2O2和MDA含量仍显著高于对照。喷施BSO则显著提高了NaCl胁迫下番茄幼苗叶片的H2O2和MDA含量。
这说明NaCl胁迫造成了番茄幼苗叶片H2O2积累和膜脂过氧化,而NaCl胁迫下通过喷施GSH和GSSG能够降低H2O2和MDA的含量,缓解由NaCl胁迫导致的番茄幼苗叶片的膜脂过氧化,但喷施GSSG的缓解效果不如喷施GSH的;而喷施BSO则加剧了NaCl胁迫下番茄幼苗叶片H2O2积累和膜脂过氧化水平。
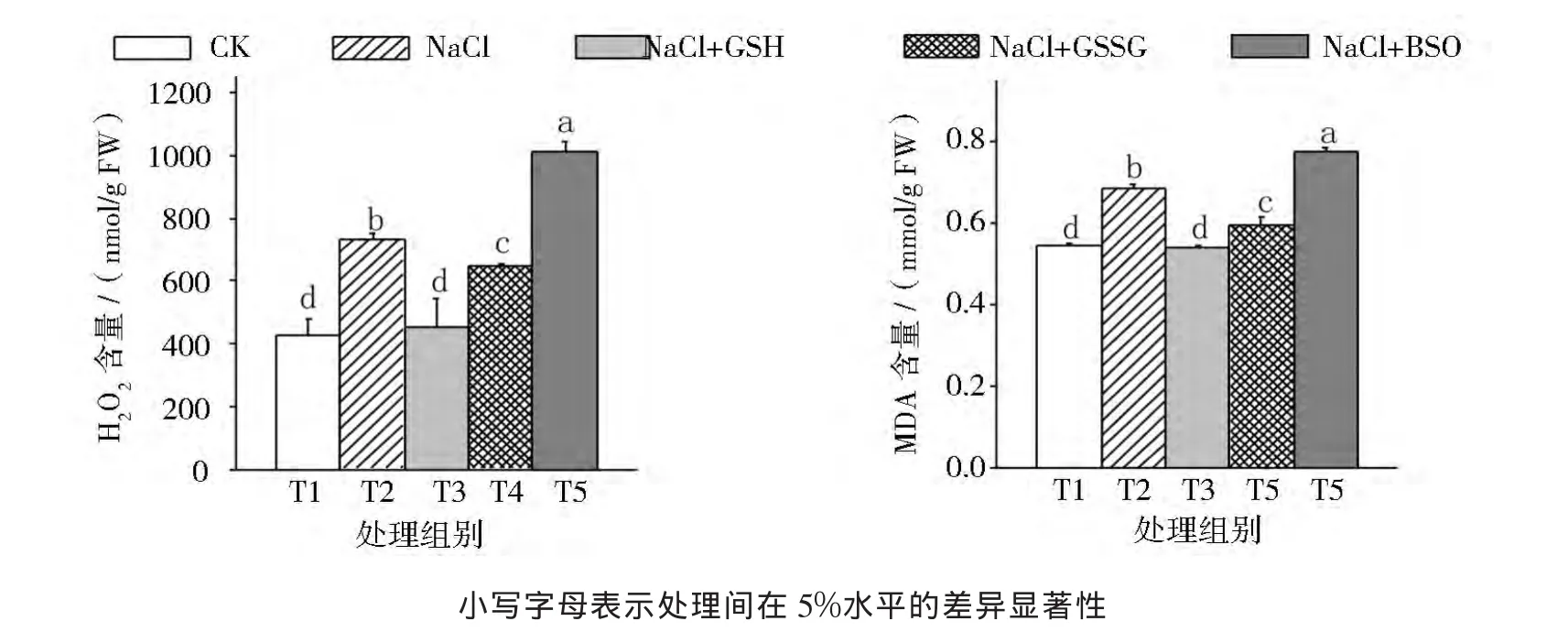
图1 外源GSH对NaCl胁迫下番茄幼苗H2O2和MDA含量的影响Fig.1 Effect of exogenous GSH on content of H2O2and MDA of tomato seeding under salt stress
2.3 外源GSH对NaCl胁迫下SOD和AsA-GSH循环关键酶活性的影响
由图2可见:与对照相比,NaCl胁迫下番茄幼苗叶片的SOD、APX、DAHR、MDHAR和GR活性均显著升高。
NaCl胁迫下,喷施GSH和GSSG的2个处理的番茄幼苗叶片的 SOD、APX、DAHR、MDHAR 和GR活性均进一步显著提高。喷施BSO则显著降低了NaCl胁迫下番茄幼苗叶片的SOD、GR、APX和MDHAR的活性,但对DHAR的活性无显著影响。
NaCl胁迫下外源喷施GSH、GSSG和BSO的3个处理相比,NaCl+GSH处理的番茄幼苗叶片的SOD、APX、DAHR、MDHAR 和 GR 活性均显著高于NaCl+GSSG和NaCl+BSO处理;NaCl+GSSG处理显著高于NaCl+BSO处理。
这说明NaCl胁迫处理下,番茄幼苗通过上调叶片中 SOD、APX、DAHR、MDHAR 和 GR 活性,对盐胁迫产生了适应性反应;外源GSH和GSSG的喷施进一步提高了NaCl胁迫下番茄幼苗叶片抗氧化酶活性,从而提高活性氧清除能力;外源BSO的喷施由于抑制了SOD、GR、APX和MDHAR的活性,活性氧清除能力降低。
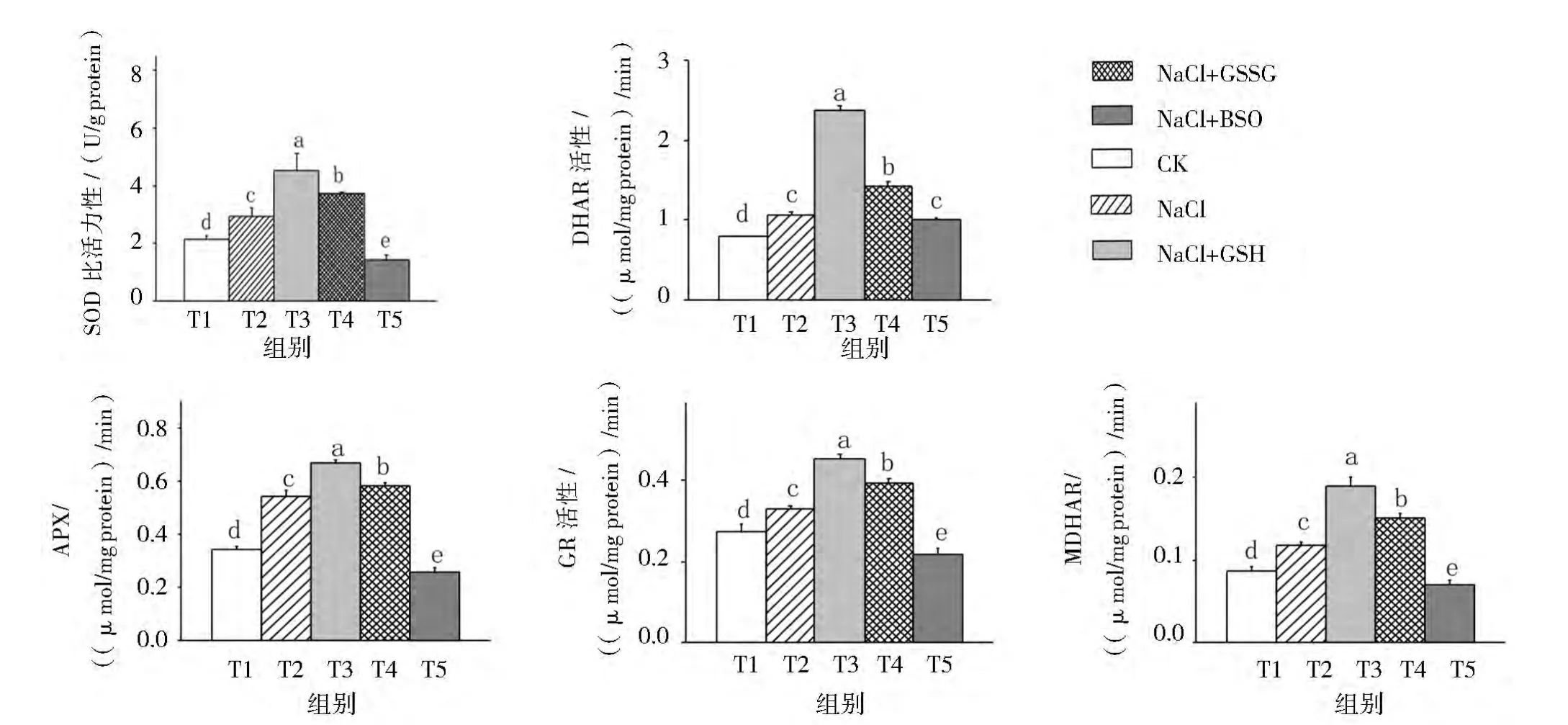
图2 外源GSH对NaCl胁迫下番茄幼苗叶片SOD、DHAR、APX、GR、MDHAR活性的影响Fig.2 Effect of exogenous GSH on activity of SOD,DHAR,APX,GR and MDHAR in leaves of tomato seedlings under salt stress
2.4 外源GSH对NaCl胁迫下番茄幼苗叶片 AsA、GSH 含 量 和 AsA/DHA、GSH/GSSG比值的影响
由图3可知:NaCl胁迫下番茄幼苗叶片的AsA、AsA+DHA 含量和 GSH/GSSG、AsA/DHA 比值显著下降,GSH和GSH+GSSG含量与对照无显著差异;外源喷施GSH后显著提高了NaCl胁迫下番茄幼苗叶片的 GSH、GSH+GSSG、AsA、AsA+DHA 含量和 GSH/GSSG、AsA/DHA比值,且 GSH和 GSH+GSSG含量和AsA/DHA比值显著高于对照。外源喷施GSSG显著提高了NaCl胁迫下番茄幼苗叶片的GSH、GSH+GSSG含量和AsA/DHA比值,但GSH/GSSG的比率显著降低,这主要是由于喷施外源GSSG诱导内源GSSG含量的增幅高于GSH含量的增幅,从而导致GSH/GSSG的比率下降;喷施BSO对NaCl胁迫下番茄幼苗叶片的GSH、GSH+GSSG含量和GSH/GSSG比值无显著影响,但显著降低了NaCl胁迫下番茄幼苗叶片的AsA、AsA+DHA含量和AsA/DHA比值。
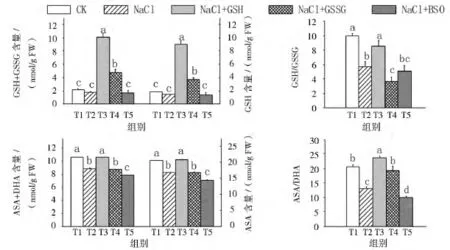
图3 外源GSH对NaCl胁迫下番茄幼苗叶片氧化还原状态的影响Fig.3 Effect of exogenous GSH on redox state in leaves of tomato seedlings under salt stress
此外,NaCl胁迫下喷施外源GSH的番茄幼苗叶片的GSH/GSSG和AsA/DHA比值显著高于NaCl+GSSG处理和NaCl+BSO 2个处理的,而NaCl+GSSG处理的GSH/GSSG比值显著高于NaCl+BSO处理,AsA/DHA与NaCl+BSO处理无显著差异。
以上结果表明,NaCl胁迫导致番茄幼苗叶片还原力水平降低。施用外源GSH可显著提高NaCl胁迫下番茄幼苗叶片中还原力的水平,外源施用BSO则加剧了NaCl胁迫下番茄幼苗叶片的还原力水平的降低。
3 讨论
(1)生长量是植物对盐胁迫的综合反映,盐胁迫严重影响植物的生长发育,造成植株的生物量积累减少[19]。
本实验结果表明,NaCl胁迫条件下番茄幼苗的生长受到显著抑制。喷施外源GSH可有效缓解胁迫对番茄幼苗生长的抑制作用,而喷施BSO则进一步抑制了NaCl胁迫下番茄幼苗的生长,这说明喷施GSH可促进盐胁迫下番茄幼苗的生长和提高盐适应性。此外,本实验中喷施GSSG亦一定程度缓解了NaCl胁迫下对番茄幼苗生长的抑制作用,但其缓解效果显著低于喷施GSH处理组。本实验喷施GSSG缓解NaCl胁迫抑制番茄幼苗生长的作用可能与其所诱导的内源GSSG含量及redox状态有关。
(2)盐胁迫下活性氧大量产生导致膜系统损伤是植物受害的普遍现象[20]。正常条件下,植物体内活性氧的产生与清除保持动态的平衡;盐胁迫时,由于细胞代谢受阻将产生大量的活性氧导致膜系统损伤和细胞伤害,加速细胞衰老和解体,从而影响植物生长[21]。MDA是膜脂过氧化的的终产物,所以细胞膜受伤害程度可用其含量的多少来衡量[22]。
本实验结果表明,NaCl胁迫下番茄幼苗叶片的MDA和H2O2含量增加,表明NaCl胁迫导致番茄叶片活性氧积累,膜脂过氧化加剧;而NaCl胁迫下喷施外源GSH和GSSG不同程度的降低了番茄幼苗叶片中MDA和H2O2的含量,缓解了活性氧诱发的膜脂过氧化程度,降低了活性氧含量,其中以外源GSH处理缓解程度较好。外源BSO的喷施则进一步提高了NaCl胁迫下番茄幼苗叶片中MDA和H2O2的含量,加剧了膜脂过氧化程度和氧化胁迫。
(3)植物在逆境胁迫下为防御过量活性氧的产生造成伤害,存在酶促和非酶促两类活性氧自由基清除系统,在维持膜的结构和完整性、防御活性氧自由基对膜脂的攻击伤害中发挥着重要作用[23]。在抗氧化酶系中,SOD构成了防御ROS的第一道防线,它催化 O2-歧化为 H2O2和 O2[24],而 AsA-GSH 循环是植物清除H2O2的重要机制[20]。在AsA-GSH循环中,APX,MDAR,DHAR 和 GR 是关键酶[20]。
SOD作为一种对环境胁迫的适应性防御机制[25],其活性在低温胁迫下提高[26],而在盐胁迫下的植物根系中SOD活性下降[27]。罗娅等[28]对低温胁迫下草莓叶片AsA-GSH循环酶系统的研究表明,APX、MDHAR和DHAR活性的增加有助于植物抗性的提高。
本实验中,NaCl胁迫下番茄叶片SOD活性上升,同时伴随着叶片H2O2含量的提高,这是其适应逆境反应的正常表现。同时,NaCl胁迫下番茄幼苗叶片的APX、GR、MDHAR和DHAR的活性亦显著升高,这可能是植株对NaCl胁迫下过量H2O2产生的应激反应;喷施GSH显著提高了NaCl胁迫下番茄幼苗叶片的SOD、APX、GR、MDHAR和DHAR活性,同时伴随着H2O2和MDA含量的显著降低,表明外源喷施GSH可提高盐胁迫下番茄幼苗叶片的H2O2清除能力,降低ROS造成的氧化胁迫伤害,华春等[6]在水稻上的研究也证明了这一点。
外源GSSG的喷施也可提高NaCl胁迫下番茄幼苗叶片APX、GR、MDHAR和DHAR活性,降低H2O2含量。本实验中,外源BSO的喷施并未对DHAR活性有太大影响,这可能是由于植物本身对逆境的防御机制,或是外源BSO的喷施并未对其产生影响,但降低了APX、GR和MDHAR活性,表明喷施BSO降低了番茄叶片清除活性氧的效率,加剧了NaCl胁迫下的活性氧伤害。
(4)GSH和AsA是2种重要的抗氧化剂[29]。通常认为AsA和GSH含量及AsA/DHA、GSH/GSSG比值的变化是植物响应盐胁迫最普遍的特征[20]。Chen等[30]认为土壤缓慢干旱和自然干旱以及盐渍生境均可导致小麦、芦苇等植物GSH和AsA代谢发生变化,而上调GSH和ASA代谢速率以及氧化还原循环能力可提高植物对干旱等逆境的抵抗,揭示细胞内较高的还原能力和还原状态参与了植物对干旱等逆境的响应。
本实验结果表明,NaCl胁迫下番茄幼苗叶片的AsA/DHA、GSH/GSSG比值显著下降,说明叶片内redox状态参与了番茄幼苗对NaCl胁迫信号的响应,表现为NaCl胁迫下番茄幼苗叶片氧化力提高,还原力降低,刘建新等[20]在多裂骆驼蓬幼苗叶片的研究也证明了这一点。
本实验中,外源GSH的喷施提高了NaCl胁迫下番茄幼苗叶片的内源 GSH、GSH+GSSG、AsA、AsA+DHA含量和AsA/DHA、GSH/GSSG比值,表明外源GSH的喷施提高了番茄叶片内还原力水平,使细胞redox平衡处于还原状态,从而有效缓解了NaCl胁迫下活性氧对植株造成的伤害。外源GSSG的喷施显著提高了AsA/DHA的比值,但由于外源GSSG处理诱导了叶片内源GSSG的大量积累,使叶片GSH/GSSG比值显著降低,因此叶片内H2O2含量的降低可能是由AsA清除。外源BSO的喷施显著降低了NaCl胁迫下番茄幼苗叶片的 AsA、AsA+DHA的含量和AsA/DHA比值,使得细胞redox平衡处于氧化状态,加剧了NaCl胁迫对番茄幼苗的活性氧伤害。
4 结论
(1)外源喷施GSH通过诱导NaCl胁迫下番茄幼苗叶片SOD、AsA-GSH循环关键酶活性和还原库力水平提高,使细胞redox平衡处于还原状态,有效清除了NaCl胁迫产生的H2O2,缓解了膜脂过氧化水平的加剧,促进了NaCl胁迫下番茄植株的生长。
(2)外源喷施GSSG虽降低了GSH/GSSG比值,但通过上调AsA/DHA比值和SOD、AsA-GSH循环关键酶活性,一定程度缓解了NaCl胁迫对番茄幼苗生长的抑制作用。
(3)外源喷施BSO通过降低NaCl胁迫下番茄幼苗叶片还原库力水平和 SOD、APX、GR和MDHAR活性,使得活性氧清除能力下降,加剧了膜脂过氧化程度,进一步抑制了NaCl胁迫下番茄植株的生长。
[1]薛继澄,毕德义,李家金,等.保护地栽培蔬菜生理障碍的土壤因子与对策[J].土壤肥料,1994(1):4-9.
[2]Zhu J K.Genetic analysis of plant salt tolerance using arabidopsis[J].Plant Physiology,2000,124(3):941-948.
[3]May M J,Vernoux T,Leaver C,et al.Glutathione homeostasis in plant:Implications for environmental sensing and plant development[J].J Exp Bot,1998,49:649-667.
[4]Mates J M,Pe R G,Mez Z C,et al.Glutathione and its relationship with intracel-lular redox status,oxidative stress and cell proliferation/death[J].The International Journal of Biochemistry&Cell Biology,2002,34:439-458.
[5]马彦霞.自毒作用下外源谷胱甘肽(GSH)对辣椒幼苗生理生化特性的影响[D].兰州:甘肃农业大学,2009.
[6]华春,王仁雷,刘友良.外源GSH对盐胁迫下水稻叶绿体活性氧清除系统的影响[J].植物生理与分子生物学学报,2003,29(5):415-420.
[7]鲁丽丽,刘耕,李君,等.外源GSH对NaCl胁迫下二色补血草盐害缓冲机理的研究[J].山东师范大学学报:自然科学版,2006,21(2):108-111.
[8]吴锦城,陈建琴,梁杰,等.外源一氧化氮对低温胁迫下枇杷叶片AsA-GSH循环的影响[J].应用生态学报,2009,20(6):1395-1400.
[9]李晓云,王秀峰,吕东福,等.外源NO对铜胁迫下番茄幼苗根系抗坏血酸-谷胱甘肽循环的影响[J].应用生态学报,2013,24(4):1023-1030.
[10]Draper H H,Hadley M.Malondialdehyde determination as index of lipid peroxidation[J].Method Enzymol,1990,186:421-431.
[11]Patterson B D,Macrae E A,Ferguson I B.Estimation of hydrogen peroxidein plantsextractsusingtitanium(IV)[J].Annals of Biochem,1984,134:487-492.
[12]Rao K V M,Sresty T V S.Antioxidant parameters in the seedlings of pigeon pea(Cajanus cajan L.Millspaugh)in response to Zn and Ni stresses[J].Plant Sci,2000,157:113-128.
[13]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbatespecific peroxidase in spinach chlorop lasts[J].Plant Cell Physiology,1981,22:867-880.
[14]Miyake C,Asada K.Thylakoid bound ascorbate peroxidase in spinach chloroplasts and photoreduction of its primary oxidation product of monodehydroascorbate radicals in thylakoids[J].Plant Cell Physiology,1992,33:541-553.
[15]Hossain M A,Asada K.Purification of dehydroascorbate reductase from sp inach and its characterization as a thiol enzyme[J].Plant Cell Physiology,1984,25(1):85-92.
[16]FoyerC H,HalliwellB.Presence ofglutathione and glutathione reductase in chlorop-lasts:a proposed role on ascorbic acid metabolism[J].Planta,1976,133:21-25.
[17]Griffiths O W.Determination of glutathione and glutathione disulphide using glutathione reductase and 2-vinylpyridine[J].Anal Biochem,1980,106:207-212.
[18]Law M Y,CharlesS A,HalliwellB.Glutathione and ascorbic acid and spinach(Spinacea oleracea)chlorop-lasts:the effect of hydrogen peroxide and paraquat[J].J Biochem,1983,210:899-903.
[19]罗庆云,焚丙军,刘友良.大豆苗期耐盐性鉴定指标的检验[J].大豆科学,2001,20(3):177-182.
[20]刘建新,王鑫,李博萍.外源一氧化氮供体对NaCl胁迫下多裂骆驼蓬幼苗叶片AsA-GSH循环的影响[J].植物研究,2010,30(1):37-41.
[21]Sreenivasulu N,Grimm B,Wobus U,et al.Differential response of antioxidants to salinity stress in salttolerant and salt-sensitive seedlings of foxtailmillet(Setaria italica)[J].Physiol Plant,2000,109:435-442.
[22]张静会,齐永顺,陈崇,等.低温对燕山板栗枝条生理生化特性的影响研究[J].中国农学通报,2012,28(16):65-68.
[23]Demiral T,Turkan I L.Comparative lipid peroxidation,antioxidant defense systems andproline content in roots oftwo rice cultivarsdiffering in salttolerance[J].Environ Exp Bot,2005,53:247-257.
[24]孙维敏,施子晗,张根发.超氧化物歧化酶研究进展[J].现代农业学报,2013,2(1):1-12.
[25]Lee D H,Lee C B.Chilling stress-induced changes of antioxidant enzymes in the leaves of cucumber:in gel enzyme activity assays[J].Plant Sci,2000,159,75-85.
[26]Liang Y C,Chen Q,Liu Q,et al.Exogenous silicon(Si)increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley(Hordeum vulgare L.)[J].Plant Physiol,2003,160,1157-1164.
[27]Azevedo Neto A D,Prisco J T,Eneas Filho J,et al.Effect of salt stress on antioxidative enzymes and lipid peroxidation in leaves and roots of salt-tolerant and salt-sensitive maize genotypes[J].Environ Exp Bot,2006,56:87-94.
[28]罗娅,汤浩茹,张勇.低温胁迫对草莓叶片SOD和AsAGSH循环酶系统的影响[J].园艺学报,2007,34(6):1405-1410.
[29]Noctor G,Foyer C H.Ascorbic and glutathione keeping active oxygen under control[J].Plant Physiology,1998,49:249-279.
[30]Chen K M,Gong H J,Chen G C,et al.Up-regulation of glutathione metabolism and changesofredoxstatus involved in adaptation of reed (Phragmites communis)ecotypes to drought prone and saline habitats[J].Plant Physiol,2003,160:293-301.

