穿山龙提取物的纯化工艺研究△
刘斌,高文学,刁兴彬
(山东省泰安市食品药品检验检测中心,山东 泰安 271000)
中药工业
穿山龙提取物的纯化工艺研究△
刘斌,高文学*,刁兴彬
(山东省泰安市食品药品检验检测中心,山东 泰安 271000)
目的研究并建立穿山龙提取物的纯化工艺。方法以总皂苷和薯蓣皂苷综合评价为指标,利用大孔吸附树脂纯化穿山龙提取物。结果以生药质量浓度为1 g·mL-1的上柱液,通过D-101型大孔吸附树脂,依次用4 BV水,体积流量为1 BV·h-1,5 BV 65%乙醇,体积流量为2 BV·h-1洗脱,并收集65%乙醇洗脱流分,减压干燥,分离转移率平均分别为84.8%、84.2%。结论该方法稳定可行,能较好地纯化穿山龙提取物。
穿山龙提取物;总皂苷;薯蓣皂苷;纯化;大孔吸附树脂
穿山龙为薯蓣科植物穿龙薯蓣DioscoreanipponicaMakino的干燥根茎[1],是中国传统名药,也是“泰山四宝”之一。穿山龙中主要药效成分包括薯蓣皂苷、原薯蓣皂苷、伪原薯蓣皂苷、纤细薯蓣皂苷、穗菝葜甾苷及其苷元[2-3]。其中薯蓣皂苷可以合成200多种药物,为合成副肾皮质激素以及口服或注射用避孕药的主要原料,同时也是心脑血管系统药物合成的主要原料[4-5]。经过提取纯化的穿山龙提取物所含薯蓣皂苷含量较高,成分稳定,市场需求非常大,可以满足大生产的需要。本文以总皂苷及薯蓣皂苷为指标成分,对穿山龙提取物的提取纯化工艺进行系统研究[6-8],为穿山龙提取物标准的制定提供参考。
1 仪器与试药
1.1 仪器
Agilent 1260 Series高效液相色谱仪(Agilent 1200 四元泵,VWD检测器),Agilent Chemstation工作站;TU-1901双波束紫外可见分光光度计(北京普析);十万分之一电子天平(Mettler Toledo XS205)。
1.2 试药
薯蓣皂苷(中国食品药品检定研究院,批号:110717-200501)。甲醇、乙腈为色谱纯,其他试剂均为分析纯,水为纯化水。穿山龙采自泰山,经泰安市食品药品检验检测中心程艳华主任中药师鉴定为薯蓣科植物穿龙薯蓣DioscoreanipponicaMakino的根茎。
2 方法与结果
2.1 薯蓣皂苷的含量测定
2.1.1 色谱条件 采用HPLC法,以薯蓣皂苷含量计。采用ZORBAX SB-C18(250 mm×4.6 mm,5 μm)色谱柱,乙腈-水(55∶45)为流动相,测定波长为203 nm,流速为1.0 mL·min-1,柱温为30 ℃,进样量为10 μL。
2.1.2 薯蓣皂苷对照品溶液的制备 精密称取薯蓣皂苷对照品15.25 mg,置于50 mL容量瓶中,加甲醇制成含薯蓣皂苷305 μg·mL-1的对照品溶液。
2.1.3 穿山龙粗提物的制备 称取穿山龙粉末100 g,用10 BV 60%的乙醇回流提取3次,每次1 h,过滤残渣,合并滤液,减压干燥,制备成穿山龙乙醇粗提取物干膏,干燥保存。
2.1.4 供试品溶液的制备 精密称取2.1.3项下穿山龙粗提取物干膏1.00 g,置于200 mL容量瓶中,用65%乙醇溶解并定容至刻度。分别取对照品溶液和供试品溶液进样。色谱图见图1和图2。

1.薯蓣皂苷 图1 薯蓣皂苷对照品HPLC图
1.薯蓣皂苷 图2 穿山龙供试品HPLC图
2.2 穿山龙总皂苷的测定
2.2.1 对照品溶液的配制 取薯蓣皂苷对照品13.5 mg,精密称定,置25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀即得对照品储备溶液。精密量取对照品储备液5 mL,置25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得对照品溶液。
2.2.2 供试品溶液的配制 精密称取2.1.3项下干膏1.00 g,置于200 mL容量瓶中,用甲醇溶解并定容至刻度。
2.2.3 测定波长的选择 精密吸取对照品溶液和供试品溶液各2.0 mL,置具塞试管中,水浴挥干溶剂,精密加入高氯酸10 mL,于60 ℃水浴加热15 min,冰水终止反应,随行试剂作为空白溶液。分别在190~500 nm进行光谱扫描,薯蓣皂苷及穿山龙总皂苷的吸收曲线基本一致,且都在206 nm 处有最大吸收峰,空白溶液在该波长下无吸收,故选择206 nm为检测波长。紫外扫描图见图3和图4。
图3 薯蓣皂苷对照品紫外扫描图

图4 穿山龙供试品紫外扫描图
2.2.4 标准曲线的绘制 精密吸取对照品溶液0.5,1.0,2.0,3.0,4.0,5.0 mL,置具塞试管中,水浴挥干溶剂,精密加入高氯酸10 mL,于60 ℃水浴加热15 min,冰水终止反应,随行试剂作为空白溶液,在206 nm波长测定吸光度,以吸光度(Y)为纵坐标,质量浓度(X,μg·mL-1)为横坐标,绘制标准曲线。得到回归方程为Y=0.019 11X-0.045 3,r=0.999 4,线性范围为5.4~54.0 μg·mL-1。
2.3 树脂型号的筛选
采用平行试验,以总皂苷及薯蓣皂苷为指标成分,利用静态吸附,筛选文献中常用于分离皂苷类的不同型号的大孔树脂色谱柱。
2.3.1 比吸附量考察 将经过预处理的4种大孔树脂D-101、AB-8、HPD-600、HP-20去除表面水后各取5 g分别置于具塞磨口锥形瓶中,各精密加入样品溶液25 mL,置摇床中,振摇24 h,使树脂充分吸附,过滤,取续滤液进行含量测定,结果表明D101对于本品比吸附较好,见表1。计算公式:

(1)
式中:m1为吸附前溶液中成分质量(mg);m2为吸附后溶液中成分质量(mg);m为树脂重量(g)

表1 不同大孔树脂比吸附值考察
2.3.2 解吸率考察 将2.3.1项下样品置于具塞磨口锥形瓶中,精密加入50%乙醇100 mL,置摇床中,具塞振摇24 h,充分解吸附,过滤,取续滤液进行含量测定,结果表明4种树脂的解吸率相差不大,综合比较吸附值与解吸率的结果,D-101树脂有较好的吸附性及解吸率,作为本品的分离用树脂较理想。见表2。计算公式:

(2)
式中:m为树脂吸附的成分质量(mg);m3为解吸附后溶液中成分质量(mg)

表2 不同大孔树脂解吸率考察
2.4 上样药液浓度对吸附效果的影响
分别称取10 g树脂分装于同一型号树脂柱中,取1 mL相当于1 g生药的样品溶液,加水或浓缩配制成相当于原药液的0.25,0.5,1,2 BV的4种不同浓度的药液,依次精密量取5,10,20,40 mL的药液,上柱(体积小于柱体积的上样后静置2 h,体积大于柱体积的以流速为1 BV·h-1循环上样2 h),收集过柱液体置100 mL量瓶中,加65%乙醇定容至刻度,摇匀,进行含量测定并按公式(1)计算比吸附量。结果发现当药液每毫升相当于原药材量2 g时,浓度过大,色谱柱堵塞,溶液无法流下,需要频繁处理,因此上样时药液合理的浓度为每毫升相当于1 g生药量,即1 000 g穿山龙药材浓缩至1 000 mL即可。见表3。
2.5 上样药液体积流速的考察
分别称取10 g树脂分装于同一型号树脂柱中,精密量取样品溶液10 mL,分别以0.5,1,2,3 BV·h-1的流速吸附上柱,收集过柱后溶液,用65%定容至100 mL,测定含量并按公式(1)计算比吸附量。结果表明随体积流速的增大,树脂吸附量呈下降趋势;0.5,1 BV·h-1吸附量较大且结果相近,考虑到工作效率的问题,选择1 BV·h-1体积流速。见表4。

表3 上样药液浓度对吸附效果的影响考察
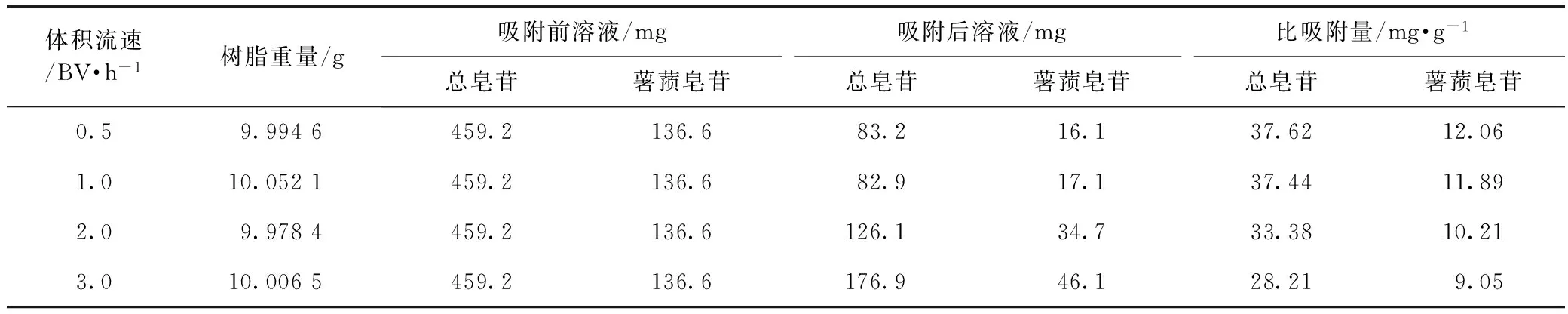
表4 上样药液体积流速的考察
2.6 径高比的考察
分别称取处理过的大孔树脂适量,置于同样型号树脂柱中,使径高比分别为1∶2、1∶4、1∶8、1∶12,依据树脂重量精密加入适量样品溶液,按1 BV·h-1体积流速吸附上样,收集过柱流出液,测定含量并按公式(1)计算比吸附量。结果表明不同的径高比对皂苷吸附量有一定的影响,当径高比在1∶2~1∶8时,吸附逐渐增大,继续增加径高比后无变化,因此采用径高比为1∶8。见表5。

表5 径高比考察
2.7 洗脱剂的考察
取大孔树脂10 g,湿法装柱(径高比为1∶8),经预处理后,取原药液8 mL,分别用水、25%乙醇、40%乙醇、65%乙醇、80%乙醇、95%乙醇各80 mL,以1 BV·h-1的体积流度梯度洗脱,前1倍柱体积洗脱液弃去,然后依次收集上述洗脱液,每次20 mL,分别测定总皂苷含量及洗脱液中固形物重量,1~4次为水;5~8次为25%乙醇;9~12次为40%乙醇;13~16次为65%乙醇;17~20次为80%乙醇;21~24次为95%乙醇。测定结果表明穿山龙总皂苷主要集中在25%~65%乙醇洗脱液中,占全部醇洗脱液中穿山龙总皂苷的89.1%,洗脱溶剂体积分数继续增大时皂苷洗脱变化不大;多数固形物存在于蒸馏水洗脱液中,这表明仅用水洗能够得到很好的除杂效果,所以洗脱溶剂确定为先用水除去大量水溶性杂质,再用65%乙醇洗脱,并收集65%乙醇洗脱流分。见表6。
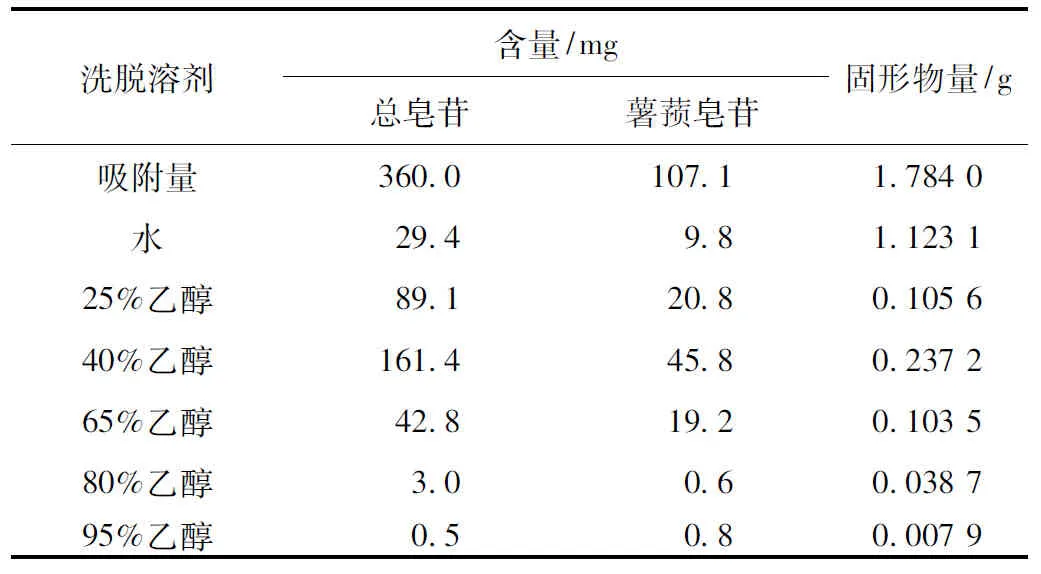
表6 洗脱剂的考察
2.8 洗脱剂用量考察
2.8.1 水洗脱用量考察 称取已处理过的树脂10 g,湿法装柱(径高比为1∶8),取原药液8 mL,上样,水洗流速为1 BV·h-1,收集上述洗脱液,1 BV收集1份,分别测定总皂苷含量及洗脱液中固形物量。结果表明水洗至5 BV时,流出液中所含固形物量己经很少了,当水洗体积为4 BV时水溶性杂质基本除去,且皂苷类成分损失不大,故确定水的洗脱用量为4 BV。见表7。
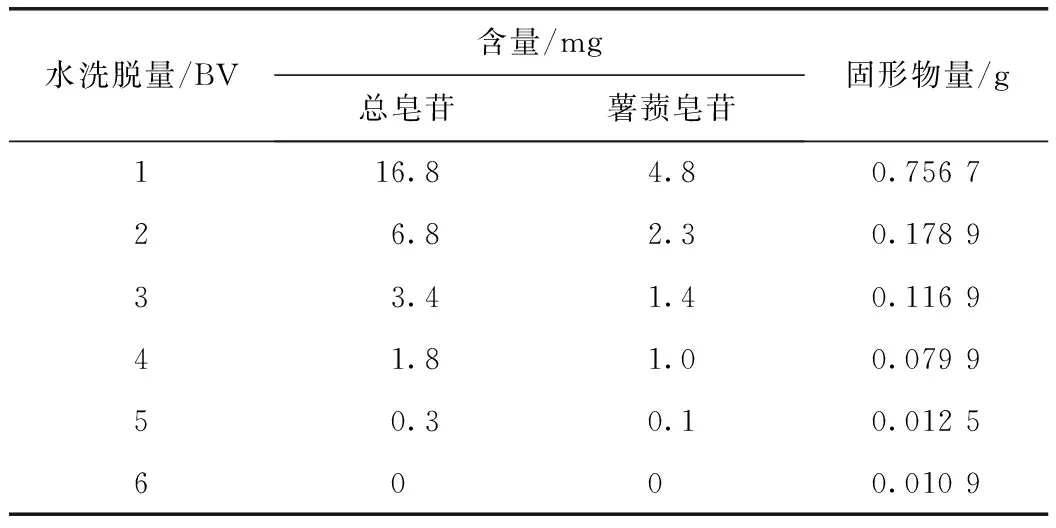
表7 水洗脱用量的考察
2.8.2 65%乙醇洗脱用量考察 称取已处理过的树脂10 g,湿法装柱(径高比为1∶8),移取原药液8 mL,上样,用4 BV水,采用1 BV·h-1冲洗,然后用65%乙醇洗脱,收集洗脱液,1 BV收集1份,分别测定总皂苷和薯蓣皂苷的含量。结果表明65%乙醇洗至6倍柱体积时,流出液中所含总皂苷及薯蓣皂苷的含量己经很少了,即5 BV时已经洗脱充分了,故确定65%乙醇的洗脱用量为5 BV。见表8。
2.9 洗脱流速的考察
称取已处理过的树脂10 g,湿法装柱(径高比为1∶8),取原药液8 mL,上样,用4 BV的水,采用1 BV·h-1冲洗,然后用5 BV的65%乙醇洗脱,采用不同体积流量冲洗,收集洗脱液,各定容至100 mL,分别测定总皂苷和薯蓣皂苷的含量。结果表明,随洗脱体积流量的增加,洗脱下来的皂苷量逐渐减少,分析是因为流速太快,洗脱液还未与皂苷充分接触,所以洗脱下来量少。1,2 BV·h-1体积流量洗脱下来皂苷量差不多,为提高工作效率,选择2 BV·h-1合适。见表9。

表8 65%乙醇洗脱用量的考察
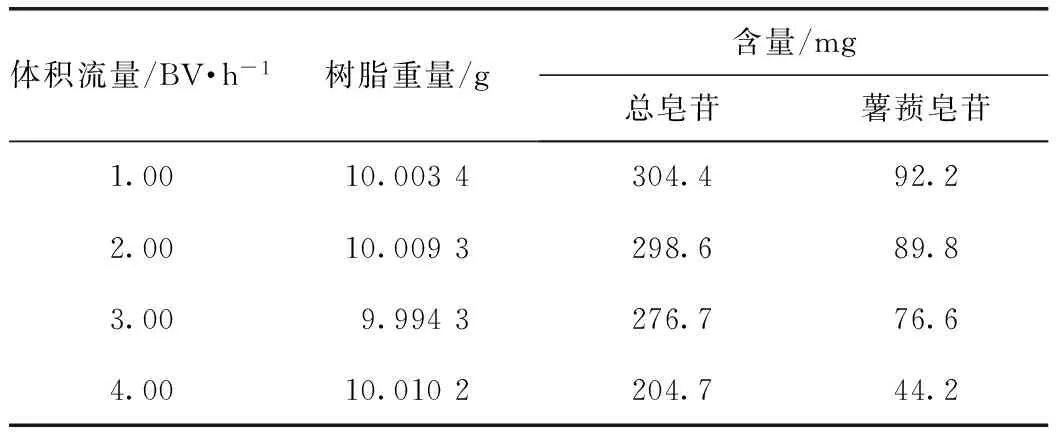
表9 体积流量的考察
2.10 验证实验
分别取处理过的大孔吸附树脂100 g,平行3份,分别吸取穿山龙生药质量浓度为1 g·mL-1的提取液80 mL,按照上述工艺依法上柱,依次洗脱后,减压干燥,分别测定提取液和洗脱液中总皂苷与薯蓣皂苷的总含量,并计算洗脱率。结果表明穿山龙提取物经过大孔树脂纯化后有效的降低了固形物的量,提高了总皂苷和薯蓣皂苷的含量,洗脱率平均分别为84.8%、84.2%,RSD分别为0.49%、0.65%,表明该工艺稳定,可行。见表10。

表10 穿山龙提取物纯化工艺验证实验
3 结果与讨论
试验以穿山龙中总皂苷和薯蓣皂苷为指标,对穿山龙提取物的纯化工艺进行研究,达到了较好的纯化效果,且工艺稳定可行。通过对大孔吸附树脂纯化穿山龙提取物工艺的研究,确定纯化工艺为采用D-101型大孔吸附树脂进行纯化,径高比为1∶8,上样药液生药质量浓度为1 g·mL-1,用4 BV纯化水,体积流量为1 BV·h-1,除去杂质,再用5 BV 65%乙醇,体积流量为2 BV·h-1洗脱。经验证实验结果表明,在该工艺下,总皂苷和薯蓣皂苷的分离洗脱率均达到80%以上。
中药成分复杂,可以通过现代中药提取纯化技术,制备中药提取物,提高有效成分的纯度。本研究根据穿山龙药材中总皂苷和薯蓣皂苷的理化性质及目前大生产的实际情况,采用D-101型大孔树脂纯化穿山龙提取物,使有效成分富集,且稳定性好,为今后穿山龙提取物的标准化建立和生产应用提供参考。
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:250.
[2] 李东翔,李清,关潇滢.HPLC法测定穿山龙中伪原薯蓣皂苷、薯蓣皂苷和延龄草苷的含量[J].药物分析杂志,2012,32(4):596-598.
[3] 秦兰艳,贾凌云,孙启时.RP-HPLC法同时测定穿山龙中薯蓣皂苷和纤细皂苷的含量[J].沈阳药科大学学报,2012,24(10):627-630.
[4] 仇华泉,苏酩,田景振.中药穿山龙治疗风湿病的研究进展[J].山东医药,2011,51(11):115-116.
[5] 柳全文,田景振,李民.穿山龙的成分、药理及临床应用研究概况[J].山东中医杂志,1998,17(1):29-31.
[6] 张园园,李静,潘激扬.穿山龙总皂苷的HPLC指纹图谱研究[J].中国药房,2012,23(27):2555-2557.
[7] 徐雄良,柯尊洪,张志荣.正交试验法优选穿山龙总皂苷的提取工艺[J].华西药学杂志,2003,18(2):95.
[8] 刘颖,刘树民,于栋华.大孔树脂纯化穿山龙总皂苷的工艺优化[J].医药导报,2011,30(5):635-637.
StudyonPurificationProcessofExtractsfromDioscoreanipponica
LIUBin,GAOWenxue*,DIAOXingbin
(TaianTestingCenterforFoodandDrugControl,Taian271000,China)
Objective:This study aimed to establish the best purification technique for the extraction process ofDioscoreanipponica.MethodsUse the total saponins and diosgenin comprehensive evalution as index,and to purify the extraction fromD.nipponicaby means of macroporous adsorption resin.ResultsThe results showed that after going through the D101 macroporous adsorption resin,eluting by means of 4BV water(1 BV·h-1),5BV 65% ethanol(2 BV·h-1),and collecting the dried 65% elute ethanol,the average separation of transfer rate is 84.8% and 84.2%.ConclusionThe process is proved reliable and stable to purify the astraction fromD.nipponica.
Dioscoreanipponicaextracts;Total saponins;Diosgenin;Purification;Macroporous adsorption resin
泰安市科技发展计划(20123080)
*
高文学,副主任药师,研究方向:药品检验;Tel:(0538)8334565
10.13313/j.issn.1673-4890.2014.07.012
2013-11-25)

