冷冻消融序贯化疗治疗晚期非小细胞肺癌的疗效观察
钱建新, 顾小强, 焦晓栋, 王 湛, 武 清
肺癌是世界上最常见的恶性肿瘤之一,发病率呈逐年上升趋势。非小细胞肺癌 (non-small cell lung cancer,NSCLC)占肺癌发病率总数的80%。目前NSCLC的治疗仍以手术为首选,然而,75%~80%患者就诊时就已经是局部进展或远处转移 (Ⅲb~Ⅳ期),失去根治性手术切除的机会[1],中位生存期仅为8~10个月,治疗以全身化疗及局部放疗为主要手段。尽管近20年来放、化疗取得了许多进展[2],但由于NSCLC对放化疗相对不敏感以及肿瘤细胞的多重耐药现象,尤其是晚期NSCLC患者局部肿瘤负荷大,疗效并不理想。氩氦刀冷冻消融是近年发展的一项肿瘤微创治疗技术[3],可快速毁损肿瘤组织,减轻肿瘤负荷。对晚期NSCLC患者应用氩氦刀冷冻消融治疗之后再通过全身化疗杀灭周围的亚临床病灶、转移灶、微转移灶,符合肺癌多学科治疗的原则[4]。本文通过回顾分析61例行氩氦刀冷冻消融序贯化疗以及同期52例单纯接受化疗的Ⅲb和Ⅳ期NSCLC患者的病例资料,探讨氩氦刀冷冻消融序贯化疗治疗晚期NSCLC的近期疗效和对远期生存的影响。
1 材料与方法
1.1 材料
1.1.1 病例资料 2005年3月—2008年3月我科收治61例晚期NSCLC行氩氦刀冷冻消融序贯化疗;同期52例单纯接受化疗的晚期NSCLC患者。均为病理组织学或细胞学确诊的初治或复治的NSCLC患者,经影像学分期为Ⅲb或Ⅳ期,Karnofsky评分≥70分。
1.1.2 器材和设备 氩氦刀冷冻治疗系统 (Cryo-HITTM,以色列Galil公司产品)。氩气为5 000 psi,氦气为2 000 psi(湖北省武汉江堤气体厂提供)。采用飞利浦公司的MX8000螺旋CT。自制CT导引下体外穿刺导向装置(简称CT穿刺架)。
1.2 方法
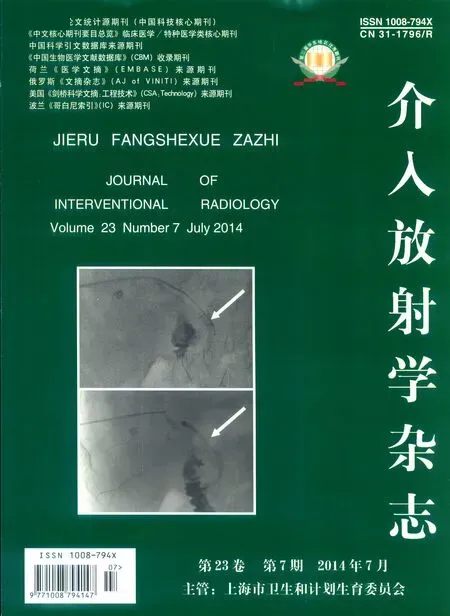
1.2.1 冷冻手术方法 术前检查血常规,肝、肾功能,凝血功能全套,血糖,肺功能,心电图等。术前30 min肌内注射地西泮5 mg,苯巴比妥0.1 g。所有患者均采用2%利多卡因20~40 ml局部浸润麻醉;采用CT穿刺架经皮穿刺冷冻。置入氩氦刀后,重复冻融2个循环,每次持续20 min。术中实时监测生命体征、冰球大小、有无气胸。术毕退刀后针道内填入止血生物胶,针道缝合。
术后至少平卧6 h,持续吸氧,床边心电监护,严密观察生命体证,观察有无发热、咯血、胸痛、呼吸困难、气胸发生。术后酌情使用止血剂、抗生素。1.2.2 化疗方案 化疗方案包括TP(紫杉醇175 mg/m2,d1,顺铂 75 mg/m2,d1)、NP(长春瑞滨 25 mg/m2,d1、8, 顺铂 75 mg/m2,d1)、GP (吉西他滨1 000 mg/m2,d1、8,顺铂 75 mg/m2,d1)一线化疗方案,以及 DP(多西紫杉醇 75 mg/m2,d1, 顺铂 75 mg/m2,d1)、PC(培美曲塞 500 mg/m2,d1,顺铂 75 mg/m2,d1)二线化疗方案。冷冻序贯化疗组患者在术后3周进行化疗,化疗为每21~28天为1个周期。
1.2.3 疗效评价
1.2.3.1 近期疗效评价:包括氩氦刀冷冻的止痛效果,冷冻对患者生活质量的影响;冷冻序贯化疗与单纯化疗患者肿瘤缓解率、临床获益率。
1.2.3.2 冷冻止痛效果:疼痛评估方法采用疼痛数字分级法(NRS):疼痛疗效评价标准:疼痛缓解度 =(治疗前NRS-治疗后NRS)/治疗前NRS,完全缓解(CR)为疼痛缓解100%;部分缓解(PR)为疼痛缓解 >50%;轻度缓解(MR)为疼痛缓解 <50%;无缓解(NR)为疼痛未缓解;有效率为CR+PR+MR。
1.2.3.3 冷冻对患者生活质量的影响:采用FACTG量表评估患者生活质量。FACT-G即Functional Assessment of Cancer Therapy-General,由美国芝加哥Rush-Pesbrylerian-St医学研究中心研制,用于测评肿瘤患者的生活质量。该量表共包括5部分,分别为身体状况 (PHY)、社交及家庭状况(SOC/FAM)、与医师关系(DOC)、情绪(EMO)、功能状况(FUNC),共28项。每项另有单独记分,生活质量的好与坏与各部分评分及总分有关。该表由患者自己填写。
1.2.3.4 肿瘤缓解评价:RECIST标准评价肿瘤缓解:缓解率为CR+PR,临床获益CR+PR+SD。冷冻结束后3周进行CT评估,化疗每2周期后进行疗效评价。
1.2.3.5 远期疗效评价:随访两组患者的中位生存时间和1年生存率。生存期为治疗开始至死亡或末次随访时间,随访截止时间2011年2月28日。
1.3 统计学方法
应用SPSS10.0统计软件分析。计数资料采用χ2检验,计量资料采用t检验,生存资料用Kaplan-Meier法,Log-rank检验判别生存率差异。P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料
2.1.1 61例氩氦刀冷冻消融序贯化疗组 61例,男42例,女19例;年龄 33~79岁,中位年龄62岁;腺癌33例,鳞癌25例,未分化癌2例,大细胞癌1例;周围型36例,中央型25例;Ⅲb期37例,Ⅳ期24例;肿瘤平均最大直径(4.7±1.8)cm。
2.1.2 单纯化疗组 共52例,其中男37例,女15例;年龄37~76岁,中位年龄57岁;腺癌35例,鳞癌17例;周围型23例,中央型29例;Ⅲb期19例,Ⅳ期33例;肿瘤平均最大直径(4.2±1.9)cm。两组在性别、年龄、病理分型、临床分型、临床分期、肿瘤大小、方面无显著性差异(P>0.05),具有可比性。
2.2 冷冻消融的不良反应和并发症
61例行氩氦刀消融患者,无一例手术死亡。一般术后反应较轻,恢复快。常见不良反应和并发症如下:气胸41.0%(25/61),其中23例在术中出现,2例在术后第2天出现,主要表现胸闷、气急,术中即给予置管抽气后缓解同时留置闭式引流,术后2例X线检查肺组织压缩 <30%,给予吸氧后自行缓解。咯血60.7%(37/61),表现为少量咯血或较术前稍增多,给予静脉滴注垂体后叶素1~3 d后消失。胸腔积液42.6%(26/61),本组8例术前即有积液,术后增多,其中5例出现大量胸腔积液,但抽液后均好转;其他18例为少量积液,2周后自行吸收。另外有寒战 21.3%(13/61)、心动过缓 14.8%(9/61)等,均为一过性,未予特殊处理。
2.3 近期疗效评价
2.3.1 冷冻消融前后疼痛变化 冷冻消融治疗61例晚期NSCLC患者中有26例伴有局部疼痛,23例周围型,3例中央型,均为肿瘤病灶压迫或直接侵犯胸壁、肋骨或脊柱,21例为中度疼痛,5例为重度疼痛。26例患者冷冻消融后当天9例疼痛消失,夜间睡眠无需药物止痛,11例疼痛减轻,总有效率为76.9%。由于瘤灶冷冻消融毁损后局部水肿及针道损伤,2例患者疼痛较前加重,1周后局部水肿消散及伤口愈合后疼痛缓解。2周后10例患者无需止痛治疗,13例患者疼痛较前减轻,止痛药剂量亦较前降低,有效率为88.5%(见表1)。

表1 癌痛患者冷冻止痛疗效 (n=26)
2.3.2 冷冻消融前后生活质量评分的改变 61例患者冷冻术后3周后生活质量FACT-G各维度均有不同程度的改善,其中 PHY、SOC/FAM、DOC、EMO、FUNC评分较冷冻前升高 19.4%、0.78%、2.2%、18.5%、7.8%。冷冻后患者生活质量QOL总评分较前升高10.4%(P<0.01),5个维度中有显著性差异有 PHY、EMO、FUNC (P < 0.01),SOC/FAM 和DOC维度则无显著差异(P>0.05)(见表2)。
2.3.3 两组肿瘤缓解评价 化疗2周期后增强CT评价情况(见表3)。氩氦刀冷冻消融序贯化疗组缓解率(34.4%)高于单纯化疗组(15.4%),临床获益率冷冻消融序贯化疗组 (82%)高于单纯化疗组(65.4%),两组间差异有统计学意义(P<0.01)。
表2 冷冻前后生活质量及其各维度评分变化 ,%)

表2 冷冻前后生活质量及其各维度评分变化 ,%)
时间 PHY SOC/FAM DOC EMO FUNC QOL冷冻前 14.53±5.41 19.05±4.35 6.34±1.71 15.05±4.59 13.44±4.79 68.40±13.96冷冻3 W后 17.35±4.07 19.20±3.73 6.48±1.49 17.84±3.63 14.49±4.30 75.52±11.53 t值 9.094 0.775 1.889 9.258 4.499 12.903 P<0.01 >0.05 >0.05 <0.01 <0.01 <0.01
2.4 远期随访和生存分析
随访截至于2011年2月28日。随访4~22个月。冷冻消融序贯化疗组与单纯化疗组的中位生存时间分别为12.9个月和9.5个月,1年生存率分别为53.6%和35.4%,两组间差异有统计学意义(P< 0.01)(见图1)。
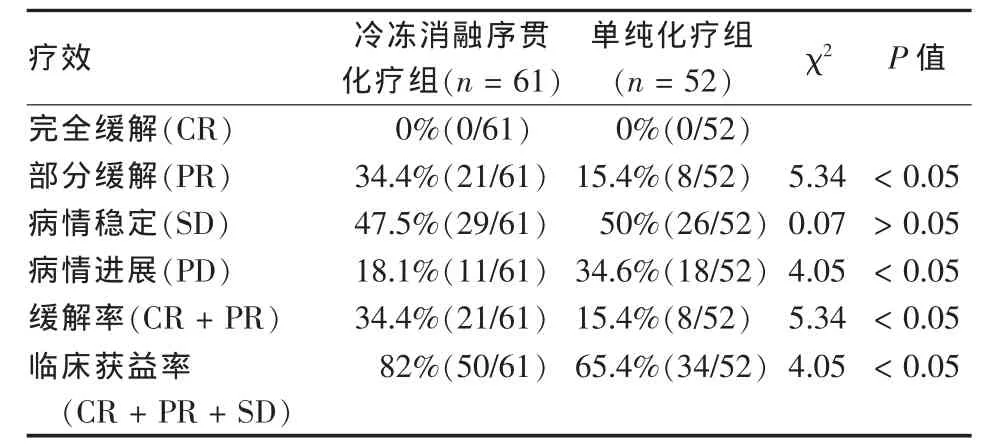
表3 化疗2周期后增强CT评价
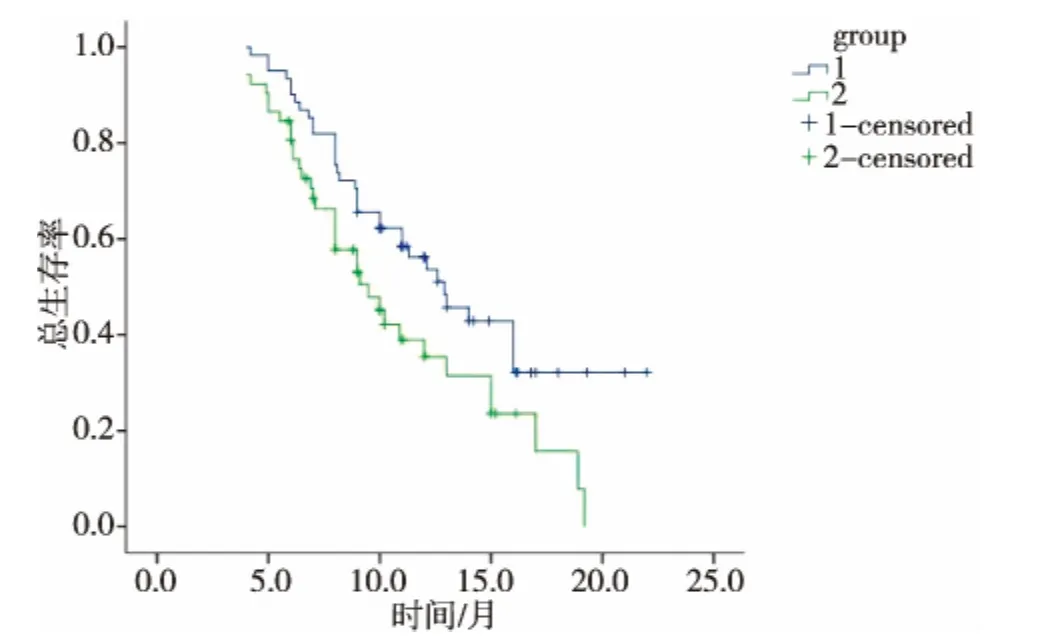
图1 生存曲线
3 讨论
疼痛是晚期癌症患者最常见的症状之一,其发病率在晚期癌症患者中的为31%~90%,是严重影响患者生活质量的重要因素[5]。癌症患者疼痛的原因,最主要是由于肿瘤本身发展,浸润、压迫其周围骨、神经、皮肤、内脏、胸腹膜等而引起持续、剧烈的刺激性疼痛,这占癌性疼痛患者总数的70%。WHO三阶梯止痛方案是目前临床广泛采用的止痛方案,但阿片类药物不良反应如便秘、呼吸抑制也影响患者的生活质量[6-8]。由于氩氦刀冷冻消融可直接毁损肿瘤,解除或减轻其对周围骨、神经、皮肤、内脏、胸腹膜的浸润、压迫,从而达到止痛或减轻疼痛的临床疗效。另外氩氦刀冷冻消融亦有神经阻滞、毁损的作用,临床表现局部疼痛消失的同时其体表投影部位麻木、触痛觉减弱或消失,而这种神经损伤一般会在1~3个月内逐渐改善或恢复,期间疼痛没有加重[9]。本研究冷冻消融序贯化疗组中有26例患者因肿瘤病灶压迫或直接侵及胸壁、肋骨或脊柱伴有局部疼痛,冷冻消融后疼痛有不同程度的改善,有效率为88.5%,提示氩氦刀冷冻消融能有效缓解肿瘤患者局部疼痛,减少三阶梯药物的使用,减少相关止痛药物的不良反应。
随着医学模式的转变,肿瘤患者的生活质量已越来越引起人们的关注。改善生活质量,在此基础上延长肿瘤患者的生存已逐渐成为晚期肿瘤治疗的共识。FACT-G量表是目前应用较广泛的生活质量自评量表。该量表共包括5个部分,分别为PHY、SOC/FAM、DOC、EMO和FUNC,共28项。本研究比较了61例患者冷冻消融前和消融后3周FACT-G量表评分情况,结果FACT-G各维度均有不同程度的改善,冷冻后患者生活质量总评分较前升高10.4%(P<0.01)。提示氩氦刀冷冻消融可改善晚期肺癌患者的生活质量。
晚期(Ⅲb~Ⅳ期)NSCLC是临床肺癌最常见的病变类型,且大多失去外科手术这一局部治疗的机会,而化疗和放疗成为其主要的治疗手段。晚期NSCLC不治疗者中位生存期(MST)仅为4~5个月,1年生存率约10%左右,化疗作为NSCLC姑息治疗的主要手段之一[10-11]。近10余年来,通过各种临床试验结果的荟萃分析,含铂的化疗方案对晚期NSCLC患者能延长生存期,同时减轻症状,提高生活质量;2药方案疗效优于单药,3药与2药方案的生存期相似但毒性增加。在含铂的2药方案中,新药联合方案比老药联合方案(一线化疗方案),有效率提高20%(25%比40%~50%),平均中位生存期延长2~3个月(6个月比9个月),1年生存率提高10%~15%(25%比 40%)。目前在一线化疗方案中,第三代新药联合铂类的2药方案是晚期NSCLC标准治疗 方 案[12-13]。 ECOG (Eastern Cooperative Oncology Group) 和 SCOG (Southern Cooperative Oncology Group)对Ⅲb/Ⅳ期NSCLC进行了大样本的化疗观察,结果ECOG1594中吉西他滨联合顺铂一线方案有效率为22%,中位生存时间8.1个月,1年生存率为36%。
尽管目前化疗仍然是晚期NSCLC的主要治疗手段,同时随着新药的出现,化疗疗效较前有所提高,但由于NSCLC对化疗相对不敏感以及肿瘤细胞普遍存在的多重耐药现象,严重影响肺癌化疗疗效的提高。尤其是对于那些局部肿瘤负荷大、复治的晚期NSCLC患者,化疗的效果仍不尽如人意。为消除局部肿瘤负荷,提高综合治疗疗效,近年来不少学者提出序贯放化疗和同步放化疗的治疗策略,与单纯化疗相比具有较高的有效率,但往往因其严重的不良反应,如放射性肺损伤、骨髓抑制等,使治疗难以完成或严重影响生活质量反而降低了临床受益率[14]。
氩氦刀冷冻消融治疗是近年来一项令人关注的局部肿瘤微创治疗技术,目前已经在前列腺癌、肝癌、肾癌等多种实体肿瘤中应用[15-20]。临床研究证实,冷冻消融手术是局部破坏肿瘤,减轻肿瘤负荷的有效手段。而且,与放疗相比明显具有并发症少,不良反应小的优势。氩氦刀冷冻消融可以最大限度的摧毁靶区肿瘤组织,起到降低肿瘤负荷作用,之后再通过全身化疗杀死周围的亚临床病灶、转移灶和微转移灶,提高综合治疗的疗效,符合肺癌多学科治疗原则。本组资料中冷冻消融序贯化疗组的肿瘤缓解率(34.4%)明显高于单纯化疗组(15.4%),临床获益率冷冻消融序贯化疗组(82%)也明显高于单纯化疗组(65.4%)(P<0.01)。 远期随访,冷冻消融序贯化疗组中位生存时间高于单纯化疗组(12.9月vs 9.5月),1年生存率分别为53.6%和35.4%,两组间差异有统计学意义(P<0.01)。研究提示应用氩氦刀冷冻消融序贯全身化疗治疗晚期NSCLC不仅取得了较好的近期缓解,而且还可提高晚期NSCLC的生存率。
经皮穿刺氩氦刀冷冻消融治疗晚期NSCLC具有局部疗效确切,创伤小等优点,但单纯的冷冻消融手术治疗仅有减瘤效果,且受到肿瘤与大血管、心脏、纵隔浸润等瘤周组织器官诸多因素的影响无法全部灭活肿瘤细胞,更无法预防肿瘤转移,因此仍需联合其他方法进行综合治疗。氩氦刀冷冻消融治疗可以增强综合治疗的临床效果,氩氦刀冷冻消融序贯化疗对于晚期NSCLC患者是一疗效较好的治疗方案。
[1] 苏 忠,陈 宏.肺癌的综合治疗 [J].中国医学创新,2009,6: 151-152.
[2] 郝利国,申宝忠,李任飞,等.中晚期非小细胞肺癌联合治疗进展[J].中国全科医学, 2012, 15: 3812-3815.
[3] 方 文,滕皋军.肝脏恶性肿瘤现代超低温冷冻技术治疗进展[J].介入放射学杂志, 2005, 14: 96-97.
[4] 王 洁.肺癌多学科综合治疗:困境与对策 [J].循证医学,2008, 8: 378-379.
[5] 周际昌.实用肿瘤内科学[M].北京:人民卫生出版社,1999:218.
[6] 孙 燕,周际昌.临床肿瘤内科手册[M].第4版.北京:人民卫生出版社,2003:106.
[7] 罗爱伦,黄宇光.癌痛的规范化治疗势在必行[J].中华医学杂志,2003,83:1929-1930.
[8] 孙 燕,顾慰萍.癌症三阶梯止痛指导原则 [M].第2版.北京医科大学出版社,2002.
[9] 张富同,李秀莉,李慧杰,等.氩氦刀联合介入治疗复发、难治性非小细胞肺癌的临床分析 [J].介入放射学杂志,2007,16: 759-761.
[10] Schiller JH,Harrington D,Belani CP,et al.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N Engl J Med, 2002, 346: 92-98.
[11] D’addario G, Pintilie M, Leighl NB, et al.Platinum-based versus non-platinum-based chemotherapy in advanced nonsmall-cell lung cancer:a meta-analysis of the published literature[J].J Clin Oncol, 2005, 23: 2926-2936.
[12]刘 联,王秀问,黎 莉,等.含顺铂的三组联合化疗方案治疗晚期非小细胞肺癌的随机对照临床研究 [J].癌症,2006,25: 990-994.
[13]屠小龙,舒琦瑾.晚期非小细胞肺癌的维持治疗进展[J].肿瘤学杂志,2010,16:595-599.
[14]王小震,王绿化,吕纪马,等.Ⅲ期非小细胞肺癌放疗加紫杉醇卡铂同步化疗的临床试验结果 [J].中华放射肿瘤学杂志,2006, 15: 270-274.
[15] Sohn RL,Carlin AM,Steffes C,et al.The extent of cryosurgery increases the complication rate after hepatic cryoablation[J].Am Surg, 2003, 69: 317-322.
[16]方驰华,钟洪才,陈小伍,等.氩氦刀冷冻治疗中晚期肝癌的临床研究[J].中华普通外科杂志, 2005, 20: 87-88.
[17]王 会,胡继红,赵 卫.骨肿瘤的消融治疗[J].介入放射学杂志,2012,21:879-883.
[18]曹建民,史东宏,许 健,等.肝癌的氩氦刀冷冻治疗近期疗效的探讨[J].介入放射学杂志, 2008, 17: 258-261.
[19]陈 波,许 健,曹建民,等.氩氦刀冷冻治疗肺癌及疗效评估[J].介入放射学杂志, 2009, 18: 510-514.
[20]赵勇洁,史秋生.超声和CT引导下氩氦刀冷冻治疗恶性肿瘤的临床应用[J].中国医学影像技术, 2007, 23: 258-261.