复方奥美拉唑胶囊质量控制方法的研究
胡晨,邓紫薇,王旭,房志仲,朱立勤
(1.天津医科大学一中心临床学院,天津300192;2.天津市第一中心医院药学部,天津300192;3.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
奥美拉唑(o meprazole,OMP) 是一种 H+-K+-ATP酶(质子泵)抑制剂,OMP与特异性 H+-K+-ATP酶有两个结合位点,对胃酸分泌有明显抑制作用,起效迅速,适用于消化性溃疡(胃、十二指肠溃疡)、反流性食管炎和胃泌素瘤[1-2]。该药作为第一代质子泵抑制剂具有疗效显著、复发率低、不良反应少及服用方便等特点,临床应用广泛[3]。2006年,由Santarus公司研制、商品名为Zegerid的复方奥美拉唑胶囊上市,即将OMP与碳酸氢钠制成复方制剂,为首个上市的质子泵抑制剂速释制剂,每粒胶囊中含OMP 20mg与碳酸氢钠1 100mg,处方中碳酸氢钠可以保护OMP不被降解,同时起到中和胃酸的作用,起效迅速[4]。碳酸氢钠为吸收性抗酸药,口服能被吸收而影响体液的酸碱平衡。主要用于治疗胃酸过多症、代谢性酸中毒、与磺胺类药合用碱化尿液[5]。根据文献报道,笔者研制了该复方胶囊,并建立了相应的质控方法,为申报仿制药物制剂奠定理论基础。
1 材料和方法
1.1 仪器与试药
1.1.1 仪器 美国高效液相色谱仪Spectra-Physics,检测器 Spectra Focus100,输液泵 SP8810,Anastar色谱工作站;色谱柱TIANHE誖KromasilC18(200 mm×4.6 mm,5μm);紫外可见分光光度计(UV-3310,日立公司);RCZ-8A智能药物溶出仪(天津市鑫州科技有限公司);KQ-100B型超声波清洗器(昆山市超声仪器有限公司);ALC-210.4型电子分析天平(北京赛多利斯系统仪器有限公司);80-2B型台式离心机(上海安亭科学仪器有限公司);酸度计PHS-25(数显)pH计(上海精密科学仪器有限公司)。
1.1.2 试剂 奥美拉唑对照品(中国药品生物制品检定所,批号:100367-201104);奥美拉唑原料(湖北远诚药业,批号:A-10411107001);复方奥美拉唑胶囊(本室自制);甲醇(天津市康科德科技有限公司,色谱纯);乙腈(天津市康科德科技有限公司,色谱纯);其它试剂均为市售分析纯;重蒸水(自制)。
1.2 方法
1.2.1 奥美拉唑的质量控制方法
1.2.1.1 紫外分光光度法的建立[6~7]
1.2.1.1.1 样品溶液的制备:(1)对照品溶液的制备:精密称取干燥至恒重的OMP对照品10mg置100mL量瓶中,加入少量甲醇超声溶解,再稀释至刻度。过滤,所得续滤液作为浓度为100μg/mL储备液;(2)样品溶液的制备:取20粒胶囊内容物,混匀,研细后,取 118.7mg(相当于 OMP 2mg),置 50 mL棕色量瓶中,用甲醇稀释,超声20min,静置至室温,用甲醇稀释定容。取一定量的溶液,离心,3 000 r/min,5min。取上清液,经0.45μm微孔滤膜过滤。取续滤液2.5mL置10mL棕色量瓶中,用甲醇稀释定容,即得样品溶液;(3)空白溶液的制备:按照制剂处方去除OPM制成空白胶囊,其它操作同样品溶液的制备过程,得到空白溶液。
1.2.1.1.2 标准曲线的绘制:精密吸取0.2、0.5、0.75、1、1.25、1.5、1.7mL 储备液于 10mL 的量瓶中,稀释成 2、5、7.5、10、12.5、15、17 μg/mL 标准溶液,以甲醇为空白溶液,测定其吸光度,计算回归方程。
1.2.1.1.3 精密度试验:将OMP对照品配制成10 μg/mL浓度溶液,用甲醇定容,一天内重复测定6次,得日内精密度;连续测定6 d,得日间精密度,计算RSD。
1.2.1.1.4 稳定性试验:按照“1.2.1.1.1⑵”项下操作,其中一份避光放置,一份不避光,分别在0、3、6、9、12、24 h 测定其吸光度,计算 RSD。
1.2.1.1.5 重复性试验:精密量取同一批样品适量,共6份,分别按照“1.2.1.1.1⑵”项下供试品制备方法制备供试品溶液,在302 nm处测定吸光度,结果OPM的RSD=0.66%(n=6),表明本方法重复性良好。
1.2.1.1.6 含量测定:按照“1.2.1.1.1⑵”项下操作,制备样品溶液,在302 nm处测定吸光度,计算含量。
1.2.1.1.7 回收率试验:精密称取干燥至恒重的OMP对照品50mg,于50mL量瓶中,配制成1mg/mL储备液,分别吸取0.8、1、1.2mL(即处方量80%、100%、120%),分别加入处方量的辅料置50mL棕色量瓶中,用甲醇溶解,超声振荡20min后定容至刻度,3 000 r/min离心10min,吸取5mL置10mL棕色量瓶中,照分光光度法在302 nm波长下测定其吸光度值,并将测得值与加入值比较,计算其回收率。
1.2.1.2 HPLC方法的建立[8~9]
1.2.1.2.1 色谱条件的选择:选用反向硅胶色谱柱TIANHE誖 Kromasil-C18柱(200mm×4.6mm,5μm)为固定相,流动相:甲醇-水-磷酸-三乙胺=60∶40∶0.12∶0.3,流速为 0.8mL/min,柱温为室温。
1.2.1.2.2 专属性试验:分别以流动相作溶剂,配制复方奥美拉唑胶囊的溶液、OMP原料药溶液及各种辅料的溶液。将所配溶液按照确定色谱条件进行测定,记录色谱图。
1.2.1.2.3 样品溶液的制备:⑴对照品溶液的制备:精密称取干燥至恒重的OMP对照品10mg,于50 mL量瓶中,先加入少量流动相超声溶解,再稀释至刻度,过滤,所得续滤液作为浓度为200μg/mL储备液;⑵样品溶液的制备:按照“1.2.1.1.1⑵”项下操作,即得样品溶液;⑶空白溶液的制备:按照“1.2.1.1.1⑶”项下操作,得到空白溶液。
1.2.1.2.4 标准曲线的制备:精密吸取0.1、0.25、0.5、0.75、1.00、1.25、1.50mL 储备液于 10 mL 的量瓶中,用流动相稀释成 2、5、10、15、20、25、30 μg/mL标准溶液,分别进样20μL,记录峰面积,以峰面积(A)为纵坐标,浓度(C)为横坐标进行线性回归。
1.2.1.2.5 精密度试验:吸取“1.2.1.2.3项下”储备液1mL置10mL量瓶中,用流动相稀释,所得溶液按照确定色谱条件同一天内平行进样6次,计算RSD值,得到日内精密度。连续进样6 d,计算RSD值,得到日间精密度。
1.2.1.2.6 稳定性试验:取同一供试品溶液适量,按照“1.2.1.2.1”项下色谱条件分别于制备后 0、3、6、9、12、24 h进样20μL测定,记录峰面积。
1.2.1.2.7 重现性试验:精密量取同一批样品适量,共6份,分别按照“1.2.1.2”项下供试品制备方法制备供试品溶液,按照“1.2.1.2.1”项下色谱条件各取20μL进样测定,记录峰面积。
1.2.1.2.8 回收率试验:处理方法同“1.2.1.1.1⑵”项下供试品制备方法制备供试品溶液,溶剂由甲醇改成流动相。
1.2.1.2.9 含量测定:取20粒胶囊内容物研细后,取118.7mg(相当于OMP 2mg),置50mL棕色量瓶中,用流动相稀释,超声20min,静置至室温,用流动相稀释定容。取一定量的溶液,离心,3 000 r/min、5min。取上清液,用0.45μm微孔滤膜过滤。取续滤液5mL置10mL棕色量瓶中,用流动相稀释定容,即得样品溶液。按照“1.2.1.2.1”项下色谱条件进样,测定峰面积(A),按照外标一点法,计算浓度,测定OMP的含量,将其结果与紫外分光光度法的结果进行t检验,比较两种方法是否存在显著性差异。
1.2.1.2.10 含量均匀度试验:取本胶囊1粒,称重,精密称量取所有囊壳内细粉,置于50mL量瓶中,用流动相冲洗胶囊壳,冲洗液加入量瓶中,加适量流动相稀释,超声20min,放冷定容。取一定量的溶液,离心,3 000 r/min、5min。取上清液,用 0.45 μm微孔滤膜过滤。取续滤液5mL置10mL棕色量瓶中,用流动相稀释定容,即得样品溶液。按此要求共检测10粒。按照上述色谱条件进样,测定峰面积(A),按照外标一点法,计算浓度,测定OMP的含量,应符合药典规定。
2 结果
2.1 奥美拉唑对照品紫外分光光度法的结果
2.1.1 检测波长的选择 由图1和图2可以看出,OMP对照品在302 nm处有最大吸收,且辅料在此波长处对主药的测定无干扰,所以确定302 nm为药物的检测波长。
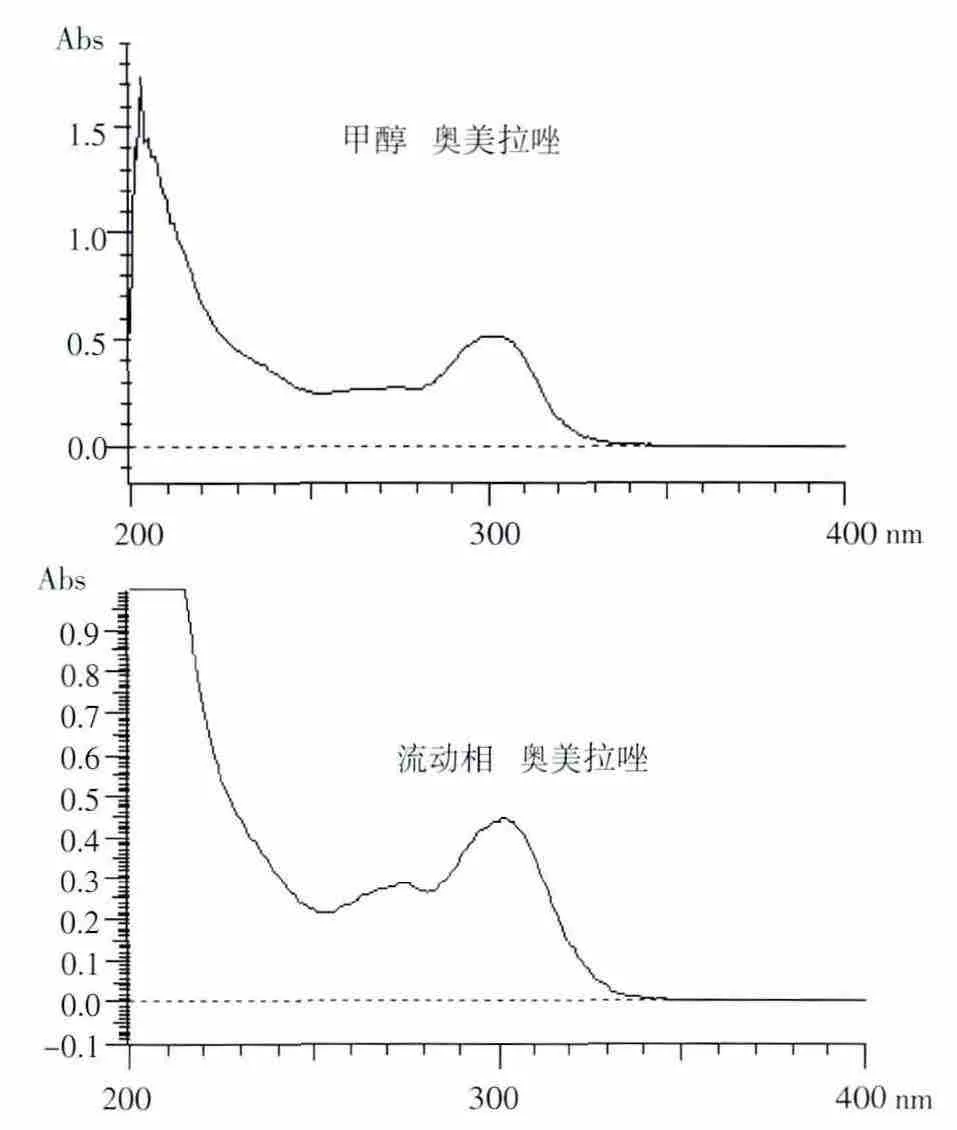
图1 奥美拉唑对照品的甲醇溶解和流动相溶解的紫外扫描图Fig 1 UV spectrum of omeprazole reference inmethanoland in m obilephase
2.1.2 奥美拉唑对照品的标准曲线 以吸光度值(A)对浓度(C)作线性回归,得标准曲线,方程为:y=0.0503x-0.0066,r=0.9998。结果表明,在2~17μg/mL的浓度范围内,线性关系良好。
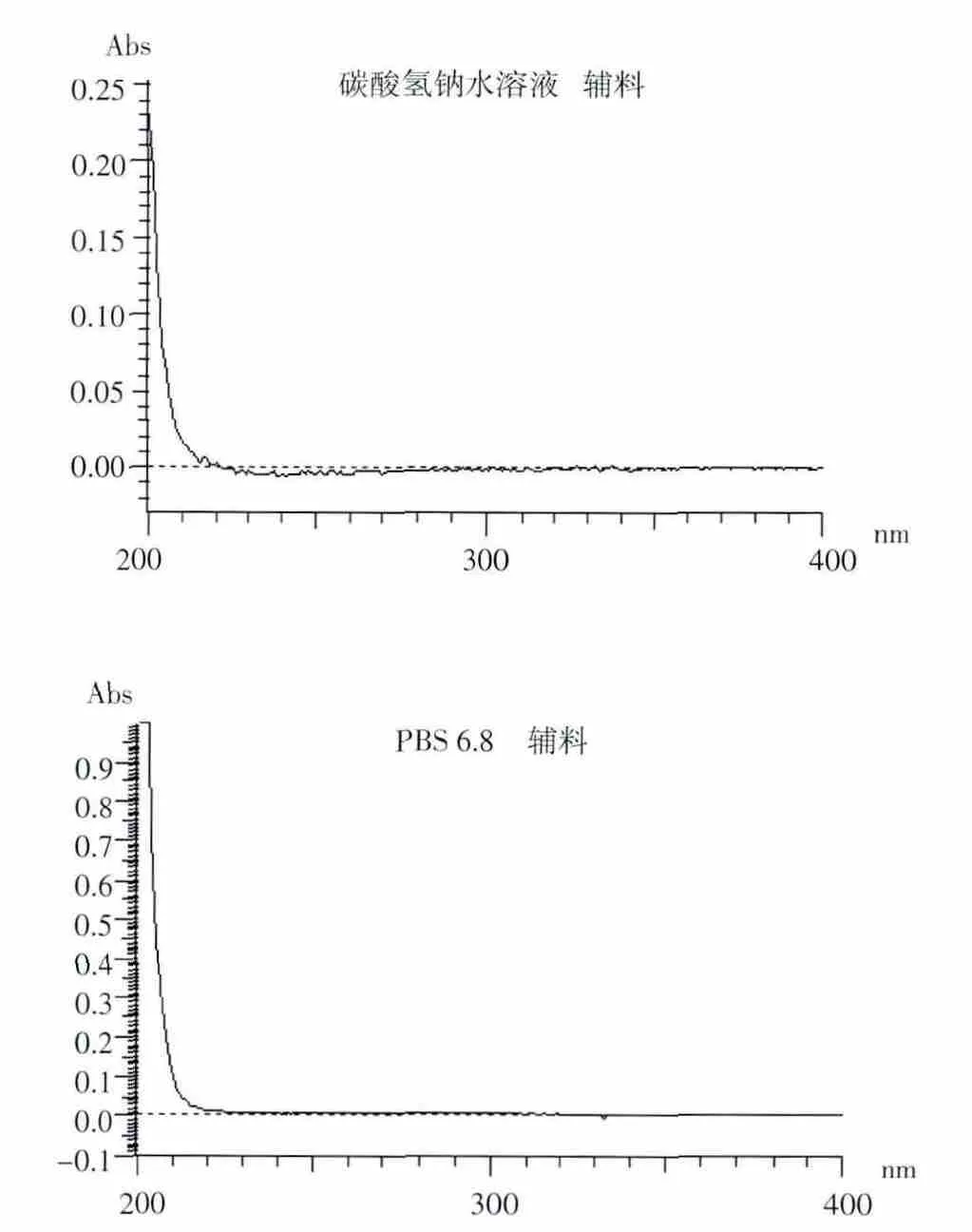
图2 空白辅料在碳酸氢钠水溶液和PBS 6.8中的紫外扫描图Fig2 UVspectrum ofblankexcipientsinsodium bicarbonatesolution and in PBS 6.8
2.1.3 精密度试验结果 日内精密度的RSD为0.44%,日间精密度的RSD为0.75%,均小于2%,方法重现性良好,符合要求。
2.1.4 样品溶液稳定性考察结果 未避光放置的样品溶液在9 h时测量其吸光度值降低,而采取避光处理的样品溶液在24 h内的稳定性符合要求,RSD<2%,提示奥美拉唑见光易降解,需要避光保存。见表1。
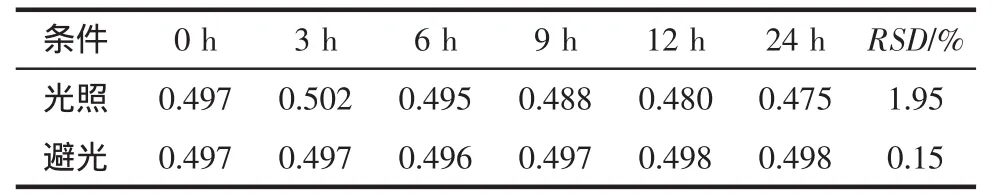
表1 奥美拉唑样品稳定性试验(n=12)Tab1 Stability of omeprazole sampleby theUV analysis(n=12)
2.1.5 回收率试验结果 方法回收率为98%~102%,RSD<2.0%,符合规定。证明在高、中、低3个浓度范围内,本处方辅料不影响OMP的测定,该方法具有良好准确度。见表2。
2.2 奥美拉唑HPLC测定结果
2.2.1 专属性试验结果 分别取“1.2.1.2.3”项下对照品溶液、供试品溶液、阴性对照溶液各20μL,按照“1.2.1.2.1”项下色谱条件进样测定,记录峰面积。结果表明,OPM的保留时间约12min,阴性对照对测定结果无干扰。色谱见图3~4。

表2 回收率试验结果(n=9)Tab2 Resultsof recovery test(n=9)

图3 奥美拉唑原料药HPLC色谱图Fig 3 HPLC chrom atogram sof om eprazole
图4 空白辅料HPLC色谱图Fig 4 HPLC chrom atogram sof blank
2.2.2 奥美拉唑的标准曲线 以峰面积(A)对浓度(C)做线性回归的标准曲线,方程为A=71 627C-9 783,r=0.999 9(n=3),结果表明,OMP 在 2~30 μg/mL的浓度范围内线性良好。
2.2.3 精密度结果 日内精密度的RSD为0.60%,日间精密度的RSD为0.56%,均小于2%,方法重现性良好,符合要求。
2.2.4 稳定性试验结果 OPM样品稳定性试验RSD 为 0.54%(n=12),OMP 避光保存在 24 h 内稳定。
2.2.5 重现性试验结果 OPM的RSD为0.66%(n=6),表明本方法重复性良好。
2.2.6 回收率试验结果 OMP的回收率为98.00%~102.00%,RSD均小于2%,符合规定,见表3。

表3 回收率试验结果(n=9)Tab3 Resutsof recory test(n=9)
2.2.7 含量测定结果 测得3个批次复方奥美拉唑胶囊中OMP的平均含量为99.36%,RSD为0.57%。根据2010年版《中国药典》(二部)规定,OMP含量应在90.00%~110.00%之间,相对标准偏差小于2%,符合要求。
2.2.8 含量均匀度试验结果 复方奥美拉唑胶囊中:A+1.80S 为 2.17<15.0,符合规定,见表 4。
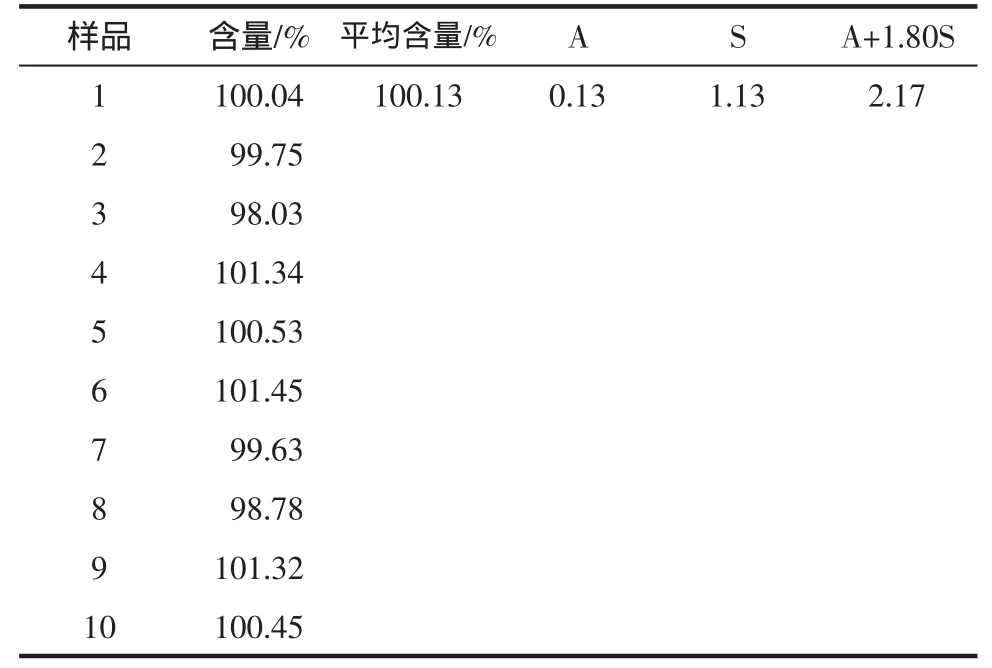
表4 复方奥美拉唑胶囊的含量均匀度(n=10)Tab4 The content uniform ity of com pound omeprazole capsules(n=10)
3 讨论
3.1 超声时间的确定 取6粒样品研细后,取118.7mg置50mL量瓶中,加入流动相,分别超声5 min、10min、20min,静置,用流动相稀释定容。取一定量的溶液,离心5min,转速为3 000 r/min。取上清液,用0.45μm微孔滤膜过滤。分别吸取续滤液5mL至10mL量瓶中,用流动相稀释定容,即得样品溶液,分别进样,计算结果表明:超声20min的复方奥美拉唑胶囊中OMP的含量高于其他两种方法,因此选择超声20min的提取方法。
3.2 色谱条件的选择 不同流动相比例的考察:分别配制甲醇-水-磷酸-三乙胺=61∶39∶0.12∶0.3,甲醇-水-磷酸-三乙胺=62∶38∶0.12∶0.3,甲醇-水-磷酸-三乙胺=59∶41∶0.12∶0.3 不同比例的 3 种流动相,分别精密量取对照品20μL进样,流速均为0.8mL/min,观察OMP的出峰情况。含量测定结果显示,流动相的比例和流速有微小的变动对其几乎没有影响,说明本方法耐用性良好。
3.3 紫外分光光度法和HPLC法比较 两种质量控制方法的结果通过t检验进行分析,P值均>0.05,说明两种方法无显著性差异,由于杂质及有关物质检测的需要,所以首选HPLC法,紫外分光光度法可以作为溶出度结果的考察方法。
[1]卞志家,何亦秋,何瑜,等.奥美拉唑的全球专利申请状况分析[J].统计分析,2012,8(10):57
[2]Hiroshi I,Shingo K,Yusuke S,etal.Early effectsoforaladministration of omeprazole and roxatidine on intragastric pH[J].JZhejiang University,SCIENCEB,2012,13(1):29
[3]梁建华,张石革.质子泵抑制剂的研究进展与临床应用[J].中国药房,2012,13(1):51
[4]FDA.PatentCounseling Information.ZEGERID(omeprazole/sodium bicarbonate)Powder for Oral Suspension and Capsules.http://www.rxlist.com/zegerid-drug.htm
[5]娄伯琴,倪根珊.碳酸氢钠的近日临床应用[J].临床荟萃,1994,9(21):997
[6]国家药典委员会.《中国药典》2010年版(二部)[M].北京:中国医药科技出版社,2010:1038-1041
[7]陈新玲,许晓,翟卫芳.紫外-可见分光光度法测定奥美拉唑钠中间品中奥美拉唑的含量[J].首都医药,2009,16(18):52
[8]王旭,李美珍,卢欣,等.3种HPLC色谱条件下测定奥美拉唑含量方法的比较[J].天津医科大学学报,2012,18(4):510
[9]王宇和,朱润峰,曹文宁.复方奥美拉唑胶囊的制备和质量控制[J].中国药业,2011,20(16):45

