同步辐射微区X射线荧光和吸收谱技术在大气、土壤和动植物分析中的应用
袁 静 罗立强
1(中国地质大学(北京)数理学院 北京 100083)
2(国家地质实验测试中心 北京 100037)
大气飘尘、土壤和动植物等是环境中毒性元素迁移转化的重要载体,这些样品基质复杂,异质性强,而这种内在的异质性在元素的生物地球化学过程和行为机制中起着关键作用[1],因此仅在宏观水平测定元素的总量并不能满足研究需要,而往往需要在微观尺度探索元素的行为,进而获得元素的移动性、生物有效性和毒性等信息。
同步辐射技术由于其检测限低、灵敏度高、微区原位、无损分析等特性,在众多微区分析技术中脱颖而出,尤其对于微尺度样品和水合的生物样品具有独特优势。经过三代发展,同步辐射光谱亮度达 1020ph/(S·mm2·mrad2·0.1%BW)[2],使得灵敏度更高,不仅大大缩短了测量时间,并且能够对常规分析手段难以测定的痕量金属或类金属元素进行较为理想的测定;光斑尺寸可达几微米,空间分辨率达到纳米-亚微米尺度,能够获得更高分辨率的图像,并可在细胞水平上开展元素分析[3]。因此,同步辐射微区分析技术开拓了原位分析微尺度样品或微小区域元素组分、化学形态、物质结构及其空间分布的新方法,目前已广泛应用于环境科学[4]、地球科学[5]、生物学[6]和医学[7]等多学科领域研究。
1 同步辐射微区分析的重要技术进展
1.1 同步辐射光源历史
同步辐射就是高速运动的带电粒子在磁场中做变速运动时发出的电磁辐射。1947年,Elder等在美国通用电器公司实验室里的一台70 MeV的同步加速器上首次观察到“同步辐射”[8−9]。但起初这种辐射被视为一种电子能量损失的负面效应,从它作为一种不可避免的现实被加速器物理学家和高能物理学家所接受到如今在各个学科领域广泛应用并仍在迅速成长的技术手段,同步辐射光源的发展,大体经历了三个阶段。
第一个阶段是从20世纪60年代中期开始的10年间,这一阶段同步辐射应用的主要特点是必须与高能物理实验同时进行,由于此时同步辐射是作为高能物理实验时的一种不可避免的负面产物来应用的,也因此被称为“寄生应用”。同步辐射应用发展迅速,第一代光源渐渐不能满足应用的需要。第二代同步辐射光源专门为同步辐射应用而设计。
第二代光源的研制源于60年代储存环的建成。1966年,美国威斯康星大学(麦迪逊)开始运作专用于同步辐射光源的 240 MeV电子储存环Tantalus[10],掀起了世界范围内建造同步辐射专用装置的热潮。第二代光源的建造约从20世纪70年代中期开始,它与第一代光源最主要的区别在于它已经不是作为一个高能物理实验的副产品,而是为同步辐射应用专门设计和建造,这个时期最重要的进展是磁铁聚焦结构的引入得到更优化的光源[11]。
20世纪90年代开始,迎来了同步辐射光源的第三次飞跃,第三代同步辐射光源的发展源于插入件技术的发展及应用,安装插入件,使光斑尺寸大大减小,束流长期稳定,发散度小于10−12弧度,同步光亮度达1016数量级[12]。
1.2 同步辐射光源装置
同步辐射光源装置主要分为三部分:一是光源,包括加速器,电子储存环和插入件;二是光束线,同步辐射离开加速器后经过各种光学元件,成为具有不同特性的光被引入到实验站上供用户使用;三是实验站,每个实验站功能各不相同,一个同步辐射装置能够供几十个实验站使用。
同步辐射装置主要依靠各种元件改善光束性能,得到各种不同特性的光束线。常见的元件有插入件、聚焦系统、准直系统、单色器等。例如插入件波荡器的使用可使同步辐射X射线亮度大幅度提高。又如Kirkpatrick-Baez聚焦镜系统、折射透镜或菲涅尔区板等光学元件,将光束尺寸聚焦到微米甚至亚微米范围,从而提高横向分辨率,这对常规微区分析技术难以分析的生物样品组织[13]和土壤微生物[14−15]的研究非常有益。
目前世界上同步辐射装置已建成的有60多个。其中,2009年投入使用的德国汉堡同步电子加速器PETRA III的储存环能量高达6 GeV,目前被认为是最强的X射线源。随着同步辐射技术的优越性广泛被大家认同,越来越多的小型同步辐射装置在全世界范围内建造,储存环能量从1.3−3 GeV不等,例如欧洲有:BESSYII—德国、SOLEIL—法国、DIAMOND—英国、SLS—瑞士、ALBA—西班牙、MAX IV—瑞典[16]。我国的上海光源(Shanghai Synchrotron Radiation Facility, SSRF)已于2009年5月正式投入使用,它属于第三代中能同步辐射光源,包括一台150 MeV电子直线加速器、一台全能量增强器和一台 3.5 GeV的电子储存环,储存环周长432m,能够安装60多条光束线,流强200−300 mA的电子束流[17]。
1.3 同步辐射微区 X 射线荧光(μ-SXRF)和同步辐射X射线吸收谱技术(XAFS)
近20年来,随着第三代同步辐射光源的不断发展,同步辐射微区分析技术在各个学科领域应用不断深入。其中,应用在环境科学领域和地球科学领域的分析技术主要有两种:同步辐射微区X射线荧光光谱分析(Synchrotron micro-X-ray fluorescence spectroscopy, μ-SXRF)和同步辐射X射线吸收谱技术(X-ray absorption fine spectroscopy, XAFS)。
μ-SXRF和XAFS技术原理均基于光电效应(图1)。不论是吸收还是荧光过程,都涉及到入射X射线和出射荧光的特定能量,而这些特定的能量对应的是不同原子的电子结构特征。这就是不同元素产生特征吸收和荧光谱的原因。
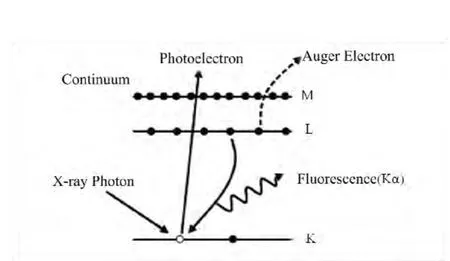
图1 入射X射线激发吸收原子内层电子时产生的光电效应,通过释放X射线荧光或俄歇电子使激发态达到稳定,K、L和M是内层电子的能级[16]Fig.1 Depiction of the excitation of an atom by an X-ray photon and decay of the excited state by either X-ray fluorescence or by the Auger effect. The K, L and M are the core electron levels[16].
μ-SXRF技术是基于高通量的同步X射线照射样品获取荧光谱图而对样品进行定性或定量分析,和通过光学元件得到空间相干的高亮度微束X射线对样品进行面扫描分析获取样品的元素空间分布图。相较于传统XRF,μ-SXRF主要有三项突破:一是具有更高的亮度,比传统X射线管产生的X射线亮度大10个数量级[16,18],再加上能量可调和低散射的特性使SR-XRF分析的灵敏度大大提高,非常有益于传统 XRF难以测定的痕量金属和类金属元素的分析[19];并且,同步辐射源的电子束必须在超高真空的环境中,因而激发样品的X射线束高度洁净,光束不必穿过铍窗或者气体,X射线受到的吸收和污染均可减小到最低;此外,随着近年来X射线光学的发展,大部分同步辐射装置都配备了Kirkpatrick-Baez聚焦镜系统、折射透镜或菲涅尔区板等光学元件,使得X射线的光斑尺寸更小,甚至达到nm级,能够获得更高分辨率的元素空间分布图。目前,微束X射线的分辨率大体在50 nm−20 μm之间[20],可实现对生物样品细胞或亚细胞水平的元素分布分析。这些都使得μ-SXRF技术受到众多学科领域越来越多的研究者的欢迎。
XAFS技术是通过一定能量范围的连续X射线扫描样品,来获取感兴趣元素的局域结构信息[16]。吸收谱实验的基本原理是保持样品不动,照射样品的X射线的能量逐渐增加,同时探测器收集荧光信号。当入射光能量接近感兴趣元素的核外电子结合能时,原子对入射光的吸收逐渐增加,同时出射的荧光信号也相应增加。因此感兴趣元素在每个能量点的吸收或荧光信号被探测和记录下来形成吸收谱线[19]。一条吸收谱线通常被分为两部分:X射线吸收近边结构谱(X-ray absorption near-edge structure,XANES)和扩展 X射线吸收精细结构谱(Extended X-ray absorption fine structure, EXAFS) (图2[16]),能量范围大约为吸收边前50 eV到吸收边后200 eV和吸收边至吸收边后800 eV[18]。XANES能够提供原子的氧化态、价态和配体的电负性等信息[21]。而EXAFS能够提供原子的化学配位信息,如配位原子的种类、配位数和配位距离等[22−23]。XAFS对元素周期表上的每个元素都响应[24],并且对样品无特殊要求,研究介质从矿物到生物样或溶液均可[16]。
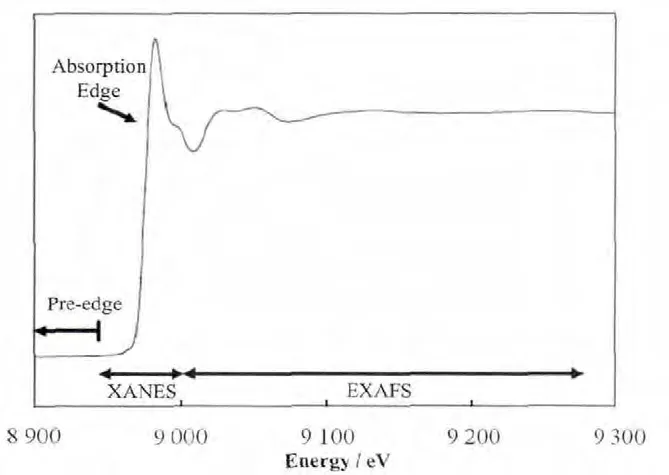
图2 孔雀石中Cu的K边吸收谱线,分别标出了XANES和EXAFS区域[16]Fig.2 XAS spectrum of malachite [Cu2(CO3)(OH)2] showing the region of the spectrum pertinent to XANES and EXAFS[16].
2 μ-SXRF和XAFS的应用
近几十年来,同步辐射微区分析技术一直促进着人类在微观水平对元素行为的理解。其中,μ-SXRF和XAFS在元素分布分析和形态分析中得到了广泛而深入的应用[25−26],为了解元素在环境和生物体内的迁移特征和转化规律带来了全新的发现,揭示了元素生物有效性和毒性等重要线索。大气飘尘、土壤、植物是生态环境中元素传递的重要环节,而蚯蚓在土壤生态系统中发挥重要作用,影响土壤中金属元素的生物有效性,通过与土壤和植物的相互作用参与元素在生物链中的循环。本部分将从大气飘尘、土壤、植物和蚯蚓四个方面总结这两种同步辐射微区分析技术的应用。
2.1 大气飘尘的来源分布和形态分析
近几年,不断增加的大气颗粒物对生态环境和人类健康造成的危害引起了越来越多的关注。大气颗粒物的危害程度主要取决于颗粒物大小、化学成分及有害元素的浓度[27]。颗粒物大小为2.5−10 μm,但过去的几年中小于 2.5μm 的颗粒引起更多的关注。PM10的主要组成是C、O、N、Fe、K和Ca,而 PM2.5含有更多的重金属[28],可进入到支气管和肺泡,造成呼吸系统、免疫系统损伤和心血管疾病。近年来已经有多种方法研究颗粒物的组成和形态,其中,μ-SXRF和XAFS技术由于其高灵敏度、低检出限、微区原位和无损检测等特点已逐渐成为研究大气颗粒物中组成特征和元素形态的理想工具。
大气颗粒物的单颗粒的μ-SXRF谱特征是研究颗粒物来源的重要指纹信息,因此可通过 μ-SXRF分析识别颗粒物的来源[29−31]。Yue 等[31]用 μ-SXRF对上海市三个监测点的PM2.5样品进行探测,共识别出7种来源:冶金工业尘(18%)、汽车尾气(14%)、土壤尘(11%)、燃煤烟尘(9%)、柴油机排气(7%)、石油燃烧气(2%)和摩托车排气(1%),通过对大量颗粒物统计分析,发现冶金工业尘、汽车尾气和燃煤烟尘是上海市 PM2.5的主要来源。Walker等[30]用10μm的光斑在17.479 keV能量处对加拿大渥太华一户城市居民家中活动区域灰尘、家长卧室灰尘、儿童卧室灰尘和花园土壤四种样品进行μ-SXRF面扫描,并对图中感兴趣点进行探测,结果显示,样品中有 S、Cl、K、Ca、Ti、Cr、Mn、Fe、Ni、Cu、Zn、As、Pb、Br、Rb和 Sr。并且与同一城市的其他家庭相比,家长卧室灰尘、儿童卧室灰尘、花园土壤样品中的Pb和Zn含量较高,儿童卧室灰尘样品中Cu的含量较高,活动区域灰尘样品As的含量较高。对这些样品进行来源分析,结果表明卧室灰尘中Pb、Zn和Ba的主要来源是颜料中的铅白和立德粉,可能与家庭的装修活动有关。以上研究均显示,μ-SXRF分析已经成为大气颗粒物源解析的快速有效手段。
XANES技术能够对大气颗粒物中元素形态进行分析,用以判断元素形态及毒性信息。Jiang等[32]选用美国国家标准与技术研究所的两种标样:城市灰尘(SRM 1649a)和室内灰尘(SRM 2584)作为样品,用XANES技术对其进行Pb L-edge、Mn K-edge、Cr K-edge分析,研究这三种元素在城市灰尘和室内灰尘中的存在形态。与三种元素标样吸收谱图进行比对(图3)并用已有标样进行线性拟合,结果显示,城市灰尘的Pb L-edge谱线与PbSO4相似,拟合结果是由 PbSO4(61%)和 2PbCO3·Pb(OH)2(39%)组成,室内灰尘由 2PbCO3·Pb(OH)2(98.5%)和 PbSO4(1.5%)组成。由此可直观地观察到 Pb在两种灰尘中主要的存在形态。同样的,也可准确地观察到Mn和Cr的存在形态。

图3 城市灰尘(SRM 1649a)和室内灰尘(SRM 2584)与纯Pb化合物的Pb L-edge XANES谱图(a)、城市灰尘(SRM 1649a)和室内灰尘(SRM 2584)与纯Mn化合物的Mn K-edge XANES谱图(b)、城市灰尘(SRM 1649a)和室内灰尘(SRM 2584)与纯Cr化合物的Cr K-edge XANES谱图(c)[32]Fig.3 Lead L-edge XANES spectra of the urban dust (SRM 1649a) and the indoor dust (SRM 2584) accompanied by the spectra of pure Pb chemical compounds in the increasing order of the Pb oxidation states (a), manganese K-edge XANES spectra of SRM 1649a and SRM 2584 as compared with spectra of pure Mn compounds (b) and chromium K-edge XANES spectra obtained from SRM 1649a and SRM 2584 compared with spectra of pure Cr compounds (c)[32].
μ-SXRF和XAFS技术在大气颗粒物研究中的应用,展示了该技术在大气颗粒物等微尺度样品研究中的巨大潜力。大气颗粒物的研究者们期待同步辐射微区分析技术在未来的几年中,不断推进此领域的发展。
2.2 土壤和沉积物中的元素分布与形态研究
同步辐射微区分析技术能够对土壤中矿物组合、元素分布进行原位分析,并能进行土壤孔隙中的细节分析及与微生物的相互作用等研究,分析过程方便快捷,不需样品前处理,很好地克服了以往测定土壤和沉积物中元素的局限,为土壤和沉积物中的元素测定提供了非常好的方法。特别是同步辐射技术空间分辨的特点使土壤中金属形态的研究发生了巨大变化[33]。例如μ-SXRF由于其高亮度、高度聚焦和快速发展的探测技术,使其能够在高分辨下原位分析土壤,保持土壤的自然属性。此外,还能够与XAFS和XRD等其他同步辐射技术联用,在研究土壤中元素分布的同时,还能够在3D水平测定污染元素或营养元素的化学形态,从而揭示元素的迁移转化机制、生物有效性、毒性及其在环境中的命运等多种信息。
XAFS技术提供新的视角研究土壤中元素的化学形态,揭示受污土壤中微量毒性元素与自然系统的相互作用。Flogeac等[34]用实验室模拟的方法在石灰性土壤中人为地加入Cu,模拟天然土壤中Cu的吸附机理,并用电子顺磁共振(Electron paramagnetic resonance, EPR)和XAFS方法对其进行测定,根据XANES和EPR谱图并对EXAFS谱进行拟合获得Cu第一壳层的配位信息,发现Cu主要与矿物表面的土壤有机质(Soil organic matter,SOM)结合。Liu等[35]用XAFS分析采自电路板回收厂的Cu污染土壤,他们对XANES谱进行线性拟合,并且对 EXAFS谱进行第一壳层拟合,结果表明土壤中的Cu以Cu-SOM、CuCO3、Cu2O和CuO几种形态存在,其中Cu-SOM是主要的存在形态。
μ-SXRF技术能够得到土壤中元素的二维分布图,可用于研究元素间的相关性,为目标元素存在矿相提供参考。Terzano等[36]用μ-SXRF研究受污土壤中的Hg元素,通过μ-SXRF扫描获得的元素分布图发现,Hg与Cl和S显著相关,但与Fe不存在相关性,说明Hg并不像通常所认为的一样与含铁矿物相结合,而更有可能存在于一种含S和Cl的矿物中。Khaokaew等[37]对从锌矿区采集的水稻土壤样品进行μ-SXRF分析,通过微区X射线荧光结果表明,Cd元素的分布与Ca元素显著相关,而并非如通常所认为的与 Zn相关,研究结果表明,相对于Zn,Cd与Ca似乎更有可能存在于一个矿相。
更多的情况下,同步辐射XAFS与μ-SXRF联合用于研究土壤中元素的分布与形态。首先对样品进行微区X射线荧光面扫描,确定感兴趣元素存在区域,再对该区域进行微束XRF探测和XAFS形态分析。例如,Strawn等[38]研究了长期受Cu污染的天然土壤,用μ-SXRF和μ-XAFS对土壤样品进行详尽的分析,发现土壤中的Cu分布并不均匀(图4),并且浓度最高的点只有几个像素宽,说明土壤中Cu高的部分由小富铜颗粒组成;在μ-SXRF元素分布图中,Cu像素最高的点缺少高计数的S、Si、K和P的峰,并且缺少显著的Ca、Fe或者Mn的荧光信号,表明 Cu在土壤中并不是以硅酸盐、磷酸盐、硫酸盐或者粘土矿物的形式存在,也不与 Ca、Fe和Mn的金氧化物或碳酸盐相连,因此推测土壤中的Cu是以Cu的(氢)氧化物、Cu的碳酸盐形态存在,或者是直接吸附到 SOM 上;进一步对样品上的两个高点Spot1和Spot2进行Cu的K边吸收谱分析,并与CuCO3·Cu(OH)2、 Cu(OH)2、Cu2+Ads.Elliot HA(Cu 吸附 Elliot HA)等多种标样进行比对,用Cu(OH)2和Cu2+Ads.Elliot HA对样品的谱图拟合结果最好,其中Cu2+Ads.Elliot HA对拟合曲线有90%的贡献,推测Cu主要是吸附在Elliot HA上。

上述研究展示了XAFS和μ-SXRF分析技术成功地应用于土壤和沉积物中的元素分布与形态研究,推进了研究者对土壤和沉积物中元素相互作用、迁移性、毒性等的理解。
2.3 植物中的耐受机制
植物形成了生态系统的第一营养级,因此要研究元素在生态系统内的行为,就要彻底地了解元素在植物器官内的吸收、转运、耐受机制和积累机制。近年来,随着μ-SXRF的出现和飞速发展,使得植物内部甚至亚细胞水平的相关金属的分布研究成为可能。与μ-XAS联用,能够原位研究植物内感兴趣金属元素的形态。
μ-SXRF能够在细胞或亚细胞水平研究植物中金属和类金属的富集部位[39−43]。例如 Fukuda等[1]用光斑尺寸为3.8 μm×1.3 μm的微束X射线在亚细胞水平对Cd超富集植物拟南芥进行μ-SXRF扫描分析,获得的二维荧光图像显示 Cd高度富集在叶片表面的香毛簇。类似地,Freeman等[39]用微束X射线对Se超富集植物紫云英的幼叶进行扫描发现,Se主要富集在叶片表面的毛状体上,并且通过 Se的信号可推测,毛状体部位的Se浓度约比叶片其余部位高 10倍。Kopittke等[41]用配备快速探测器的μ-SXRF 对经过 24 h As(Ⅲ)和 As(Ⅴ)浸泡豇豆新鲜根部组织进行探测,图像显示 As主要积累在根部的内皮和中柱鞘细胞。
XAFS能够测定植物鲜样组织中元素的配位环境和化学形态。Lombi等[44]用XANES技术研究蕨类植物蜈蚣草(Pteris vittata)中As的形态,研究发现植物的叶片中砷主要以As(Ⅲ)的形式存在。这一观点后来被webb等[45]证实,并结合EXAFS研究,发现在新鲜叶片中,三价砷主要是以水合亚砷酸离子即非配位的亚砷酸盐的形态存在。然而,随着新鲜叶片的老化干燥,叶片中砷的形态逐渐由As(Ⅲ)转化为As(Ⅴ)(图5)。推测这种亚砷酸盐可能存贮于植物的液泡中。
用XAFS和μ-SXRF相结合的方法研究植物新鲜样品中重金属元素的形态和分布,能够推测重金属元素从土壤转移到植物的生物化学途径和机制[46−48]。Pickering 等[46]用 μ-XANES 和 μ-SXRF 对蜈蚣草新鲜组织进行研究,在砷酸盐和亚砷酸盐两种吸收边能量下分别对蜈蚣草的配子体进行μ-SXRF扫描分析,观察到亚砷酸盐主要分布在细胞中央而远离细胞壁,基于蕨类植物细胞中液泡位于细胞中间并且占据着大部分的细胞空间,因此再次验证了蜈蚣草叶片中砷以亚砷酸盐的形态分布在液泡中;对蜈蚣草的根、叶轴、叶三部分进行μ-SXRF扫描分析,观察到砷酸盐(As(Ⅴ))分布在叶脉中心,而砷的硫化物 As(SR)3则像一个圆柱外壳,紧密地环绕在叶脉上砷酸盐的周围。进一步对蜈蚣草的根、叶轴、叶部分进行XANES分析,发现植物根中由As(Ⅴ)(90%±4%)和 As(Ⅲ)(10%±5%)组成,植物叶轴中为 24% 的 As(Ⅴ)和 76%的 As(Ⅲ),植物羽叶中砷的形态主要为As(Ⅲ)(95%±1%),并含有微量的硫化物砷官能团(As(SR)3)(5%±1%),由以上推测砷的硫配体复合物可能是植物提取和传输砷的过程中将As(Ⅴ)还原为As(Ⅲ)的重要媒介。
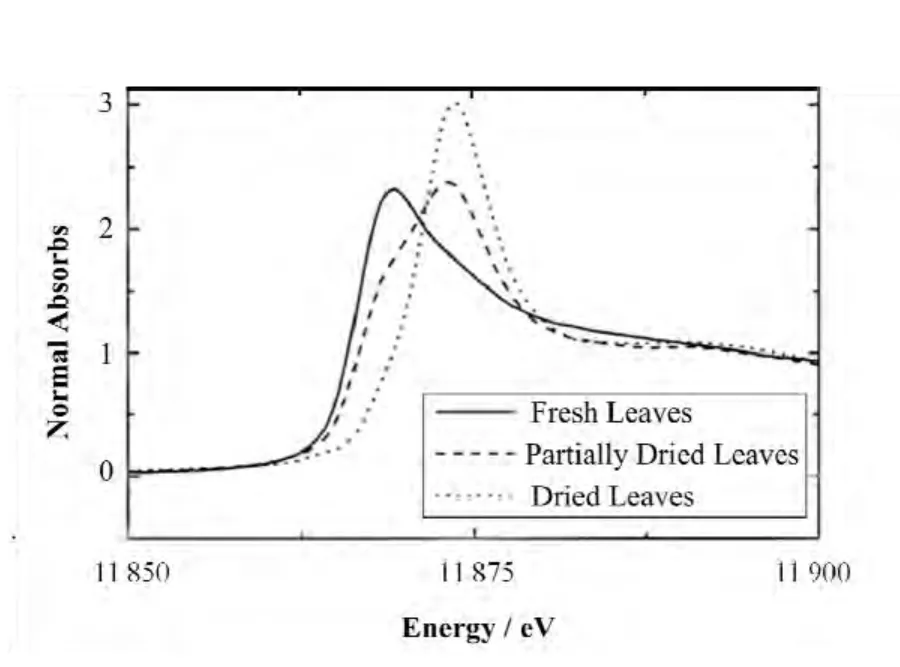
图5 蜈蚣草叶片在干燥过程中不同阶段的K边XANES谱线,随着老化过程的进行,叶片中砷的形态逐渐由As(Ⅲ)转化为 As(Ⅴ),样品中砷的浓度约为 1 000 μg·g−1[45]Fig.5 Arsenic K-edge XANES data of Pteris vittata leaves atvarious stages of drying. The shift in oxidation state from As(Ⅲ) to As(Ⅴ) can be seen as the aging process progresses.Arsenic concentration is approximately 1 000 μg·g−1[45].
XAFS和μ-SXRF相结合的方法能研究植物在受毒性元素胁迫时的存储、耐受和解毒机制[49−50]。Isaure等[49]对经过 Cd浸泡的超富集植物拟南芥(Arabidopsis thaliana)进行研究,发现在拟南芥根部Cd位于维管束中,并且与硫配体相结合,而在拟南芥叶片组织中毛状体是大量的 Cd的存贮部位,并且Cd LIII-edge μ-XANES结果显示拟南芥叶中Cd主要与来自细胞壁的O/N配体结合(约75%),少量与S配体结合(约25%)。可见在拟南芥根部和叶片部位Cd的主要存贮方式并不相同。研究结果表明,当 Cd进入生物体后,生物体本身可能有一定调节能力。Seyfferth等[50]研究人工培养的As污染水稻根部样品,发现在水稻根部表面含铁斑块可见的部位,As和Fe共同存在,对其中As化合物进行线性拟合,发现由 66%−87%的 As(Ⅴ)和 0%−15%的As(Ⅲ)组成。由此推測,水稻根部的含铁斑块可能为As(Ⅴ)进入植物体提供了一道屏障。以上研究结果与以往研究者发现的土壤中重金属被植物根吸收后,沿着植物干部运输到叶部过程中植物会对重金属进行一些去毒化处理[51−52]相符合。
以上研究均显示XAFS和μ-SXRF已经成功应用于植物中的元素分析,不仅突破了常规方法,能够在细胞和亚细胞水平测定元素的微区分布和存在形态,而且为水合鲜样提供了更加便捷和可靠的途径,为揭示植物中毒性元素的行为机制提供了重要线索。
2.4 蚯蚓中的代谢过程
蚯蚓是陆地生态毒理学中一个非常重要的角色[53],被称为“生态系统工程师”[54]。它不仅能够通过自身活动改善土壤性质,而且还能对与土壤生态系统相关的其他生物如植物[55]、微生物[56]产生影响。最重要的是,它能够在受污染的土壤中定居生存,因此,蚯蚓如何通过自身的吸收与代谢等生命活动使其免受有毒元素的毒害并参与到这些元素在生态系统内的迁移和循环[57]成为科学家们研究的热点。同步辐射XAFS和μ-SXRF通过测定蚯蚓体内元素的形态与分布帮助理解其代谢过程和机理[58],目前已经成为研究蚯蚓体内元素行为所广泛采用的手段。
近年来,已经有很多研究者利用同步辐射μ-SXRF测定蚯蚓体内毒性元素的富集位点。Morgan等[13,59]在最近的研究中,用μ-SXRF对蚯蚓组织鲜样进行微区扫描,获取的元素荧光分布图表明 Zn、Pb、Ca元素主要分布在排列在后部消化道周围的 chloragogenous组织。这一结果与 Cotter等[60]的研究类似,该作者用电子探针X射线微区分析和同步辐射X射线吸收谱分析研究受污染的农田中天然蚯蚓,电子探针结果表明蚯蚓的代谢活动有效地将金属运移到特定的亚细胞分区位点。通过以上研究,可推测当蚯蚓受到重金属的胁迫时,倾向于通过体内某个部位有效的积累和固定来使毒性得以避免。
用XAFS分析蚯蚓中重金属元素或毒性元素的配位环境,并与其它技术手段结合能够推测蚯蚓体内元素的代谢机理[60−62]。例如 Arnold 等[61]用 XAFS对铜矿区土壤(王水 Cu=(789±4) mg·kg−1)中的蚯蚓和含有 Cu的牲畜棚环境(王水 Cu=(54±1)mg·kg−1)中的蚯蚓进行研究,有三点重要发现:一是整体水平的蚯蚓、蚯蚓的后部和蚯蚓的体壁三种样品之间 Cu的形态无明显差别,并且生长于以上两种环境下和生长于人工配制土壤中蚯蚓的Cu的形态也无明显差异;二是蚯蚓样品中Cu的配位环境是 3个 S原子,Cu-S键的配位距离为0.22nm,而实验中几种土壤中Cu的EXAFS数据均显示Cu与4个O原子相连,Cu-O键长为0.19 nm;三是化学分析结果显示,对采自以上两个地区的同类型蚯蚓在完全相同的条件下培养,铜矿区土壤中生长的蚯蚓能够富集更多的Cu。
以上研究结果表明,同类型蚯蚓体内不同部分的Cu以及不同类型蚯蚓中Cu很有可能以一种形态存在,唯一不同的是在 Cu浓度高的环境下成长起来的蚯蚓能够富集更多的Cu,由此推测,这一地区的蚯蚓的代谢机理是一种可逆的生理变化而非基因结构改变导致的功能性变化。但这一推测要经过对下一代或者第三代蚯蚓进一步研究才能确证。经过蚯蚓的代谢活动之后,Cu的形态明显发生了改变,配位形式由Cu-O变成了Cu-S,推测这种S配体有可能来自金属硫蛋白[60,62],但由于缺少XANES分析的Cu的标准物质,不能就此确定Cu与金属硫蛋白复合物配位,需要进一步研究。
以上研究均表明μ-SXRF和XAFS已成功应用于蚯蚓体内元素的分布与形态分析,并且能够在低温下对蚯蚓活体或者新鲜组织样品进行分析,突破了以往技术手段蚯蚓活体分析的难题,推进了蚯蚓体内元素代谢过程研究的发展。
3 结语
大气、土壤及动植物样品中重金属和类金属等毒性元素的行为研究是目前最引人注目的研究领域之一。自从人们认识到元素形态比元素含量对生物效应的影响更为重要后,研究者更关注毒性元素的形态特征及在生态系统内的迁移规律和在生物体内的转化过程,随着研究的深入,在细胞及亚细胞水平等微尺度的研究日益迫切。同步辐射微区分析技术因其独有的特性为我们提供了微尺度的元素分布、元素形态、金属蛋白特征和金属与生物分子的代谢机理等多重信息。近30年同步辐射技术发展迅速,光源的进步、探测系统的更新换代及多种同步辐射技术的联用,使其在动植物体内重金属行为、固-液界面、矿物-水溶液、生物膜与重金属相互作用、样品微观结构等研究领域取得了显著进展,为揭示元素的迁移转化规律及产生的生物效应带来强大推动力。目前,越来越多的研究者投身这一领域,并作出卓越贡献。
但是,同步辐射微区分析技术在大气、土壤和动植物样品分析中仍存在很多难题。如光斑尺寸仍相对滞后于高分辨研究发展的需求、低含量元素的形态分析和生物样品中与金属螯合物密切相关的轻元素(如N、P、S)难以直接测定,植物鲜样和动物活体等水合样品的辐射损伤等。因此,进一步提高第三代光源的性能和第四代光源的发展成为一个必然趋势,获得更高亮度的单色光及更小的光斑尺寸;此外,新型能量探测器的改进有望进一步提高能量分辨率和探测器灵敏度。总之,未来同步辐射微区分析技术的发展将充分发挥高时间分辨率、高空间分辨率、高能量分辨率和高偏振的特性,相信随着同步辐射技术的发展,它将在大气、土壤和动植物等样品研究领域呈现出更大优势。
1 Lombi E, De Jonge M, Donner E,et al.Trends in hard X-ray fluorescence mapping: environmental applications in the age of fast detectors[J]. Analytical and Bioanalytical Chemistry, 2011, 400(6): 1637−1644
2 杨传铮, 程国峰, 黄月鸿. 同步辐射的基本知识(第一讲 同步辐射光源的原理, 构造和特征)[J]. 理化检验:物理分册, 2008, 44(1): 28−32 YANG Chuanzheng, CHENG Guofeng, HUANG Yuehong. Basic knowledge of synchrotron radiation lecture (No.1 principle, construction and characters of synchrotron radiation source)[J]. Physical Testing and Chemical Analysis Part A: Physical Testing, 44(1): 28−32
3 McRae R, Bagchi P, Sumalekshmy S,et al.In situ imaging of metals in cells and tissues[J]. Chemical Reviews, 2009, 109(10): 4780−4827
4 Majumdar S, Peralta-Videa J R, Castillo-Michel H,et al.Applications of synchrotron μ-XRF to study the distribution of biologically important elements in different environmental matrices: a review[J/OL]: http://dx.doi.org/10.1016/j.aca.2012.09.050, 2012-10-23
5 Lombi E, Hettiarachchi G M, Scheckel K G. Advanced in situ spectroscopic techniques and their applications in environmental biogeochemistry: introduction to the special section[J]. Journal of Environmental Quality, 2011,40(3): 659−666
6 Liu B, Yu P. Application of advanced synchrotron radiation–based and conventional molecular techniques in recent research on molecular structure, metabolic characteristics, and nutrition in coproducts from biofuel processing[J]. Applied Spectroscopy Reviews, 2013,48(8): 589−608
7 Qin Z, Caruso J A, Lai B,et al.Trace metal imaging with high spatial resolution: applications in biomedicine[J].Metallomics, 2011, 3(1): 28−37
8 Elder F, Gurewitsch A, Langmuir R,et al. Radiation from electrons in a synchrotron[J]. Physical Review, 1947,71(11): 829−829
9 Sokolov A, Ternov I. Synchrotron radiation[J]. Russian Physics Journal, 1967, 10(10): 39−47
10 Sarker M M. Synchrotron radiation research[N].Bangladesh, Daily Internet Edition, 1997, 6(12): 186
11 冼鼎昌. 同步辐射历史及现状[J]. 物理, 2013, 42(6):374−377 XIAN Dingchang. The history and present status of synchrotron radiation[J]. Physics, 2013, 42(6): 374−377
12 麦振洪. 同步辐射发展六十年[J]. 科学(上海), 2013,65(6): 16−21 MAI Zhenhong. The development of synchrotron radiation for sixty years[J]. Science, 2013, 65(6): 16−21
13 Morgan A, Mosselmans J, Charnock J,et al.In situ metal imaging and Zn ligand-speciation in a soil-dwelling sentinel: complementary electron microprobe and synchrotron microbeam X-ray analyses[J]. Environmental Science & Technology, 2012, 47(2): 1073−1081
14 Lehmann J, Solomon D. Organic carbon chemistry in soils observed by synchrotron-based spectroscopy[A].Singh B, Gräfe M. Developments in soil science[M]. The Netherlands: Elsevier Besloten Vennootschap, 2010:289−312
15 Liang B, Lehmann J, Solomon D,et al.Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal, 2006, 70(5):1719−1730
16 Lombi E, Susini J. Synchrotron-based techniques for plant and soil science: opportunities, challenges and future perspectives[J]. Plant and Soil, 2009, 320(1−2): 1−35
17 蒋迪奎, 陈永林, 陈丽萍, 等. 上海光源储存环真空系统[J]. 真空科学与技术学报, 2009, 29(4): 444−447 JIANG Dikui, CHEN Yonglin, CHEN Liping,et al.Vacuum system for storage ring of Shanghai Synchrotron Radidtion Facility[J]. Chinese Journal of Vacuum Science and Technology, 2009, 29(4): 444−447
18 Sarret G, Smits E, Michel H C,et al. Use of synchrotron-based techniques to elucidate metal uptake and metabolism in plants[J]. Advances in Agronomy,2013, 119: 1−82
19 Zhao F J, Moore K L, Lombi E,et al. Imaging element distribution and speciation in plant cells[J]. Trends in Plant Science, 2014, 19(3): 183−192
20 Donner E, de Jonge M D, Kopittke P M,et al.Mapping element distributions in plant tissues using synchrotron X-ray fluorescence techniques[A]. Maathuis F J M. Plant mineral nutrients: methods and protocols, methods in molecular biology[M]. Totowa: Humana Press, 2013:143−159
21 Smith P G, Koch I, Gordon R A,et al. X-ray absorption near-edge structure analysis of arsenic species for application to biological environmental samples[J].Environmental Science & Technology, 2005, 39(1):248−254
22 Gardea-Torresdey J L, Peralta-Videa J R, De La Rosa G,et al. Phytoremediation of heavy metals and study of the metal coordination by X-ray absorption spectroscopy[J].Coordination Chemistry Reviews, 2005, 249(17):1797−1810
23 Saraswat S, Rai J. Complexation and detoxification of Zn and Cd in metal accumulating plants[J]. Reviews in Environmental Science and Bio/Technology, 2011, 10(4):327−339
24 Petibois C, Guidi M C. Bioimaging of cells and tissues using accelerator-based sources[J]. Analytical and Bioanalytical Chemistry, 2008, 391(5): 1599−1608
25 Fittschen U E A, Falkenberg G. Trends in environmental science using microscopic X-ray fluorescence[J].Spectrochimica Acta Part B: Atomic Spectroscopy, 2011,66(8): 567−580
26 Lombi E, Scheckel K G, Kempson I M. In situ analysis of metal(loid)s in plants: state of the art and artefacts[J].Environmental and Experimental Botany, 2011, 72(1):3−17
27 Cho S H, Tong H, McGee J K,et al. Comparative toxicity of size-fractionated airborne particulate matter collected at different distances from an urban highway[J].Environmental Health Perspectives, 2009, 117(11):1682−1689
28 Cozzi F, Gržinić G, Cozzutto S,et al. Dimensional characterization of selected elements in airborne PM10 samples using μ-SRXRF[J]. X-ray Spectrometry, 2012,41(1): 34−41
29 MacLean L C, Beauchemin S, Rasmussen P E. Lead speciation in house dust from Canadian urban homes using EXAFS, micro-XRF, and micro-XRD[J].Environmental Science & Technology, 2011, 45(13):5491−5497
30 Walker S, Jamieson H, Rasmussen P. Application of synchrotron microprobe methods to solid-phase speciation of metals and metalloids in house dust[J]. Environmental Science & Technology, 2011, 45(19): 8233−8240
31 Yue W, Li X, Liu J,et al. Characterization of PM2.5 in the ambient air of Shanghai city by analyzing individual particles[J]. Science of the Total Environment, 2006,368(2): 916−925
32 Jiang M, Nakamatsu Y, Jensen K A,et al.Multi-scal e analysis of the occurrence of Pb, Cr and Mn in th e NIST standards: urban dust (SRM 1649a) and indo or dust (SRM 2584)[J/OL]. http://dx.doi.org/10.1016/j.atmosenv.2013.10.035, 2014
33 McNear Jr D H, Chaney R L, Sparks D L. The effects of soil type and chemical treatment on nickel speciation in refinery enriched soils: a multi-technique investigation[J].Geochimica et Cosmochimica Acta, 2007, 71(9):2190−2208
34 Flogeac K, Guillon E, Aplincourt M. Surface complexation of copper (II) on soil particles: EPR and XAFS studies[J]. Environmental Science & Technology,2004, 38(11): 3098−3103
35 Liu S H, Wang H P. In situ speciation studies of copper–humic substances in a contaminated soil during electrokinetic remediation[J]. Journal of Environmental Quality, 2004, 33(4): 1280−1287
36 Terzano R, Santoro A, Spagnuolo M,et al. Solving mercury (Hg) speciation in soil samples by synchrotron X-ray microspectroscopic techniques[J]. Environmental Pollution, 2010, 158(8): 2702−2709
37 Khaokaew S, Chaney R L, Landrot G,et al. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions[J].Environmental Science & Technology, 2011, 45(10):4249−4255
38 Strawn D G, Baker L L. Speciation of Cu in a contaminated agricultural soil measured by XAFS,μ-XAFS, and μ-XRF[J]. Environmental Science &Technology, 2007, 42(1): 37−42
39 Freeman J L, Zhang L H, Marcus M A,et al. Spatial imaging, speciation, and quantification of selenium in the hyperaccumulator plants Astragalus bisulcatus and Stanleya pinnata[J]. Plant Physiology, 2006, 142(1):124−134
40 Fukuda N, Hokura A, Kitajima N,et al. Micro X-ray fluorescence imaging and micro X-ray absorption spectroscopy of cadmium hyper-accumulating plant,arabidopsis halleri ssp. gemmifera, using high-energy synchrotron radiation[J]. Journal of Analytical Atomic Spectrometry, 2008, 23(8): 1068−1075
41 Kopittke P M, de Jonge M D, Menzies N W,et al.Examination of the distribution of arsenic in hydrated and fresh cowpea roots using two-and three-dimensional techniques[J]. Plant Physiology, 2012, 159(3): 1149−1158
42 Kopittke P M, Menzies N W, de Jonge M D,et al. In situ distribution and speciation of toxic copper, nickel, and zinc in hydrated roots of cowpea[J]. Plant Physiology,2011, 156(2): 663−673
43 Wang P, Menzies N W, Lombi E,et al. In situ speciation and distribution of toxic selenium in hydrated roots of cowpea[J]. Plant Physiology, 2013, 163(1): 407−418
44 Lombi E, Zhao F J, Fuhrmann M,et al. Arsenic distribution and speciation in the fronds of the hyperaccumulator Pteris vittata[J]. New Phytologist, 2002,156(2): 195−203
45 Webb S M, Gaillard J F, Ma L Q,et al. XAS speciation of arsenic in a hyper-accumulating fern[J]. Environmental Science & Technology, 2003, 37(4): 754−760
46 Pickering I J, Gumaelius L, Harris H H,et al. Localizing the biochemical transformations of arsenate in a hyperaccumulating fern[J]. Environmental Science &Technology, 2006, 40(16): 5010−5014
47 Pickering I J, Prince R C, George M J,et al. Reduction and coordination of arsenic in Indian mustard[J]. Plant Physiology, 2000, 122(4): 1171−1178
48 Yamaguchi N, Ishikawa S, Abe T,et al. Role of the node in controlling traffic of cadmium, zinc, and manganese in rice[J]. Journal of Experimental Botany, 2012, 63(7):2729−2737
49 Isaure M P, Fayard B, Sarret G,et al. Localization and chemical forms of cadmium in plant samples by combining analytical electron microscopy and X-ray spectromicroscopy[J]. Spectrochimica Acta Part B:Atomic Spectroscopy, 2006, 61(12): 1242−1252
50 Seyfferth A L, Webb S M, Andrews J C,et al. Arsenic localization, speciation, and co-occurrence with iron on rice (Oryza sativa L) roots having variable Fe coatings[J].Environmental Science & Technology, 2010, 44(21):8108−8113
51 Salt D E, Prince R C, Pickering I J. Chemical speciation of accumulated metals in plants: evidence from X-ray absorption spectroscopy[J]. Microchemical Journal, 2002,71(2): 255−259
52 Salt D E, Prince R C, Pickering I J,et al. Mechanisms of cadmium mobility and accumulation in Indian mustard[J].Plant Physiology, 1995, 109(4): 1427−1433
53 Spurgeon D J, Stürzenbaum S R, Svendsen C,et al.Toxicological, cellular and gene expression responses in earthworms exposed to copper and cadmium[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2004, 138(1): 11−21
54 Jones C G, Lawton J H, Shachak M. Organisms as ecosystem engineers[J]. Oikos, 1994 , 69(3): 373−386
55 Brown G G, Barois I, Lavelle P. Regulation of soil organic matter dynamics and microbial activityin the drilosphere and the role of interactionswith other edaphic functional domains[J]. European Journal of Soil Biology, 2000,36(3): 177−198
56 Lavelle P, Lattaud C, Trigo D,et al. Mutualism and biodiversity in soils[A]. Collins H P, Robertson G P, Klug M J. The significance and regulation of soil biodiversity[M]. Burlin: Springer Netherlands, 1995:23−33
57 Turbé A, De Toni A, Benito P,et al. Soil biodiversity:functions, threats and tools for policy makers[R]. Brussels:European Commission (DG Environment), 2010
58 Nahmani J, Hodson M E, Black S. A review of studies performed to assess metal uptake by earthworms[J].Environmental Pollution, 2007, 145(2): 402−424
59 Morgan A, Kille P, Bennett A,et al. Pb and Zn imaging and in situ speciation at the geogenic/biogenic interface in sentinel earthworms using electron microprobe and synchrotron micro-focus X-ray spectroscopy[J/OL].http://dx.doi.org/10.1016/j.envpol.2012.10.001, 2013
60 Cotter-Howells J, Charnock J M, Winters C,et al. Metal compartmentation and speciation in a soil sentinel: the earthworm, Dendrodrilus rubidus[J]. Environmental Science & Technology, 2005, 39(19): 7731−7740
61 Arnold B E, Hodson M E, Charnock J,et al. Comparison of subcellular partitioning, distribution, and internal speciation of Cu between Cu-tolerant and naive populations of dendrodrilus rubidus savigny[J].Environmental Science & Technology, 2008, 42(10):3900−3905
62 Langdon C, Winters C, Stürzenbaum S,et al. Ligand arsenic complexation and immunoperoxidase detection of metallothionein in the earthworm Lumbricus rubellus inhabiting arsenic-rich soil[J]. Environmental Science &Technology, 2005, 39(7): 2042−2048