大菱鲆mIgD重链基因的克隆与表达分析*
陈孔茂,唐小千,绳秀珍,邢 婧,战文斌
(中国海洋大学水产动物病害与免疫实验室,山东 青岛266003)
免疫球蛋白(Immunoglobulin,Ig)是脊椎动物B淋巴细胞在受到抗原刺激后活化、增殖、成熟后所分泌的效应性应答分子,在体液免疫防御中发挥重要作用。哺乳动物免疫球蛋白重链根据其恒定区氨基酸组成及抗原性差异,可分为γ,α,ε,μ和δ5种类型,分别相应构成IgG,IgA,IgE,IgM 和IgD[1]。相比于哺乳动物,鱼类免疫球蛋白研究起步较晚,且在很长一段时间内人们认为鱼类只存在IgM一种免疫球蛋白,随着分子生物学研究的发展,近年在鱼体上发现了IgD、IgT及IgNAR等免疫球蛋白类型[2-4]。其中,单体结构的IgD被视为最神秘的免疫球蛋白,它在机体内含量很低,抗体活性很难被检测到,其基因与蛋白结构在不同物种之间变异较大,相比其他几种免疫球蛋白而言,有关它的免疫学功能特性研究十分欠缺[5]。
鱼类IgD重链编码基因首次在斑点叉尾鮰(Ictalurus punctatus)中被发现,其转录本为嵌合体结构,以IgM的μ1区作为第一个恒定区,在基因组上的位置紧接位于IgM下游,在部分B细胞中通过选择性剪切与IgM发生共表达[6]。该发现打破了IgD仅存在于高等灵长类及啮齿类动物中的认识束缚,预示着IgD在脊椎动物免疫系统进化中起着不可预知的重要作用,使得IgD相关研究得到了广泛重视和关注[5]。近年来,多种重要经济鱼类的IgD重链基因被克隆鉴定,如鳜(Siniperca chuatsi)[7]、红 鳍 东 方 鲀 (Takifugu rubripes)[8]、庸鲽(Hippoglossus hippoglossus)[9]、大西洋鲑(Salmo salar)[10]、大西洋鳕(Gadus morhua)[11]等。通过对比研究发现,不同鱼类IgD重链的恒定区数目和重复串联方式存在较大的差异,从而使IgD分子量大小及抗原特性具有多样化[12]。尽管目前IgD在除了鸟类以外的其它物种中都有报道,但对于IgD的免疫学功能特性研究仍很欠缺,最近研究显示其可能在鱼类系统免疫监视以及免疫应答调节中起着重要作用,且其免疫应答表现出一定的组织特异性[13-14]。
大菱鲆(Scophthalmus maximus)是我国重要的海水养殖经济鱼类[15],开展其IgD的结构与免疫应答特性研究,有助于全面了解大菱鲆免疫系统防御特点,对鱼类疾病免疫防治具有一定的理论和指导意义。本研究克隆并分析了大菱鲆mIgD重链基因,利用RT-PCR检测其在各个组织器官中的表达情况,并通过实时荧光定量PCR检测了大菱鲆在注射灭活细菌后IgD的应答表达。
1 材料与方法
1.1 实验材料
实验用大菱鲆购自青岛市胶南某大菱鲆养殖场,体长为15~18cm,实验前于连续充气的大体积水槽中暂养1周。RRI、pMD-19T、Ex-Taq酶均购自 Takara公司;High Capacity cDNA Reverse Transcription Kit购于 Applied Biosystems公司;SMART cDNA Synthesis Kit购于 Clontech公司;SYBR Green Realtime PCR Master Mix试剂盒购于TOYOBO公司;琼脂糖凝胶回收试剂盒、PCR产物回收试剂盒均购自北京百泰克公司;引物由上海生工公司合成。鳗弧菌(Vibrio anguillarum)及大肠杆菌DH5α由本实验室保存。
1.2 总RNA提取及cDNA合成
取健康大菱鲆的脾组织,按照Trizol(Invitrogen)说明书抽提总RNA,通过琼脂糖凝胶电泳进行检测总RNA的完整度和纯度,RNA浓度在吸光值260nm处定量后用于反转录合成cDNA的第一链。
1.3 大菱鲆IgD cDNA全长克隆
根据GenBank获得已知鱼类IgD的序列,设计简并引物IgD Ft1和IgD Rt1(见表1)扩增IgD保守序列,根据获得的IgD保守基因片段设计3′和5′RACE特异性引物(见表1),分别与SMART cDNA Synthesis Kit内的引物UPM联合使用扩增大菱鲆IgD cDNA的3′和5′端序列。PCR反应条件为:94℃变性5min,1个循环;94℃变性30s,60℃退火30s,72℃延伸50 s,35个循环;72℃延伸10min,1个循环;4℃保存。PCR产物均用含0.5%EB的1.0%琼脂糖凝胶电泳检测片段大小,凝胶成像仪观察结果。扩增的PCR产物使用北京百泰克公司生产的凝胶回收试剂盒纯化后,克隆到pMD-19T载体,转化到大肠杆菌DH5α菌株,PCR检测阳性克隆后进行测序确认。
1.4 序列的生物信息学分析
利用 NCBI在线软件 ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)对大菱鲆IgD cDNA序列的开放阅读框进行分析,并对由cDNA序列推导获得的氨基酸序列进行蛋白质相对分子质量及理论等电点预测(http://web.expasy.org/compute_pi/),通过Smart在线软件(http://smart.embl-heidelberg.de/)预测功能结构域。使用NCBI的BLAST程序(http://www.ncbi.nlm.nih.gov/)对大菱鲆IgD 重链恒定区δ1~δ7进行同源性比对分析,并选取不同鱼类免疫球蛋白重链氨基酸序列,采用Clustal X 2.0软件进行多序列比对分析,用MEGA 4.0软件进行系统发生和进化分析,采用邻位相连法(Neighbor-joining)构建系统进化树。
1.5 RT-PCR检测IgD重链mRNA的组织分布
为了检测IgD在不同组织和器官中的表达差异,随机选取3条经暂养后的健康大菱鲆,取其外周血白细胞、鳃、肌肉、前肾、中肾、肝脏、肠、脾脏。利用Trizol法分别提取各组织总RNA。检测确认RNA完整度及纯度后,分别取1μg总RNA以 High Capacity cDNA Reverse Transcription Kit参照说明书反转录合成cDNA第一链。分别以IgD F和IgD R作为IgD目的基因的扩增引物,以β-actin F和β-actin R作为内参基因的扩增引物,PCR反应体系为25μL。PCR反应条件为:94℃变性5min,1个循环;94℃变性30s,57℃退火30s,72℃延伸50s,33个循环(内参基因为30个循环);72℃延伸10min,1个循环;4℃保存。PCR产物用含0.5%EB的1.0%琼脂糖凝胶电泳进行检测。
1.6 荧光定量PCR检测IgD对灭活鳗弧菌免疫的应答表达
将暂养后的健康大菱鲆随机分养于2个玻璃钢水槽,每组25尾。以LB液体培养基增殖鳗弧菌,离心回收菌体后经0.5%的福尔马林灭活,调整浓度至1×107cfu/mL。采用腹腔注射方式,实验组每尾注射100μL鳗弧菌灭活菌液,对照组鱼体注射等体积无菌PBS(0.01mol/L,pH=7.4)。在注射前以及注射后4、8、12、24、48h分别随机选取3尾大菱鲆,取前肾提取总RNA,检测确认RNA完整度及纯度后,分别取1μg总RNA 以 High Capacity cDNA Reverse Transcription Kit合成cDNA第一链。分别取1μL反转录产物作为模板,以qIgD F(δ7区)和qIgD R(TM 区)引物,利用SYBR Green Realtime PCR Master Mix 试 剂 盒 在Mastercycler ep Realplex(Eppendorf,Germany)PCR仪上进行荧光定量检测,每个样品设置3个重复。选择β-actin作为内参基因,扩增引物分别为β-actin F和β-actin R(见表1)。扩增条件为:95℃30s,1个循环;95℃5s,60℃30s,40个循环;95℃15s,60℃30s,95℃15s,1个循环;4℃保存。按照2-ΔΔCt法计算鱼体在免疫刺激后前肾组织中IgD基因相对表达量的变化情况,采用SPSS13.0进行数据统计分析,采用单因子方差(one-way ANOVA)分析不同时间点基因表达量的差异,以P<0.05作为差异显著的标准。
2 结果
2.1 大菱鲆IgD重链全长cDNA的克隆
以健康大菱鲆脾脏组织的总RNA为模板,利用简并引物扩增得到1条240bp的目的片段,PCR产物经TA克隆后,测序及同源比对分析显示其与鱼类IgD具有较高的同源性。根据该序列设计特异性RACE扩增引物,分别经3′和5′RACE扩增获得目的片段,经测序与序列拼接获得大菱鲆IgD cDNA全长序列(Gen-Bank登陆号:JX235360)。该基因全长3 357bp,5′非编码区(Untranslated region,UTR)为28bp,3′UTR为332bp,包含一个2 997bp的开放阅读框,编码999个氨基酸(见图1)。

图1 大菱鲆mIgD重链基因cDNA序列与推测的氨基酸序列Fig.1 cDNA sequence and deduced amino acid sequence of mIgD heavy chain in S.maximus
2.2 大菱鲆IgD重链编码氨基酸序列分析
通过大菱鲆IgD重链氨基酸组成序列分析得知,其理论等电点为5.73,理论分子量为110kDa,在成熟肽中丝氨酸所占比例最高(11.5%),其次为苏氨酸(8.2%)和亮氨酸(7.8%)。通过对其氨基酸编码的结构域分析显示,其由可变区和恒定区两部分组成,可变区具有典型的 V-D-J基因结构,恒定区先后由μ1、δ1-δ2-δ3-δ4-δ5-δ6-δ7和跨膜区(Transmembrane,TM)组成,由此确定该基因为膜结合型免疫球蛋白D(Membrane-bounded Ig,mIgD)重链编码基因(见图1)。
利用大菱鲆mIgDδ1~δ7区氨基酸序列进行同源搜索,结果显示其与庸鲽 (78%)、鳜 (71%)、牙鲆(Paralichthys olivaceu)(68%)、斜 带 石 斑 鱼 (Epinephelus coioides)(62%)、红鳍东方鲀(58%)IgD 重链相应恒定区具有较高的同源性,并在此基础上对各个δ区之间的相似度进行了比较(见表2)。将大菱鲆mIgD的δ1~δ7区域与以上几种鱼类IgD相应区域进行多序列比对,结果显示大菱鲆mIgD每个δ恒定区内均具有高度保守的半胱氨酸与色氨酸位点(见图2)。另外,利用邻位相连法构建了包括大菱鲆mIgD在内的20不同硬骨鱼类免疫球蛋白重链恒定区的系统发育树,结果显示IgM与IgD各自分别聚为一大支,IgZ与IgT聚为一大支,其中大菱鲆mIgD与庸鲽及牙鲆IgD聚为一小支(见图3)。

表2 大菱鲆与其他鱼类IgDδ恒定区氨基酸序列的相似性比较Table 2 Similarity comparisons of IgDδconstant regions between S.maximus and other fish species
2.3 IgD重链mRNA的组织分布
以β-actin基因作为内参,利用RT-PCR方法检测了IgD重链编码mRNA在大菱鲆不同组织内的表达丰度差异。结果显示,其除了未在肌肉中检测到之外,在外周血白细胞、脾脏、前肾、中肾、鳃、肝脏及肠道组织中均有不同程度的表达,其中在外周血白细胞、脾脏、前肾及中肾组织中表达量较高(见图4)。
2.4 灭活鳗弧菌免疫大菱鲆后mIgD重链基因的应答表达
以β-actin基因作为内参,利用跨膜区特异性引物进行荧光定量PCR,检测了大菱鲆在免疫灭活鳗弧菌后前肾组织内mIgD重链基因的相对表达量变化。结果显示,在免疫鳗弧菌后mIgD重链基因呈现显著表达下调,在免疫后8h时mIgD重链基因下调至最低水平(P<0.05),相对表达量约为对照组的1/28,然后呈逐渐回复上调趋势,在免疫后48h时免疫组mIgD相对表达量与对照组无显著差异(P>0.05)(见图5)。
3 讨论
不同鱼类IgD的重链基因在结构上存在很大的差异,但是根据目前对鱼类IgD重链基因结构研究发现,绝大多数鱼体的IgD重链基因均包含VH、DJ区、μ1区和若干个δ恒定区,在此基础上根据IgD存在形式的不同,在mIgD重链δ恒定区后接有TM区,而在sIgD重链δ恒定区后接有一小段分泌肽[12,16]。但是,最近也有研究发现在斑点叉尾鮰中存在VH区缺失型的sIgD分子,推测其可能行使着作为模式识别分子的一种较为原始的免疫功能,预示着IgD在特异性免疫和非特性免疫中均起着一定作用[16]。除了TM区和分泌肽的差异以外,鱼类IgD重链的δ恒定区组成数目和重复串联方式也存在很大的差异。例如,大西洋鲑、大西洋庸鲽、斑点叉尾鮰和草鱼(Ctenopharyngodon idellus)的 mIgD 重 链 结 构 均 为 VDJ-μ1-δ1-(δ2-δ3-δ4)2-δ5-δ6-δ7-TM,其中δ2-δ3-δ4存在一次复制[6,9,17];红鳍东方鲀 mIgD 重 链结构 为 VDJ-μ1-(δ1-δ2-δ3-δ4-δ5-δ6)2-δ7-TM,其 中 δ1-δ2-δ3-δ4-δ5-δ6 存 在 一 次 复制[18];虹鳟(Oncorhynchus mykiss)mIgD 重链结构为VDJ-μ1-δ1-δ2a-δ3a-δ4a-δ2b-δ7-TM,δ4后存在一次 δ2复制,且出现δ5-δ6的缺失现象[19];而大西洋鳕 mIgD基因结构比较特殊,为 VDJ-μ1-δ1A-δ2A-δy-δ1B-δ2B-δ7-δM1-δM2,出现δy将δ1与δ2复制分开[11]。本文克隆获得的大菱鲆mIgD重链基因结构与牙鲆、鳜的mIgD结构比较相似也相对简单,不存在外显子复制现 象,为 VDJ-μ1-δ1-δ2-δ3-δ4-δ5-δ6-δ7-TM[2,7]。通 过将大菱鲆mIgD与其它硬骨鱼IgD重链恒定区氨基酸序列比对发现,恒定区中的每个δ区均存在多个色氨酸与半胱氨酸的保守位点,色氨酸对免疫球蛋白空间结构的形成及功能起着重要作用,而半胱氨酸形成二硫键,对形成与维持免疫球蛋白的空间结构起着决定性的作用[5]。

图2 大菱鲆mIgD与其它硬骨鱼IgD重链恒定区氨基酸序列的多序列比对Fig.2 Multiple alignment of the deduced amino acid sequence of mIgD heavy chain delta domain in S.maximus with those of the other teleosts
鱼类IgD的表达具有一定的组织特异性,但是不同鱼体之间仍表现出一定差异性。牙鲆IgD主要在外周血中表达,其含量显著高于前肾、中肾及脾脏组织,而在肝脏与心脏内未检测到表达[2];鳜IgD在外周血白细胞和前肾中的表达量较高,其次为胸腺、脾脏和中肾,而在心脏、肠、鳃、肝脏和脑中几乎没有检测到表达[7]。本文结果显示,大菱鲆IgD基因表达量在外周血白细胞中最高,其次是脾脏、前肾及中肾,且在鳃、肠道及肝脏组织内也有IgD表达。上述研究IgD组织分布的RT-PCR扩增目的片段均为IgD的δ恒定区,因此无法具体区分mIgD及sIgD的组织差异表达情况。然而,根据IgD跨膜区及分泌肽尾编码序列设计特异性引物对虹鳟mIgD和sIgD分别进行的组织分布研究,显示虹鳟mIgD和sIgD除了在脾脏、外周血及肾脏内具有较高的表达以外,在鳃组织内检测到sIgD具有较高的表达量,推测鱼类IgD在鳃组织免疫防御中起着重要作用[14]。本研究在大菱鲆鳃组织内检测到较高的IgD表达量,但在大菱鲆体内是否存在sIgD仍需进一步研究。

图3 硬骨鱼类免疫球蛋白序列进化树Fig.3 Phylogenetic tree constructed based on 20 different immunoglobulins of teleost fish

图4 大菱鲆IgD重链mRNA在各组织中分布情况Fig.4 Distribution of mRNA of IgD heavy chain in different tissues of S.maximus
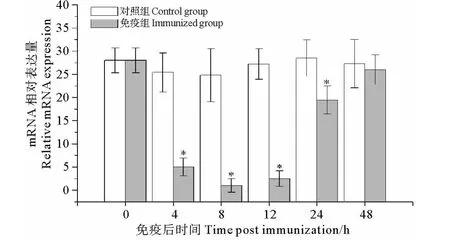
图5 大菱鲆在免疫灭活鳗弧菌后前肾组织中mIgD重链基因应答表达分析Fig.5 Time-course expression analysis of mIgD heavy chain in pronephros in response to the immunization with formalin inactivated V.anguillarum
目前,有关鱼体IgD对免疫刺激的应答研究较少,仅在鳜中开展了免疫灭活柱状黄杆菌(Flavobacterium columnare)后的IgD应答研究,结果显示鳜IgD重链基因在免疫后第3周在前肾和脾脏内表达量显著上调,该表达调控类似于鱼体分泌性IgM对抗原免疫刺激后的应答[20]。然而,在人体和小鼠研究中发现,mIgD与mIgM共表达于成熟的幼稚B细胞表面,当幼稚B细胞受到免疫原刺激,mIgD表达会发生快速下调[21-22]。最近研究也表明,IgD作为B细胞受体在B细胞发育、细胞间信号传递及刺激诱导其他免疫细胞分泌细胞因子中起着重要作用[23-24]。本研究发现,大菱鲆在免疫灭活鳗弧菌后,前肾组织中mIgD表达出现了快速显著下调,在免疫后8h时表达量下降至最低水平,仅为对照组的1/28,然后逐渐恢复至正常水平。另外,通过对虹鳟鱼B细胞表面mIgD丰度研究发现,在外周B淋巴细胞表面mIgD丰度存在高低差异分布[14]。因此,推测鱼类IgD在免疫信号传导及体液免疫防御中可能起着重要作用。
[1] Roitt I,Brostoff J,Male D.Immunology [M].Fifth Edition.London:Mosby,1998:71-78.
[2] Hirono I,Nam B H,Enomoto J,et al.Cloning and characterisation of a cDNA encoding Japanese flounder IgD [J].Fish and Shellfish Immunology,2003,15:63-70.
[3] Zhang Y A,Salinas I,Sunyer J O.Recent findings on the structure and function of teleost IgT [J].Fish and Shellfish Immunolo-gy,2011,31:627-634.
[4] Diaz M,Stanfield R L,Greenberg A S,et al.Structural analysis,selection,and ontogeny of the shark new antigen receptor (Ig-NAR):identification of a new locus preferentially expressed in early development[J].Immunogenetics,2002,54:501-512.
[5] Preud’homme J L,Petit I,Barra A,et al.Structural and functional properties of membrane and secreted IgD [J].Molecular Immunology,2000,37:871-887.
[6] Wilson M,Bengten E,Miller N W,et al.A novel chimeric Ig heavy chain from a teleost fish shares similarities to IgD [J].Proceedings of the National Academy of Sciences USA,1997,94:4593-4597.
[7] 王改玲,骆彦萍,孙宝剑,等.鳜免疫球蛋白D重链基因的克隆与表达分析 [J].中国水产科学,2011,17:11-20.
[8] Saha N R,Suetake H,Kikuchi K,et al.Fugu immunoglobulin D:a highly unusual gene with unprecedented duplications in its constant region[J].Immunogenetics,2004,56:438-447.
[9] Hordvik I.Identification of a novel immunoglobulinδtranscript and comparative analysis of the genes encoding IgD in Atlantic salmon and Atlantic halibut[J].Molecular Immunology,2002,39:85-91.
[10] Hordvik I,Thevarajan J,Samdal I N,et al.Molecular Cloning and Phylogenetic Analysis of the Atlantic Salmon Immunoglobulin D Gene[J].Scandinavian Journal of Immunology,1999,50:202-210.
[11] Stenvik J,J rgensen T.Immunoglobulin D (IgD)of Atlantic cod has a unique structure[J].Immunogenetics,2000,51:452-461.
[12] Edholm E S,Bengten E,Wilson M.Insights into the function of IgD [J].Developmental and Comparative Immunology,2011,35:1309-1316.
[13] Sun Y Z,Wei L,Zhao Y,et al.The immunoglobulin gene in jawed vertebrates:a comparative overview [J].Developmental and Comparative Immunology,2011,35:975-981.
[14] Francisco R G,Greene W,Rego K,et al.Discovery and characterization of secretory IgD in rainbow trout:secretory IgD is produced through a novel splicing mechanism [J].The Journal of Immunology,2012,188:1341-1349.
[15] 雷霁霖,刘新富,孟振.发挥产业技术体系优势做强鲆鲽类工厂化养殖 [J].中国水产,2010(6):11-13.
[16] Bengtén E,Quiniou S M,Stuge T B,et al.The IgH Locus of the channel catfish,Ictalurus punctatus,contains multiple constant region gene sequences:different genes encode heavy chains of membrane and secreted IgD [J].The Journal of Immunology,2002,169:2488-2497.
[17] Xiao F S,Wang Y P,Yan W.Ig heavy chain genes and their locus in grass carp Ctenopharyngodon idella[J].Fish and Shellfish Immunology,2010,29:594-599.
[18] Saha N R,Suetake H,Kikuchi K,et al.Fugu immunoglobulin D:a highly unusual gene with unprecedented duplications in its constant region[J].Immunogenetics,2004,56:438-447.
[19] Hansen J D,Landis E D,Ruth B P.Discovery of a unique Ig heavy-chain isotype (IgT)in rainbow trout:Implications for a distinctive B cell developmental pathway in teleost fish[J].Proceedings of the National Academy of Sciences USA,2005,102:6919-6924.
[20] Tian J Y,Sun B J,Luo Y P.Distribution of IgM,IgD and IgZ in mandarin fish,Siniperca chuatsi lymphoid tissues and their transcriptional changes after Flavobacterium columnare stimulation[J].Aquaculture,2009,288:14-21.
[21] Paul W E.Fundamental Immunology[M].Sixth Edition.Philadelphia:Lippincott Williams and Wilkins,2008:270-289.
[22] Monroe J G,Havran W L,Cambier J C.B lymphocyte activation:Entry into cell cycle is accompanied by decrease expression of IgD but not IgM [J].European Journal of Immunology,1983,13:208-213.
[23] Lutz C,Ledermann B,Kosco-V M H,et al.IgD can largely substitute for loss of IgM function in B cells[J].Nature,1998,393:797-801.
[24] Chen K,Xu W,Wilson M,et al.Immunoglobulin D enhances immune surveillance by activating antimicrobial,proinflammatory and B cell-stimulating programs in basophils[J].Nature Immunology,2009,10:889-898.

