农杆菌介导的转拟南芥AtCHX23基因玉米及其耐盐性
岳润清, 铁双贵, 韩小花, 齐建双, 燕树锋, 林 鸿, 徐玉隔, 刘 芳
(1.河南省农业科学院粮食作物研究所,河南省玉米生物学重点实验室,河南 郑州 450002;2.郑州大学生物工程系,河南郑州 450001;3.河南师范大学生命科学学院,河南 新乡 453007)
土壤盐渍化是严重影响农业生产和生态环境的因素之一,全球约20%的耕地和将近一半的灌溉土地遭受盐渍化影响[1]。中国现有盐碱地9.913×108hm2,每年因盐碱地造成的农业直接损失达数百亿元[2]。玉米是中国第二大作物,可以用作粮食、饲料和工业原料等,是中国畜牧养殖业的支柱。然而,玉米对盐分中度敏感,耐盐性相对较差,这极大地限制了其种植面积的扩大。由于缺乏耐盐玉米种质,严重限制了玉米耐盐性的遗传研究和耐盐玉米新品种的选育。
基因工程的迅速发展与完善,为人类进一步提高作物的抗逆性提供了新的策略和强有力工具[3-4]。而利用基因工程遗传转化技术对作物进行改良,培育耐盐性转基因玉米新品种已经成为在盐碱地上种植玉米的有效途径之一[5]。国内外学者克隆了一些和耐盐相关的基因,并进行遗传转化,获得了一些耐盐性较高的转基因玉米新材料。Zhang等[6]和 Li等[7]将TsCBF1基因导入玉米自交系中,显著提高了玉米抗旱或耐盐能力。Chen等[8]将OsNHX1基因成功转入玉米中,转基因玉米耐盐性得到提高。杨爱芳等[9]将来自大肠杆菌胆碱脱氢酶基因betA转入玉米骨干自交系中,批量获得了转基因植株,从其后代中选育出耐盐性大幅度提高的抗除草剂自交系。任小燕等[10]采用超声波辅助花粉介导法将山菠菜胆碱单加氧酶AhCMO基因转入玉米中,获得耐盐性提高的玉米新材料。王奕等[11]把耐盐基因DREB2A转入玉米自交系H99以及杂交种H99xA188,获得转基因阳性植株。这些研究结果表明采用基因工程技术培育玉米耐盐品种是可行的。转基因技术通过种属间基因的流动弥补了玉米遗传资源的不足,与常规育种结合必将带来育种上的重大突破,它是农业生物技术的核心领域,并将成为作物育种的一种重要手段。
拟南芥CHX23基因是Song等[12]从拟南芥中克隆出的一个在植物抗盐胁迫反应中起重要作用的基因,将其转入烟草中后获得了耐盐转基因烟草植株。本研究通过PCR方法试图克隆拟南芥AtCHX23基因,构建植物组成型高效表达载体,并通过农杆菌介导法将其转到玉米自交系郑58中,对转基因玉米耐盐性进行初步研究,为培育转基因耐盐玉米提供依据。
1 材料与方法
1.1 材料
拟南芥为哥伦比亚生态型,为河南省玉米生物学重点实验室保存。玉米转基因受体郑58为河南省农业科学院粮食作物研究所提供,开花后12~14 d的玉米幼胚用于遗传转化。
各种限制性内切酶、T4连接酶、DNA聚合酶、反转录试剂盒等均购自 TaKaRa公司。农杆菌GV3101和DH5a由河南省玉米生物学重点实验室保存;植物表达载体pGreen-0229为河南大学提供。DIG high primer DNA labeling and detection starter kit I为Roche产品;其他药品、试剂均为分析纯,购自上海生工生物工程有限公司。所用引物由上海生工生物工程有限公司合成。
1.2 试验方法
1.2.1AtCHX23基因的克隆与植物表达载体的构建 从拟南芥基因组中克隆AtCHX23基因(上游引物:5'-ATACTCGAGATGTCTTCCGGAGCCCCC-3';下游引物:5'-TGTAAGCTTTTACCTATGAATTCCATATTGATGAT-3'),构建到植物表达载 pGreen-0229载体上,16℃ 过夜连接,将构建的重组质粒pGreen-0229-AtCHX23转化到大肠杆菌DH5α,对获得的重组质粒进行酶切,PCR鉴定。其中35S组成型高表达启动子控制AtCHX23基因的表达,Bar基因标记基因为筛选标记。
1.2.2 玉米的遗传转化及抗性植株的分子鉴定玉米幼胚的遗传转化参照刘允军[13]的方法,通过冻融法将表达载体导入农杆菌GV3101。在筛选培养基上添加双丙胺膦筛选抗性苗,将获得的抗性苗进行炼苗移栽。植物DNA提取按照改良后Saghai-Maroof等[14]提出的CTAB方法进行,以转基因和野生型植株玉米叶片的全基因组DNA为模板,根据AtCHX23序列特异引物(上游引物:5'-CTACTATCTAACCCGACCCTTG-3';下游引物:5'-AAAGAAGCAAACCCAAAAAC-3')检测转基因株系。将通过PCR筛选出的其中2个阳性转基因株系进行Southern blot试验鉴定。玉米基因组DNA经BamH I酶切后,电泳转膜,利用标记试剂盒(Primer-a-gene Labeling System Promega,USA)和 α-32P-dCTP(上海生工生物工程有限公司)进行标记[15],整个试验过程在浙江大学植物生理与生化重点实验室完成。
转基因植株的RNA提取以及RT-PCR检测:取0.1 g新鲜玉米叶片,液氮充分研磨后,用Trizol(Invitrogen,USA)提取叶片总RNA,以Oligo(dT)为引物(北京天根生化科技有限公司),利用反转录试剂盒(Invitrogen,USA)进行cDNA的合成后,按照上述基因组DNA的PCR检测方法进行扩增。
1.2.3 盐胁迫处理及玉米幼苗生理指标的测定 选取健康、大小、饱满度一致的郑58非转基因玉米种子,用10 g/L次氯酸钠溶液消毒20 min,清水洗净后于室温下清水浸种6 h,然后将其置于铺有两层滤纸的培养皿中,于培养箱中发芽,其间及时补充清水保持湿度。3 d后,挑选芽期生长状况良、长势一致、且PCR检测阳的幼苗,转移至150 mmol/L NaCl的Hoagland营养液中进行盐胁迫处理[10],每天按此浓度浇灌。7 d后,取玉米叶片进行检测。叶片可溶性糖(WSS)含量的测定采用蒽酮法;游离脯氨酸(Pro)含量的测定采用磺基水杨酸法;丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法[16]。每个分析样本取10株进行测定,重复3次,取其平均值。
2 结果
2.1 AtCHX23基因的克隆和载体构建
根据AtCHX23基因DNA序列设计引物,采用PCR方法从拟南芥基因组扩增2.6 kp DNA片段,连接到T载体,经测序和Blast验证,扩增片段确实为AtCHX23基因序列,采用XhoI和XbaI分别对TAtCHX23和 pGreen0229载体进行双酶切,过夜连接。得到植物表达载体pGreen0229-35S-AtCHX23。测序结果显示,AtCHX23基因正确插入CaMV35S启动子和终止子之间。
2.2 转AtCHX23基因玉米植株的获得
取授粉后10~14 d的玉米穗进行剥胚,以大小为1.0~2.0 mm的幼胚作为外植体,通过农杆菌介导法将AtCHX23基因导入优良自交系郑58中,经过双丙胺膦(Bar基因3.0 mg/L)的筛选、愈伤组织分化、再生苗的生根和壮苗培养(图1),共获得56株具有双丙胺膦抗性的T0代玉米再生植株。

图1 玉米转基因植株的再生Fig.1 Regeneration of transgenic maize plants
为了检测再生玉米基因组中是否有AtCHX23基因的插入,以AtCHX23基因特异引物进行PCR扩增检测,阳性植株扩增出与质粒相同大小的片段,而受体对照植株未扩增出相应片段,可以初步证明外源基因已经整合到玉米基因组中(图2)。从图2我们可以也看出PCR共检测得到26株阳性植株,抗性植株阳性率为44.8%。3次重复结果一致。26株阳性植株是从6个不同的抗性愈伤组织块得到的,因此我们可以初步认为有6个独立的T0代阳性转基因株系,选取其中2个长势比较好株系,命名为Ov1和Ov3,用于下一步分子检测和抗性鉴定试验。
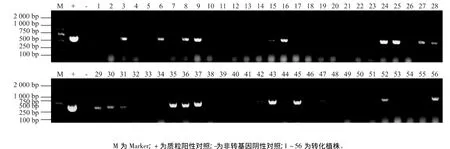
图2 T0代转基因抗性植株的PCR检测Fig.2 PCR analysis of T0 transgenic maize plants
2.3 转基因玉米植株的分子检测
为了进一步确定外源基因的整合情况,对PCR阳性株系Ov1和Ov3植株进行Southern blot分析,提取叶片基因组DNA用BamH I酶切后,以Bar基因片段为探针进行杂交,杂交结果显示,这2个PCR阳性株系可以检测到杂交条带(图3A),仍表现为阳性,并且每个株系杂交条带只有一条,位置不同,而野生型(WT)中没有检测到杂交信号,表明Ov1和Ov3为2个独立的阳性转基因株系,在这2个株系中AtCHX23基因以单拷贝形式成功整合到玉米基因组。
提取Ov1和Ov3株系叶片的总RNA,利用RTPCR方法分析转基因株系中外源基因AtCHX23的转录情况。结果显示,以这2个转化植株的cDNA为模版,以AtCHX23基因的特异引物进行PCR扩增均有阳性条带出现,并且这2个转基因玉米株系中AtCHX23基因的表达水平比较高,而对照株系没有扩增出相应条带,表明在这2个阳性株系中外源基因AtCHX23过量表达(图3B)。
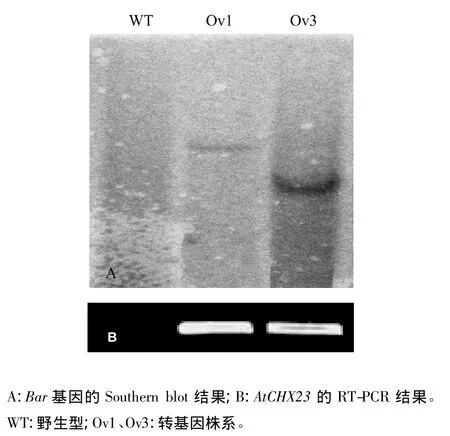
图3 2个玉米转基因株系的Southern blot(A)和RT-PCR(B)分析Fig.3 Analysis of two transgenicmaize lines by Southern blot(A)and RT-PCR(B)
2.4 转基因玉米的耐盐性分析
取转AtCHX23基因的Ov1和Ov3 2个株系的T3代植株进行耐盐性分析,首先对其芽苗进行PCR检测,转基因苗全部为阳性,说明T3代转基因株系已经纯合,部分PCR检测结果如图4A。盐胁迫处理3 d后,转基因玉米株系和对照株系的生长差异较小;但随着盐胁迫处理时间的增长,处理7 d后,Ov1和Ov3这2个转基因玉米株系已明显优于野生型玉米(图4B)。野生型植株大部分叶子卷曲、叶尖变黄,严重的植株全部变黄卷曲死亡;盐胁迫下,转基因植株也受到一定影响,部分叶尖出现卷曲变黄,但2个转基因株系Ov1和Ov3长势优于野生型。另外,在无盐胁迫的状态下,转AtCHX23基因的2个株系Ov1、Ov3和野生型植株之间没有明显的生长差异(图4C)。由此可见,AtCHX23基因的转入能够提高玉米苗期的耐盐性。
2.5 盐胁迫下转基因玉米生理生化指标的变化
为了验证AtCHX23基因的过量表达是否影响玉米中可溶性糖、脯氨酸和丙二醛含量,对处理10 d野生型和2个转基因株系(Ov1和Ov3)地上部可溶性糖、脯氨酸和丙二醛含量进行检测。非盐胁迫条件下,野生型和2个转基因株系中可溶性糖、脯氨酸和丙二醛的含量基本无显著差异,但在150 mmol/L NaCl处理下,转基因玉米株系和野生型的可溶性糖和脯氨酸含量都有增长趋势,其中2个转基因株系中可溶性糖含量分别达到46.9μg/g和44.5μg/g,分别是野生型的1.26和1.28倍,提高了27.9%和26.1%;2个转基因株系中脯氨酸含量与野生型相比,分别提高了33.5%和34.6%(图5);但2个转基因株系中丙二醛含量低于野生型,野生型株系丙二醛含量为12.66μmol/g,Ov1和Ov3 2个转基因株系丙二醛含量分别为7.90μmol/g和8.38 μmol/g,2个转基因株系中丙二醛含量比野生型分别减少了37.6%和33.8%(图5)。
3 讨论

图4 转基因玉米和野生型幼苗在NaCl处理7 d后的植株表现特征Fig.4 Phenotypes of transgenic and wild-typemaize seed lings under NaCl treatment for seven days

图5 野生型和转基因株系在0和150 mmol/L NaCl处理下可溶性糖、脯氨酸和丙二醛的含量Fig.5 Soluble sugar,protein and methane dicarboxylic aldehyde contents of maize seedlings of wild type and two transgenic lines under 0 and 150 mmol/L NaCl treatments
近年来,用于转基因玉米遗传转化方法很多:有超声波处理花粉介导法[10]、基因枪法[17-18]和农杆菌介导方法[19-21]等。农杆菌作为一种天然的植物基因转化系统,具有能转移较大的DNA片段、整合的外源基因重排少且多以单或寡拷贝整合并能稳定遗传等优点,在玉米遗传转化中应用最多。孙传波等[22-23]通过农杆菌介导法将耐盐基因HAL1转入到玉米自交系H99中,获得再生植株。Zhang等[6]采用农杆菌介导法将TsCBF1基因导入玉米中,并且在其后代中表达。Assem[24]将NPK1基因与Bar基因结合后用农杆菌介导法转化到玉米自交系中。Wang[25]利用农杆菌介导法在转基因玉米中进行ZmPLC1基因正、反方向表达,并由Southern杂交证实ZmPLC1基因已整合到玉米基因组中。这些研究说明应用农杆菌介导方法转化外源DNA可以得到玉米抗旱新资源,是一种可行、有效的抗旱育种方法。我们通过河南省玉米生物学重点实验室建立并优化的农杆菌介导的方法将拟南芥AtCHX23基因导入郑单958的优良亲本自交系材料郑58中,经过共培养、恢复培养和3次除草剂筛选后,共获得转化植株56株,通过PCR初步鉴定,其中26株呈阳性,抗性植株阳性率为44.8%;通过对转基因株系进行分子鉴定、转录表达分析及 Southern blot鉴定,获得了以单拷贝的形式成功插入到玉米基因组中且AtCHX23基因过量表达的2个玉米株系,证明外源基因AtCHX23已经整合到郑单958的优良亲本自交系材料郑58中。这些研究结果表明利用基因工程向栽培植物导入外源目的基因,已发展成为改良玉米耐盐性的新途径。
关于AtCHX23耐盐性研究,在拟南芥和烟草方面已经得到证明,超表达AtCHX23的拟南芥和烟草植物,抗盐性均比对照提高20%[12]。本试验结果表明过量表达AtCHX23基因能提高转基因玉米的耐盐性。前人研究结果表明当NaCl浓度为150 mmol/L时,郑58幼苗植株能表现出受害症状[10]。因此本试验选择150 mmol/L作为玉米苗期耐盐处理浓度。在本研究中,正常情况下,转基因株系和野生型间生长无明显差异,但在盐胁迫下,玉米幼苗受到一定的影响,包括转基因植株,部分叶尖出现卷曲变黄,但与野生型相比,转基因株系生长优势明显。由此可见,AtCHX23基因的转入能够提高转基因玉米的耐盐性。
研究结果表明:玉米幼苗在盐胁迫下,无论生长发育状况和生理生化指标都受到很大影响[26]。本试验在正常情况下,非转基因和转基因株系中可溶性糖、脯氨酸和丙二醛的含量无显著差异;盐胁迫下,2个转基因玉米株系的可溶性糖、脯氨酸含量高于非转基因玉米,转耐盐基因玉米株系Ov1和Ov3的可溶性糖含量为野生型的1.26和1.28倍,而相应地2个转基因株系脯氨酸含量为野生型的1.33倍和1.35倍;转基因玉米株系可溶性糖、脯氨酸含量的提高可能因为AtCHX23基因的过量表达可以起到稳定细胞膜和原生质作用所致[27],是转基因玉米适应盐胁迫下的一种生理调控防御反应机制,这与Lutts等[28]的研究结果是相对应的;与可溶性糖、脯氨酸含量变化不同的是:转基因玉米株系Ov1和Ov3地上部丙二醛含量均低于非转基因对照,其原因可能是由于AtCHX23基因的大量表达降低了转基因植物在盐胁迫下膜脂的抗氧化能力,提高了植物组织的保护能力。本试验证明过量表达AtCHX23基因能提高转基因玉米苗期的耐盐性,而关于AtCHX23基因在玉米盐胁迫中的表达调控功能有待进一步研究。
[1] MUNNS R,TESTER M.Mechanisms of salinity tolerance[J].Annual Review of Plant Biology,2008,59:651-681.
[2] ZHANG J F,FANG Y F,MAKESCHIN F,et al.Agroforestry and its application in amelioration of saline soils in Eastern China Coastal Region[J].Forestry Studies in China,2004,6(2):27-33.
[3] 黄 铜,莫正海,李 卉,等.延长观赏植物花期的技术措施[J].江苏农业科学,2012,40(10):168-170.
[4] 洪学钦,金 刚,代建国,等.塔胞藻基因工程的抗生素筛选标记[J].江苏农业科学,2012,40(8):49-51.
[5] YAMAGUCHIT,BLNM W E.Developing salt-tolerant crop plants:challenges and opportunities[J].Trends Plant Sci,2005,10(12):615-620.
[6] ZHANG S J,LIN,GAO F,et al.Over-expression ofTsCBF1gene confers improved drought tolerance in transgenic maize[J].Molecular Breeding,2010,26(3):455-465.
[7] LIB,LIN,DUAN X G,et al.Generation of marker-free transgenicmaize with improved salt tolerance using the FLP/FRT recombination system[J].Journal of Biotechnology,2010,145:206-213.
[8] CHEN M,CHEN Q J,NIU X G,et al.Expression ofOsNHX1gene in maize confers salt tolerance and promotes plant growth in the field[J].P1ant Soil Environ,2007,53(11):490-498.
[9] 杨爱芳,张可炜,尹小燕,等.转基因耐盐玉米自交系的农艺性状及杂种优势表现 的分析[J].中国农业科学,2007,40(12):2895-2902.
[10] 任小燕,杜建中,孙 毅.转AhCMO基因玉米后代的获得及耐盐性鉴定[J].分子植物育种,2013,11(3):332-338.
[11] 王 奕,任 贤,于志晶,等.农杆菌介导法将DREB2A基因转入玉米[J].分子植物育种,2013,11(1):48-52.
[12] SONG C P,GUO Y,QIU Q S,et al.A probable Na+/K+/H+exchanger on the chloroplast envelope functions in pH homeostasis and chloroplast development inArabidopsis thaliana[J].PNAS,2004,101(27):10211-10216.
[13] 刘允军.人工改造的cry1Ac、cry1Ie基因在大肠杆菌、转基因烟草和玉米中的表达[M].北京:中国农业大学,2004.
[14] SAGHAI-MAROOFM A,SOLIMAN K M,JORGENSEN R A,et al.Ribosomal DNA spacer-length polymorphisms in Barley:Mendelian inheritance,chromosomal location and population dynamics[J].Proceedings of the National Academy of Science,1984,81(24):8014-8018.
[15] YUE RQ,WANG X F,CHEN JY,et al.A rice stromal processing peptidase regulates chloroplast and root development[J].Plant Cell Physiol,2010,51(3):475-485.
[16] 杨 升,张华新,张 丽.植物耐盐生理生化指标及耐盐植物筛选综述[J].西北林学院学报,2010,25(3):59-65.
[17] GORDON-KAMM W J,SPENCER TM,MANGANO M L,et al.Transformation of maize cells and regeneration of fertile transgenic plants[J].Plant Cell,1990,2(7):603-618.
[18] WAN Y,WIDHOLM JM,LEMAUX P G.Type I callus as a bombardment target for generating fertile transgenic maize(Zea maysL.)[J].Planta,1995,196(1):7-14.
[19] ISHIDA Y,SAITO H,OHTA S,et al.High eficiency transforma-tion of maize(Zea maysL.)mediated byAgrobacterium tumefaciens[J].Nat Biotechno1,1996,14(6):745-750.
[20] ZHAO Z Y,GUW,CAIT,et al.High throughputgenetic transformation mediated byAgrobacterium tumefaciensin maize[J].Mol Breeding,2001,8(4):323-333.
[21] FRAME B R,SHOU H,CHIKWAMBA R K,et al.Agrobacterium tumefaciens-mediated transformation of maize embryos using a standard binary vector system[J].Plant Physio1,2002,129(1):13-22.
[22] 孙传波,曲文利,姜志磊,等.农杆菌介导向玉米茎尖导入HAL1基因的初步研究[J].玉米科学,2009,17(6):32-34.
[23] 孙传波,郭 嘉,陶 蕊,等.农杆菌介导法将耐盐基因HAL1转入玉米自交系H99的研究[J].分子植物育种,2011(9):1162-1166.
[24] ASSEM SK.Genetic transformation of the nicotiana protein kinase(NPK1)gene confers osmotic tolerance in Egyptian maize[J].Australian Journal of Basic and Applied Sciences,2009,3(2):828-835.
[25] WANG CR.Enhaneed expression of phospholipase C1(ZmPCL)improves drought tolerance in transgenicmaize[J].Planta,2007,227(5):1127-1140.
[26] 王丽燕,赵可夫.玉米幼苗对盐胁迫的生理响应[J].作物学报,2005,31(2):264-266.
[27] 卢静君,李 强,多立安.盐胁迫对金牌美达丽和猎狗种子萌发的影响[J].植物研究,2002,22(3):328-332.
[28] LUTTSS,KINET JM,BOUHARMONT J.Effects of salt stress on growth,mineral nutrition and proline accumulation in relation to osmotic adjustment in rice(Oryza sativeL.)cultivars deffering in salinity resistance[J].Plant Growth Regul,1996(19):207-218.

