重型颅脑损伤患者早期肠内营养支持的相关性研究
翟丽萍 王爱萍 苏隽 王雅宁
重型颅脑损伤(severe head injury,SHI)已经成为一种常见的急性创伤[1],尽管颅脑损伤的救治手段和水平在不断提高,但SHI的病死率仍高达30%以上[2]。在SHI患者的治疗过程中,正确的营养支持治疗有助于恢复机体内环境稳定和重要内脏器官的功能,改善预后[3]。20世纪70年代后肠内营养(enteral nutrition,EN)逐步受到临床医师的重视和推崇,它除营养以外的治疗作用得到了深入研究和认识[4]。目前国内外对于SHI患者的EN支持已经达到共识,即为保证肠道黏膜的完整性,减少肠源性感染的发生,应实施EN。本试验探讨SHI患者营养支持的合理方法,将EN在伤后早期实施于SHI患者,通过临床随机对照试验,在伤后急性期观测相关细胞因子在体液中的微观改变并结合临床观察,求证早期肠内营养(EEN)具有减轻创伤应激所导致的全身炎性反应,改善患者的预后。
1 资料与方法
1.1 一般资料 选择我院2011至2012年收治的SHI患者60例,男34例,女26例;年龄16~65岁。随机分为EEN组和早期完全肠外营养组(TPN)组,每组30例。患者入院后均常规留置胃管,营养支持均在受伤后24 h开始,研究期至伤后第7天。2组患者性别比、年龄、GCS评分等一般情况差异无统计学意义(P>0.05)。选择健康成人20例作为正常对照组(C组),其中男12例,女8例;年龄20~48岁,平均年龄38.3岁;均排除外伤、感染及重要脏器疾病。见表1。

表1 2组一般资料比较 n=30,例
1.2 入选标准 (1)患者经CT或MRI证实,并符合1995年全国第四届脑血管病诊断要点;(2)入院时GCS评分3~8分;(3)入院时间在伤后12 h以内;(4)既往无消化道应激性溃疡史、肝病、出血性疾病病史,而且伤后24 h内无消化道出血,无糖尿病及其他影响营养和代谢的内分泌疾病;(5)未合并休克或严重多发性器质性损伤;(6)住院时间>7 d;(7)胃肠道无复合伤,其他重要脏器无严重复合伤及休克,无插胃管禁忌证。
1.3 方法
1.3.1 主要仪器设备:全自动生化分析仪(日立7600-110,日本)、全自动全血细胞分析仪(Sysmex XT-2000i)、低温高速离心机(Thermo,美国)、一次性聚氨基甲酯鼻胃管(Nutricia,公司)、胃肠营养泵及配套营养输注管(袋鼠,美国)、Multiskan MK3酶标仪(Thermo,美国)。
1.3.2 主要试剂与药品:人TNF-α、CRP含量ELISA检测试剂盒(江苏希望生物技术公司)、力能脂肪乳(华瑞制药有限公司,中国)、维沃(美国诺华制药有限公司)、能全力营养液(Nutricia公司)、静脉营养液(本院药剂科配制)。
1.3.3 营养液配制及支持方法
1.3.3.1 肠内营养液配方及主要成分:EEN组营养液第2、3天选用维沃肠内营养液(营养以水解蛋白形式存在,不经胃肠道消化即可吸收,每100毫升含能量100 kcal),第4~7天选用能全力肠内营养液,每100毫升含能量150 kcal,其中蛋白质6.0 g,碳水化合物18.4 g,脂肪5.83 g,膳食纤维 1.5 g,及矿物质、维生素等。
1.3.3.2 支持方法:所有患者入院后即常规留置鼻胃管,均选用聚氨基甲酸甲酯鼻胃管。按25 kcal·kg-1·d-1提供非蛋白能量,按氮 0.2 g·kg-1·d-1供给蛋白。2组的蛋白质、脂肪、糖的比例基本相当。①EEN组:按计划在伤后24 h开始逐步实施EEN。肠内营养液经胃肠营养泵持续泵入,以600 ml开始,视个体不同情况每天以300~400 ml递增直至全量。②TPN组:伤后24 h采用完全肠外营养支持治疗,7 d后逐步过渡到肠内营养。全静脉营养混合液中葡萄糖质量浓度为250 g/L,脂肪乳剂质量浓度为100 g/L,由复方氨基酸供氮,非蛋白质热卡(NPC)∶氮=150∶1;并加入适量微量元素、维生素、水、电解质。经中心静脉导管24 h均匀滴注,7 d后逐步改为肠内营养。
1.4 评价指标
1.4.1 血清TNF-α和CRP测定:分别于伤后7 d每天晨7∶00,经股静脉采集静脉血约2 ml于不加抗凝剂的干燥试管内,室温下放置2 h后,3 000 r/m下离心15 min后分离上层血清,置-20℃环境下保存。血样采集方法同试验组,用ELISA法测定TNF-α和CRP值,严格按照试剂盒说明进行操作。
1.4.2 其他指标:每天记录体重(BW)、血糖(GLU),每天查血常规及外周血淋巴细胞值比较2组伤后7 d内血糖、外周血淋巴细胞数,伤后第1、3、7天血清总蛋白(TP)及氮平衡等营养指标,同时观察2组患者在治疗过程中并发症情况和胃肠道反应发生情况。
1.5 统计学分析 应用SPSS17.0统计软件,计量资料以±s表示,采用独立样本t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者血清TNF-α比较 EEN组第4天的TNF-α值与 C组相比升高(P <0.05);而 TPN组TNF-α值在第4、7天显著高于C组(P <0.01);EEN组第7天低于TPN组 (P <0.05)。见表2。
表2 2组患者血清TNF-α比较ng/ml,±s

表2 2组患者血清TNF-α比较ng/ml,±s
注:与TPN组比较,*P <0.05;与C组比较,#P <0.05,△P <0.01
组别 第1天 第2天 第3天 第4天 第5天 第6天 第7天EEN组(n=30) 1.03±0.26 1.10±0.17 1.14±0.14 1.20±0.23# 1.21±0.15* 1.18±0.17* 1.16±0.27*TPN组(n=30) 1.16±0.33 1.19±0.16 1.22±0.14# 1.38±0.19△ 1.40±0.15△ 1.41±0.15△ 1.43±0.14△C组(n=20) 0.79±0.23 0.77±0.31 0.78±0.11 0.79±0.29 0.78±0.15 0.77±0.25 0.79±0.20
2.2 2组患者血清CRP比较 所有颅脑损伤患者伤后24 h内CRP即升高达峰值,随着病情的好转,并逐渐下降,到伤后7 d时仍维持在较高水平,与C组比较,均明显升高(P<0.01)。2组的CRP含量随时间变化均呈下降趋势,并且EEN组CRP含量下降幅度更大。但2组给予营养治疗前,血清CRP含量差异无统计学意义(P>0.05)。见表3。
表3 2组患者血清CRP比较mg/L,±s

表3 2组患者血清CRP比较mg/L,±s
注:与TPN组比较,*P <0.05,#P <0.01;与C组比较,△P <0.01
组别 第1天 第2天 第3天 第4天 第5天 第6天 第7天EEN组(n=30) 59.5±6.6△ 57.5±6.0△ 54.2±5.9△ 51.3±5.1△ 44.1±5.1△# 38.4±6.1#△ 33.5±4.2#△TPN组(n=30) 59.8±5.7△ 57.8±5.7△ 56.0±5.5△ 54.7±4.1△ 49.8±5.2△ 45.9±6.2△ 41.0±3.2△C组(n=20) 4.5±2.3 4.5±1.8 4.5±1.2 4.5±2.0 4.5±2.4 4.5±2.0 4.5±1.7
2.3 2组患者血糖比较 EEN和TPN 2组在伤后各时相点的血糖值均高于C组(P<0.01);2组间第1天血糖差异无统计学意义(P>0.05),第4天和第7天时EEN组血糖低于TPN组,差异有统计学意义(P <0.05)。见表4。
表4 2组患者血糖比较n=20,mmol/L,±s

表4 2组患者血糖比较n=20,mmol/L,±s
注:与C组比较,*P <0.01;与TPN组比较,#P <0.05
组别 第1天 第4天 第7天EEN组(n=30) 8.6±2.2* 7.2±2.3*# 5.4±1.0*#TPN组(n=30) 8.3±2.5* 7.9±1.9* 6.7±2.0*C组(n=20)4.1±1.1 4.1±0.9 4.1±1.3
2.4 2组患者检测学指标比较 摄入同等热能、同等氮量的条件下,伤后第7天EEN组血清白蛋白、血红蛋白以及总淋巴细胞计数均优于TPN组(P<0.05);体重丢失显著少于B组(P<0.05)。伤后第7天EEN组患者感染以及上消化道出血的发生率明显低于TPN组(P <0.05)。见表5。
表5 2组患者检测指标比较±s
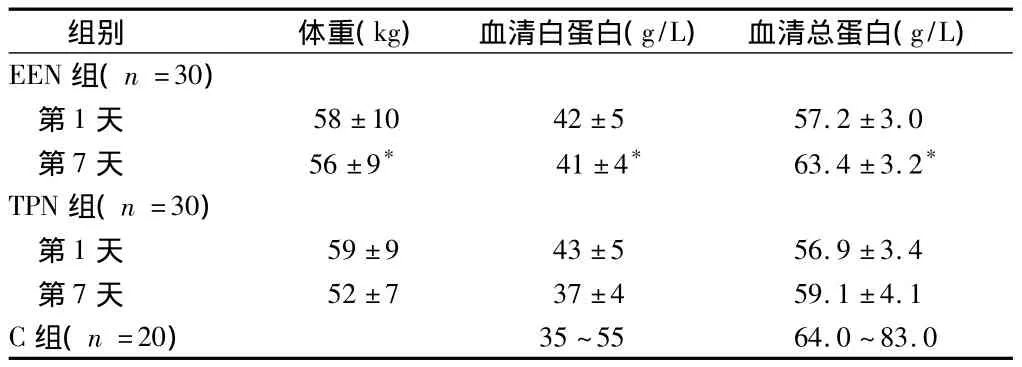
表5 2组患者检测指标比较±s
注:与TPN组比较,P <0.05*
组别 体重(kg) 血清白蛋白(g/L) 血清总蛋白(g/L)EEN组(n=30)第1天 58±10 42±5 57.2±3.0第7天 56±9* 41±4* 63.4±3.2*TPN组(n=30)第1天 59±9 43±5 56.9±3.4第7天 52±7 37±4 59.1±4.1 C组(n=20)35~55 64.0~83.0

表6 SHI 患者入院第7天并发症情况和胃肠道反应比较
2.6 SHI患者GCS评分比较 EEN组GCS评分比TPN组明显改善(P<0.05)。见表7。
表7 SHI患者GCS评分比较n=30,分,±s

表7 SHI患者GCS评分比较n=30,分,±s
注:与TPN组比较,*P <0.05
组别 第1天 第7天EEN组 6.4±1.4 11.8±2.4*6.5±1.4 10.1±2.5 TPN组
3 讨论
当今社会,SHI的发生率越来越高,如何提高SHI患者的生存率及预后质量越来越受到临床重视[2]。SHI患者营养不良使细胞能量代谢和高能磷酸化合物代谢紊乱,最终营养不良造成机体能量和物质储备减少,修复缓慢,免疫抑制,病死率增加[5]。根据SHI患者需要予以及时的营养支持是非常必要的,是颅脑损伤治疗方案中的重要部分[3]。
3.1 营养支持与应激性溃疡 应激性溃疡(stress ulcer,SU)可导致消化道出血、穿孔,并使原有病情恶化,影响原发疾病的治疗效果[6]。由颅脑病变引起的SU又称Cushing溃疡[7]。在机体受到致病因素作用后TNF-α最早产生,为炎性反应的启动物质,具有广泛的生物学作用,促使形成级联放大的瀑布效应,致使炎性反应过度。过量的TNF-α本身可引起消化道溃疡,它会启动凝血过程,产生小血管内凝血,加重局部胃肠道黏膜缺血、缺氧、坏死状况。同时它还以自分泌和旁分泌的形式局部作用及刺激炎性介质,间接损伤胃粘黏屏障。由此可见TNF-α在SU的发生发展中扮演着重要角色。
SHI患者伤后第1、4、7天3个时相点,2组的血清TNF-α值均高于C组。TPN组值在第4天急增至一较高点,随后继续缓慢上升,持续至第7天。EEN组的整体变化较为平缓,增高程度显著低于TPN组。本结果说明,EEN明显降低了伤后TNF-α快速增高的势头,减轻了创伤后的应激和炎性反应。同时TNF-α浓度的相对降低使得高浓度炎性介质和细胞因子导致的黏膜继发性损害减少[8]。
3.2 营养支持与炎性反应 急性期反应是一种内稳态机制,以保护创伤愈合所必须的代谢环境,其特征性表现是发热和白细胞增高,伴有高浓度的血中急性期反应蛋白和清蛋白水平降低。SHI急性期反应的重要特征之一是肝脏合成CRP增加,随着病情的稳定及炎性反应的消退,血清CRP的含量迅速下降[9]。检测颅脑损伤急性期血清CRP含量有助于评价颅脑损伤的程度及预后,并对治疗起到重要的指导作用[10]。本试验中所有颅脑损伤患者伤后24 h内血清中CRP含量即升高达峰值,随着病情的好转,并逐渐下降,到伤后7 d时仍维持在较高水平,至伤后14 d时仍高于正常,与正常对照组相比,均明显升高(P<0.01)。2组的CRP含量随时间变化均呈下降趋势,并且EEN组CRP含量下降幅度更大。
3.3 营养支持后部分临床观测指标变化
3.3.1 血糖变化:SHI后血糖的升高是应激反应的结果,是颅脑损伤后一个普遍的现象。血糖水平是判断脑损伤程度和预后的可靠指标[11]。本实验中2组患者伤后伤后各时相点的血糖值均高于正常水平(P<0.01),2组比较差异无统计学意义(P>0.05)。在进行不同的营养支持后,2组患者血糖值均呈下降趋势,EEN组血糖明显低于TPN组,差异有统计学意义(P<0.05)。有研究发现早期进食组较TPN组血糖值低,可减少危重患者并发症[12],与肠外营养相比更有助于控制血糖,这样即保证了对脑神经细胞的能量供应,又能避免高血糖引起乳酸堆积导致的损伤,有助于脑内正常物资的合成,促进神经功能的恢复,并能有效的控制应激性高血糖的发生。
3.3.2 2组患者部分血液检验学指标:SHI患者有50% ~70%合并继发感染,患者营养不良、低蛋白血症是导致机体免疫能力地下、易感性增加的重要因素。肠内营养可以改变机体在应激状态下出现的免疫抑制和蛋白代谢紊乱,增强机体免疫力,减少感染并发症。本实验结果表明EEN组患者血红蛋白和外周淋巴细胞总数明显高于对照组,EEN组血清总蛋白高于对照组,并且晚期并发症的发生率明显少于对照组,同时EEN组患者GCS评分在第7天时明显高于TPN组(P<0.05),这是由于EEN及时提供了能量,较好的控制了低蛋白血症;并且外周血淋巴细胞总数明显多于对照组,这是优于营养支持使T淋巴细胞生长分化所需的营养物质如转铁蛋白上升,从而促进了血中淋巴细胞的生长,增强了自身免疫功能,因此增强了机体的抗感染能力。
综上所述,对SHI患者采用早期、正规、合理的肠内营养支持是可行的,较好的满足了颅脑损伤患者营养和机体代谢的需要,能改善重型颅脑损伤患者的意识状态,有利于患者康复,可减少并发症,改善预后。
1 Sim SK,Lim SL,Lee HK,et al.Care of severe head injury patients in the sarawak general hospital:intensive care unit versus general ward.Med J Malaysia,2011,66:138-141.
2 Ahmad FU,Bullock R.Decompressive craniectomy for severe head injury.World Neurosurg,2011,75:451-453.
3 Alkhoury F,Courtney J.Outcomes after severe head injury:a national trauma data bank-based comparison of level I and Level II trauma centers.Am Surg,2011,77:277-280.
4 Eckerwall G,Andersson R.Early enteral nutrition in severe acute pancreatitis:a way of providing nutrients,gut barrier protection,immunomodulation,or all of them.Scand JGastroenterol,2001,36:449-458.
5 Xiao GM,Wei J,Wu ZH,et al.Clinical study on the therapeutic effects and mechanism of progesterone in the treatment for acute severe head injury.Zhonghua Wai Ke Za Zhi,2007,45:106-108.
6 Naka A,Badore PJ.Stress-ulcer prophylaxis:an overused therapeutic modality.Conn Med,2011,75:285-288.
7 Wondisford FE.A new medical therapy for Cushing disease.J Clin Invest,2011,121:4621-4623.
8 Ross SA,Halliday MI,Campbell GC,et al.The presence of tumour necrosis factor in CSF and plasma after severe head injury.Br J Neurosurg,1994,8:419-425.
9 Is M,Coskun A,Sanus GZ,et al.High-sensitivity C-reactive protein levels in cerebrospinal fluid and serum in severe head injury:relationship to tumor necrosis factor-alpha and interleukin-6.JClin Neurosci,2007,14:1163-1171.
10 Oconnor E,Venkatesh B,Mashongonyika C,et al.Serum procalcitonin and C-reactive protein as markers of sepsis and outcome in patients with neurotrauma and subarachnoid haemorrhage.Anaesth Intensive Care,2004,32:465-470.
11 Walia S,Sutcliffe AJ.The relationship between blood glucose,mean arterial pressure and outcome after severe head injury:an observational study.Injury,2002,33:339-344.
12 Van den Berghe G,Wouters P,Weekers F,et al.Intensive insulin therapy in critically ill patients.N Engl JMed,2001,345:1359-1367.

